动态增强扫描磁共振定量参数对卵巢肿瘤诊断价值
廖思蓬
浙江省温州市中西医结合医院(325000)
卵巢癌组织来源多样性,临床缺乏敏感、有效的检测方法,早期诊断困难,容易扩散转移、复发, 20%患者确诊时已处于中晚期[1]。早发现、早治疗对预后改善有极其重要意义[2]。妇科双合诊对早期卵巢癌检出效果有限[3],腹腔镜创伤性较大,影像检查在卵巢癌早期诊断、分期、疗效判断方面均有重要作用和价值,磁共振(MRI)具有优良组织对比度,可观察到不典型和复杂卵巢包块[4],可有效鉴别囊性和实性肿块。近年来随着MRI技术提高,动态增强扫描成像可以提供半定量和定量分析,对鉴别良恶性卵巢肿瘤、肿瘤恶性程度分级等有极大价值[5]。目前少有动态增强MR定量和半定量参数在卵巢肿瘤诊断的研究,鉴于此,本研究回顾性分析了82例卵巢肿瘤患者临床资料、卵巢肿瘤影像学特征,探讨动态增强MR定量和半定量参数对卵巢肿瘤的鉴别诊断价值。
1 资料与方法
1.1 一般资料
纳入标准:①MRI平扫和增强扫描图像质量能满足诊断需求;②卵巢肿瘤具有直径≥3mm强化实性成分;③术后病理检查资料完整。排除标准:①囊性肿瘤;②病理学检查结果缺失;③接受放疗、化疗患者;④图像质量较差。回顾性收集符合上述标准2010年1月—2018年5月本院收治的卵巢肿瘤患者临床资料82例,年龄(53.6±8.3)岁(49~68岁)。
1.2 动态增强扫描
仪器为西门子Verio 3.0T高磁场超导型MRI扫描仪,32通道相控阵线圈采集MR信号。患者取仰卧位,先进行两个不同翻转角度T1-mapping序列扫描,参数设置:重复时间(TR)/回波时间(TE):5.08/1.74ms值,层厚3.6mm,间隔:0.72mm,视野(FOV):260mm×260mm,矩阵:192×138,反转角度(Flip angle):2°、15°,采集时间75s、56s。应用VIBE序列进行动态增强扫描,参数设置:TR/TE分别为5.08/1.74ms值,层厚3.6mm,间隔:0.72mm,FOV:260mm×260mm,矩阵:192×138,Flip angle:15°,共采集35次,第2次采集结束后,用高压注射器经肘前静脉注入对比剂钆喷替酸葡甲胺(0.2ml/kg),2.0ml/s快速注射,每次采集时间9s,一次屏气完成。后行常规VIBE常规增强扫描:TR/TE 4.56/2.03ms,层厚3mm,间隔0.6mm, 层数72层,FOV 380×315mm,激励1次,矩阵320×240。
1.3 图像处理
所有采集图像资料传输至后台工作站,手动选取异常增强软组织区域为感兴趣区域(ROI),显示病灶最大增强幅度和时间,将时间-强度曲线(TIC)分为三类:Ⅰ型,卵巢病变实性成分呈轻度缓慢强化;Ⅱ型,卵巢病变实性成分呈早期中等持续强化;Ⅲ型,卵巢病变实性成分呈早期明显强化迅速下降。根据TIC曲线获得半定量参数:SI60%=(SIpost60s-SIpre)/SIpre×100.00%(SIpost60s是增强扫描60s病灶最大信号强度值,SIpre为增强扫描前信号强度值)、达峰时间(TTP200s:增强扫描后200s内信号强度达高峰时间)。定量参数:采用Siemens TISSUE 4D软件包根据增强扫描前采集两个翻转角T1-mapping序列计算获得基线T1值,并计算动态增强扫描后图像T1强化值。在Ktrans图、Kep图、Ve图上最高信号区域选择含病灶容积ROI,每个病灶选择两个ROI区,取区域定量参数平均值作为该病灶的定量参数。以上均由2名主治以上医师审片,取一致意见作为最终判断结果。
1.4 统计学分析
2 结果
2.1 病理诊断
本组82例共检出恶性卵巢肿瘤52例,浆液性囊腺癌26例,黏液性囊腺癌15例,支持细胞瘤9例,转移癌2例。良性肿瘤30例,其中卵泡膜纤维瘤15例,卵泡膜细胞瘤10例,囊性腺纤维瘤5例。
2.2 不同性质卵巢肿瘤TIC类型对比
良、恶性卵巢肿瘤TIC分类存在差异(P<0.05),良性组以Ⅰ型、Ⅱ型为主,恶性组以Ⅱ型、Ⅲ型为主,见表1。
2.3 不同性质卵巢肿瘤半定量参数对比
良性肿瘤组TTP200s高于恶性肿瘤组(P<0.05),SI60%低于恶性肿瘤组(P<0.05),见表2。
2.4 不同性质卵巢肿瘤定量参数对比
恶性卵巢肿瘤者Ktrans、Kep、Ve值高于良性肿瘤者(P<0.05),见表2。
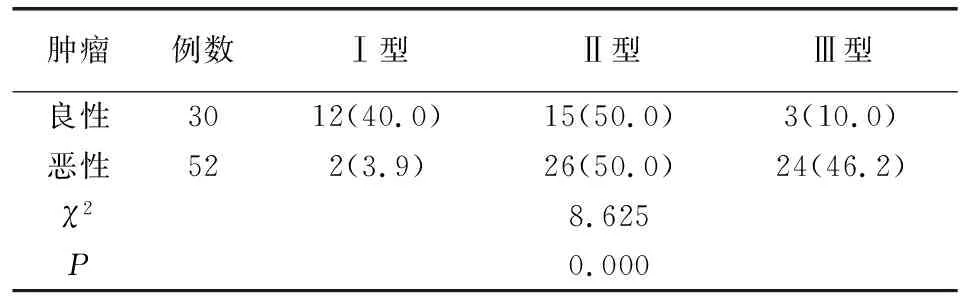
表1 不同性卵巢肿瘤 TIC分型[例(%)]

表2 不同性卵巢肿瘤参数值比较
2.5 各参数对卵巢肿瘤的诊断价值
ROC分析SI60%、TTP200s、Ktrans、Kep、Ve诊断卵巢肿瘤的曲线下面积分别为0.780(95%CI:0.664~0.897,P=0.000)、0.869(95%CI:0.765~0.973,P=0.000)、0.922(95%CI:0.853~0.991,P=0.000)、0.808(95%CI:0.699~0.917,P=0.000)、0.872(95%CI:0.768~0.976,P=0.000),见图1。SI60%、TTP200s、Ktrans、Kep、Ve诊断卵巢肿瘤的最佳效能见表3。

表3 各参数对卵巢肿瘤的诊断价值(%)
3 讨论
卵巢癌是女性常见恶性肿瘤,血清CA125检测、阴道超声检查是卵巢恶性肿瘤筛查的主要手段。但CA125特异性较差,阴道超声检查敏感性高于CA125但存在一定假阳性;妇科双合诊对早期卵巢癌检出效果有限,腹腔镜可明确肿瘤分期、判断疗效,但创伤性较大。MRI具有高空间、软组织分辨率,清晰显示盆腔结构,对比增强磁共振根据信号强度有效区分组织类型和成分,可鉴别超声难以鉴别卵巢肿瘤性质。但常规MR平扫或增强扫描均依赖于对肿瘤形态上的主观判断,缺乏量化指标,难反应早期肿瘤微小病变,因此难以通过单纯形态学特征准确判断良恶性卵巢肿瘤[6-7],动态增强MR扫描可获取量化参数,根据强化程度反映血供情况,判断肿瘤成分[8],同时可提高对微小病灶检出率、定性能力、明确肿瘤分期,适用于颅脑、胸腹部肿块,占位性病变以及血管性疾病诊断。
半定量参数主要通过描述感兴趣区内组织信号曲线的形状和结构来获得,TIC已经被广泛应用于乳腺癌、前列腺癌等良恶性肿瘤的鉴别诊断中[9-10]。本研究结果显示良恶性卵巢肿瘤TIC曲线具有明显差异性,良性组以Ⅰ型、Ⅱ型为主,恶性组以Ⅱ型、Ⅲ型为主。分析原因为良恶性卵巢肿瘤病灶内微血管密度差异化导致,恶性卵巢肿瘤新生微血管数量多,血管网丰富,血流容量多,速度快,因此在增强扫描图上呈现快进快出趋势;而良性卵巢肿瘤新生血管数量少,因此在对比剂注入后呈现缓慢上升趋势,或居高不下。但是单独依靠TIC分型并不能作为诊断良恶性卵巢肿瘤,比如,粘液性腺癌可能表现为缺乏血管,硬化性间质肿瘤则出现丰富的血管网,因此为提高诊断准确率需结合半定量参数。SI60%指强化60s曲线下面积,代表对比剂进入肿瘤血管的速率,主要通过TIC获得,操作简单,本研究以SI60%和TTP200s为半定量参数指标对卵巢肿瘤进行鉴别诊断,发现恶性组SI60%较高,说明恶性肿瘤灌注增加,对比剂浓度较高;恶性组TTP200s较低,考虑为恶性肿瘤具有丰富新生血管,血管通透性大,因此对比剂可快速渗透间质空间。本研究提示SI60%、TTP200s对卵巢肿瘤有较高诊断价值。
定量参数是用复杂的药代动力学模型推导的,Ktrans值最重要的定量参数,指对比剂从血管转运到组织间隙的能力,反应肿瘤组织毛细血管通透性[11],Ktrans值越高,组织血流量越高,恶性程度越高;Kep指对比剂从组织间隙转移到血管内的能力,Ve反应ROI组织坏死及组织细胞化程度[12]。本研究恶性卵巢肿瘤患者Ktrans、Kep、Ve值高于良性组,Ktrans值高说明恶性肿瘤血管渗透性高于良性组,恶性肿瘤新生血管发育不完全、脆弱[13-14];同时新生血管缺乏肌肉外套,通透性高,Ktrans值明显增高。Kep值增高说明对比剂在血管外高浓度前提下反流入血管内增多。郭永梅等[15]研究高分化子宫内膜癌Ktrans值、Kep值、Ve值均小于低分化组,说明Ktrans值、Kep值及Ve值有助于判断肿瘤病理分化程度。本研究ROC分析显示诊断良恶性卵巢肿瘤Ktrans诊断效能最高,当Ktrans>0.235时诊断良恶性卵巢肿瘤的灵敏度、特异度分别达到87.5%、92.4%,说明定量参数对卵巢肿瘤的鉴别诊断具较高价值。
综上,本研究发现动态增强扫描半定量参数SI60%、TTP200s和定量参数Ktrans、Kep、Ve在良恶性卵巢肿瘤中差异显著,对鉴别诊断良恶性卵巢肿瘤具有较高价值,可作为鉴别诊断良恶性卵巢肿瘤的有效影像学指标。

