8-羟基脱氧鸟苷高特异性ELISA检测方法的建立及其用于妊娠期糖尿病的对比研究
邱 月 安莉莎 曹小芳 杜 蒙 高 丹 张 辰 王启迪 马 旭*
1.北京协和医学院研究生院(100730);2.国家卫生健康委科学技术研究所
8-羟基脱氧鸟苷(8-OHdG)作为一类稳定的DNA氧化产物,与多种氧化损伤相关疾病进程具有相关性,目前已成为DNA氧化损伤中最常用的生物标志物[1-3]。在临床上作为一种生物标志物可以辅助相关疾病的诊断或反映相关疾病的进程。妊娠期糖尿病(GDM)发病机制研究表明其与氧化应激有着密切的联系[4-5]。因此有研究推断8-OHdG与GDM的疾病进程可能存在一定的联系[6-7],提示对于8-OHdG水平的监控可能对临床上早期诊断GDM以及制定后续治疗方案有一定的积极作用。本研究尝试建立具有特异性良好的检测8-OHdG的方法,用于检测孕妇血清8-OHdG水平,探讨GDM与血清8-OHdG水平的关系。
1 材料与方法
1.1 主要材料
59份GDM血清样本和59份健康孕妇血清样本为人类遗传资源中心样本库提供 (2010年—2015年收集);Balb/c小鼠购自北京维通利华实验动物有限公司;小鼠骨髓瘤细胞系购自北京康为世纪生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂、抗体亚型测定试剂盒均购自Sigma公司;8-OHdG mcKLH购自Thermo Fisher Scientfic公司;其他各类试剂和培养液均购自美国Gibco公司和Corning公司。
1.2 检测方法的建立
1.2.1合成抗原8-OHdG-mcKLH本研究使用EDC法将8-OHdG与钥孔血蓝蛋白(mcKLH)偶联形成了8-OHdG-KLH复合物,取2mg的mcKLH溶于2ml ddH2O中 ,形成A溶液;取8-OHdG 5mg 溶于50μl DMSO中,形成B溶液;称取0.011g EDC溶于1100μl ddH2O中,形成C溶液;取500μl A溶液与B溶液混匀后迅速加入125μl的C溶液,将混合液置于摇床,室温180rpm 2h;混合液4℃透析2~3h,换2次PBS后过夜;次日将混合液储存于EP管内,标记浓度5mg/ml备用,置-20℃冰箱保存。
1.2.28-OHdG抗体的制备采用8-OHdG-mcKLH免疫原对6只Balb/C小鼠进行腹腔免疫,经过4次免疫后,隔7d断尾采血,第4次加强免疫前取小鼠尾血,间接ELISA法检测小鼠体内8-OHdG抗体。选取效价高的小鼠进行细胞融合实验。融合后每日观察,将细胞数量较多的培养基保存ELISA检测筛选阳性细胞株,用有限稀释法将细胞进行克隆,最终得到能够稳定分泌抗8-OHdG的单克隆抗体的杂交瘤细胞株。小鼠腹水体内诱生法制备大量单克隆抗体,硫酸铵盐析法结合蛋白质A亲和层析柱纯化法纯化腹水抗体。
1.2.3阳性克隆抗体亚型鉴定结果及腹水效价测定确定1D4、3B8、4G3、5C10、8E9、7D5、8D9的抗体作为腹水生产细胞株,制备腹水小鼠7只,10d后收集腹水,行纯化和腹水效价检测。腹水单克隆抗体的效价以间接ELISA方法测定。其中选择了抗体效价较高的1D4(1:320000)和3B8(1:400000)抗体。其中1D4的亚型为IgG1 /κ,3B8的亚型为IgG2a/κ。
1.2.4配对抗体的筛选釆用抗体类型及亚类鉴定ELISA试剂盒(Southern Biotech公司),实验步骤按照试剂盒说明书操作,对已纯化到的抗体进行分型检测,并以8-OHdG为抗原进行包被,间接ELISA法测定抗体的效价。将鸟嘌呤(G)、鸟苷(GR)、8-羟基鸟苷(8-OHG)、尿素(U)分别作为包被抗原,间接ELISA法对抗体进行交叉反应性分析。
1.2.5生物素-亲和素ELISA的方法的建立制备3B8生物素化抗体,将2mg/ml的8-OHdG抗体1D4包被,100μl/孔,用碳酸盐缓冲液包被抗体,4℃孵育过夜;洗板后, 加入封闭液200μl/孔, 室温封闭2h,洗板晾干;加入样本(1:1000稀释)以及8-OHdG标准品100μl/孔加入96孔板, 室温孵1h;加生物素化抗体3B8(1:40000稀释), 在洗板后100μl/孔加入96孔板, 室温孵1h;洗板后加入显色液100μl/孔, 室温避光孵育15 min;加入终止液100μl/孔,反应30min内读取吸光度值(450nm)。
1.2.6建立标准品通过建立8-OHdG不同浓度之间与OD值的关系模型,从数学关系模型中选择线性较好的部分进行R2值的计算,从而缩小8-OHdG浓度检测范围并再次检测直至得到较高的R2值。
1.2.7回收率实验利用回收率实验评价方法的精密度与准确度。 取1份由8份血清混合的样品(市售试剂盒检测3次平均浓度为9.5ng/ml)分成3等份,分别加入3种不同浓度的8-OHdG抗原标准品(浓度分别为7.5,10,8ng/ml),检测其实际浓度(平行检测3次平均值),计算回收率。
1.2.8重复性实验批内实验:将3份不同浓度(10.3,7.58,4.06ng/ml)的血清样本(本室测得), 在同一酶标板上检测6次,检测得出3种血清浓度样本的批内变异系数(CV)。批间实验:将3份不同浓度(10.3,7.58,4.06ng/ml)的血液样本(本室测得)在3种不同酶标板上进行检测,得出3种血清样本的批间CV。
1.3 样本检测
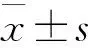
2 结果
2.1 交叉反应
根据各单抗腹水的亚型鉴定结果,选择了1D4与3B8不同亚型的抗体。对8-OHdG及其类似物的进行交叉反应。将抗体1D4、3B8对8-OHdG的反应率设定为100%,抗体1D4与8-OHdG类似物鸟嘌呤(G)、鸟苷(GR)、8-羟基鸟苷(8-OHG)、尿素(U)的交叉反应率分别为15%、11%、10%和10%,抗体3B8分别为80%、36%、26%和20%。抗体1D4、3B8与尿素的交叉反应率分别为10%和20%。
2.2 抗原标准品浓度范围
如图1所示,当8-OHdG的浓度在1.56~100 ng/ml时,8-OHdG浓度与OD值成线性相关,其相关系数R2值为0.9947。
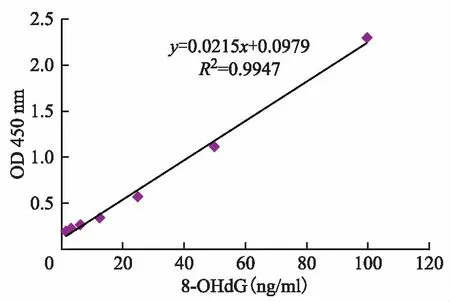
图1 8-OHdG抗原标准曲线
2.3 批内批间重复性实验
3种血液样本批内CV分别为1.8%,2.4%,6.3%;批间CV分别为9.7%,9.0%,10.1%。批内与批间CV均<15%。
2.4 回收率实验
回收率试验结果见表1。
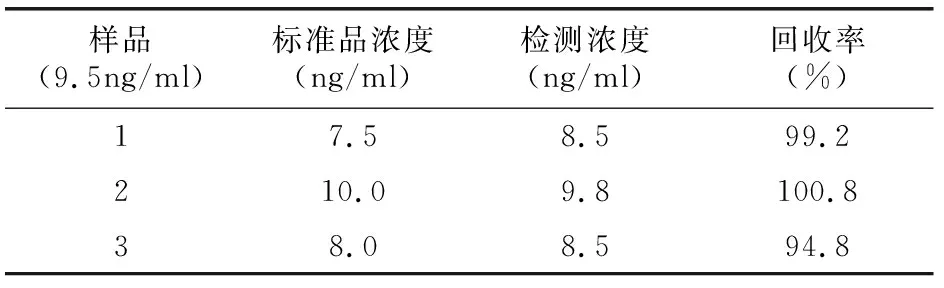
表1 回收率实验结果
2.5 GDM患者及健康孕妇检测结果比较
GDM组孕妇8-OHdG血清水平(7.3±1.3)ng/ml,正常对照组(2.2±0.7)ng/ml, 两组有差异(P<0.001)。
3 讨论
本研究通过优化后的偶联方法,得到了免疫效果较高的8-OHdG-mcKLH 抗原复合物,随后进行小鼠免疫,腹水制备,抗体纯化等,最终获得一对8-OHdG的特异性的配对抗体。由于实验结果中抗体1D4与鸟嘌呤的交叉反应率为15%,而抗体3B8与鸟嘌呤的交叉反应率为80%,推测抗体1D4和抗体3B8分别结合在8-OHdG的不同部位,可以作为配对抗体建立ELISA检测方法并对8-OHdG进行识别。另外,抗体1D4、3B8与尿素的交叉反应率较低,说明尿液中的氨不会对检测结果造成较大影响,因此本检测方法不仅可以用于血液样本的检测,也适用于尿液样本的检测。此外,该配对抗体也可用于氧化损伤方向的联合免疫诊断试剂的开发,为氧化损伤检测领域提供技术基础。
由于每个亲和素能结合4个分子的生物素,通过生物素与亲和素之间的放大作用,可以使检测方法更灵敏[8]。生物素与亲和素结合稳定性好、专一性强,不受试剂浓度、 pH环境或蛋白变性剂等有机溶剂影响,这一特点可以用于构建一个多层次信号放大系统[9]。本研究利用单克隆抗体技术,制备出8-OHdG的特异性抗体后,建立的生物素-亲和素标记的双抗夹心ELISA定量检测8-OHdG的方法,为研究氧化损伤与疾病关系提供了更为准确、便捷的检测方法。
利用建立起来的生物素-亲和素双抗夹心ELISA定量检测8-OHdG方法,对59份GDM患者及59份健康孕妇血清进行检测,发现GDM患者的8-OHdG水平远高于健康人群,提示8-OHdG血清水平与妊娠期糖尿病可能有一定相关性。

