2019年8月美国、欧盟和日本新批准药物概述
孙友松
(上海递鸽医药科技有限公司,上海 201210)
1 2019年8月美国FDA新批准药物

2019年8月,美国FDA共批准11个新药,包括5个全球首次批准的新分子实体[盐酸吡昔替尼(pexidartinib hydrochloride,1)、普托马尼(pretomanid,2)、酒石酸乌帕替尼(upadacitinib tartrate,3)、非屈替尼(fedratinib,4)、来法莫林(lefamulin,5)]、3个美国首次批准的新分子实体、1个新复方和2个新增适应证药物(见表1)。
1.1 盐酸吡昔替尼
盐酸吡昔替尼是一种CSF1R抑制剂、FLT3抑制剂和c-Kit原癌基因蛋白抑制剂,由第一三共公司研发,研发代号PLX-3397,商品名为Turalio®。2019年8月2日,美国FDA批准盐酸吡昔替尼用于治疗不宜通过手术治疗的症状性腱鞘巨细胞瘤[1]。FDA批准盐酸吡昔替尼时附加了一个黑框警告,提示盐酸吡昔替尼可能导致可致命的肝损伤,用药前医疗人员需对患者开展较全面的肝功能检查。该药曾获美国FDA和欧洲药品管理局(EMA)授予的孤儿药资格和美国FDA授予的突破性疗法认定资格。
盐酸吡昔替尼此次获得美国FDA加速批准基于1项随机Ⅲ期临床研究(ENLIVEN研究,NCT02371369)结果。研究共招募120例症状性腱鞘巨细胞瘤受试者,随机分为2组,一组接受盐酸吡昔替尼治疗(n=61),另一组接受安慰剂对照药治疗(n=59),评价盐酸吡昔替尼的安全性和有效性。研究的主要终点指标是治疗第25周的总生存率(overall response rate,ORR),研究结果显示,盐酸吡昔替尼治疗组的ORR为39%,而安慰剂对照组的ORR为0%[2]。
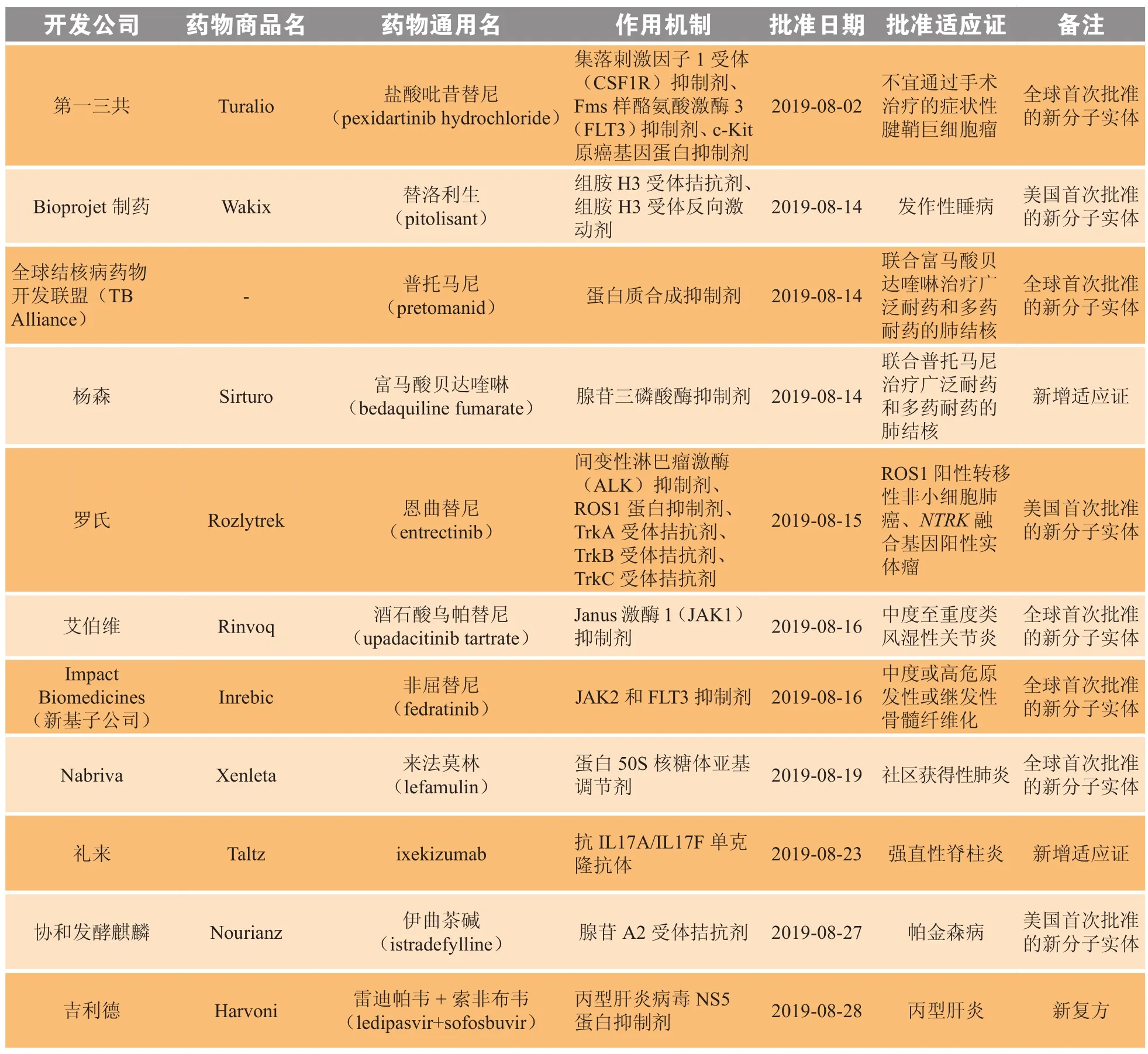
表1 2019年8月美国FDA新批准药物Table 1 New drugs approved by FDA in August 2019
1.2 普托马尼
普托马尼是一种蛋白质合成抑制剂,由全球结核病药物开发联盟(TB Alliance)和诺华制药公司合作开发,研发代号为PA 824。2019年8月14日,美国FDA通过抗菌和抗真菌药物的有限人群使用途径(Limited Population Pathway for Antibacterial and Antifungal Drugs,LPAD)批准普托马尼与贝达喹啉和利奈唑胺组成联合治疗方案(BPaL方案),用于治疗广泛耐药和多药耐药的肺结核[3]。TB Alliance已将该药在中国的商业化权利授予复星医药子公司星泰医药,目前该产品正在国内开展临床研究。
普托马尼此次获得美国FDA批准基于1项在南非开展的开放性Ⅲ期临床研究(Nix-TB研究,NCT02333799)结果。Nix-TB研究共招募109例广泛耐药和多药耐药的肺结核患者,治疗6个月后,107例受试者中的95例(88.78%)治疗成功,大大超过了广泛耐药和多药耐药肺结核的历史治疗成功率[4]。此外普托马尼还在超过14个国家约1168例受试者中开展了多项广泛耐药和多药耐药肺结核相关临床研究。
1.3 酒石酸乌帕替尼
酒石酸乌帕替尼是一种JAK1抑制剂,由艾伯维公司研发,研发代号ABT-494,商品名为Rinvoq®。2019年8月16日,美国FDA批准酒石酸乌帕替尼用于治疗中度至重度类风湿性关节炎[5]。该药获得了美国FDA的优先审评资格,其治疗中度至重度特应性皮炎的适应证还获得了美国FDA突破性疗法认定资格。
酒石酸乌帕替尼此次获得美国FDA批准基于5项Ⅲ期SELECT系列临床研究(SELECT-EARLY研 究,NCT02706873;SELECT-MONOTHERAPY研究,NCT02706951;SELECT-COMPARE研究,NCT 02629159;SELECT-NEXT研 究,NCT02675426;SELECT-BEYOND研究,NCT02706847)结果。研究结果显示,酒石酸乌帕替尼在5项临床研究中均达到主要临床终点和关键性次要临床终点[6]。
1.4 非屈替尼
非屈替尼是一种JAK2和FLT3抑制剂,由新基子公司Impact Biomedicines公司研发,商品名为Inrebic®。2019年8月16日,美国FDA通过优先审评批准非屈替尼用于治疗中度或高危原发性或继发性骨髓纤维化[7]。
非屈替尼此次获得美国FDA批准基于1项多中心、随机、双盲、安慰剂对照的Ⅲ期临床研究(JAKARTA研究,NCT01437787)结果,研究共招募289例受试者,随机分为非屈替尼500 mg治疗组(n = 97)、非屈替尼400 mg治疗组(n = 96)和安慰剂对照组(n = 96),评价6个疗程后经磁共振成像(MRI)或电脑断层扫描(CT)检测脾脏大小缩小35%以上的患者比例。临床研究结果显示,非屈替尼治疗组37%的患者脾脏大小缩小35%以上,而安慰剂对照组比例仅为1%,该研究结果达到临床主要终点[8]。
1.5 来法莫林
来法莫林是一种蛋白50S核糖体亚基调节剂,由Nabriva生物医药公司研发,商品名为Xenleta®。2019年8月19日,美国FDA批准来法莫林用于治疗社区获得性肺炎[9]。美国FDA曾授予来法莫林用于治疗社区获得性肺炎的快速通道资格、优先审评资格和合格传染病产品(Quali fied Infectious Disease Product,QIDP)资格,此外,美国FDA还授予来法莫林治疗皮肤和软组织感染的快速通道资格和QIDP资格。
来法莫林此次获得美国FDA批准基于2项关键性Ⅲ期临床研究(LEAP-1研究,NCT02559310;LEAP-2研究,NCT02813694)结果,2项研究共招募约1289例社区获得性肺炎患者,评价来法莫林相对于莫西沙星治疗社区获得性肺炎患者的安全性和有效性。2项研究结果均显示,来法莫林与莫西沙星相比,达到非劣效性,达到临床研究主要终点[10]。
2 2019年8月欧盟新批准药物
2019年8月,欧盟委员会(European Commission,EC)共批准7个新药,包括1个欧盟首次批准的新分子实体和6个新增适应证药物(见表2)。
3 2019年8月日本新批准药物
2019年8月,日本厚生劳动省(Ministry of Health,Labour and Welfare,MHLW)共批准7个新药,均为新增适应证药物(见表3)。

表2 2019年8月欧盟新批准药物Table 2 New drugs approved by European Commission in August 2019

表3 2019年8月日本新批准药物Table 3 New drugs approved in Japan in August 2019

