外泌体透射电镜样品的制备方法
蔺 萌,王亚婷,朱美霖,雷宁静
(1郑州大学基础医学院形态学实验中心微生物与免疫实验室,郑州 450001;2郑州大学基础医学院免疫学教研室;*通讯作者,E-mail:lnj717@zzu.edu.cn)
外泌体(exosomes)存在于几乎所有正常或病理的组织细胞和培养细胞中,它是来源于细胞内溶酶体内陷形成的多囊泡。多囊泡的外膜与细胞膜融合,然后被释放到胞外基质中形成外泌体,现在主要指的是直径在40-100 nm的盘状囊泡[1]。目前,关于外泌体的研究越来越受到国内外的重视,自1983年首次被发现以来,其形成原因、组成成分[2]、分泌过程[3]和信号传导作用[4]以及相关的一系列功能逐渐被发现[5],外泌体的大小决定了其研究在超微结构的水平。现今最常用到的是电子显微镜尤其是透射电镜[6],而透射电镜样品制备方法的选择对最终样品观察有极大影响,因此选择一种适合的外泌体制备方法至关重要。透射电镜实验中组织和细胞等制备样品一般都采用超薄切片的常规制备方法,对于体积在微米级以下的生物样品则需要通过其他方法制备[7]。目前,已有很多文献报道中对超微结构在临床上的作用进行研究,其中外泌体的研究较为广泛[8,9]。本文主要以巨噬细胞外泌体为例总结出一种适用于外泌体等超微结构透射电镜样品的制备方法,选择最佳的制备条件以达到更好的观察效果。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 本研究所用外泌体来源于小鼠单核巨噬细胞RAW264.7;其余试剂有磷酸缓冲液(PB)、醋酸铀染色液(雅盛科技)等。
1.1.2 耗材设备 碳覆膜铜网(300目);恒温培养箱;超速离心机(Optima L-100K,美国);HT7700透射电子显微镜(HITACHI,日本)。
1.2 方法
1.2.1 外泌体的获取 培养小鼠巨噬细胞RAW264.7,以10个10 cm细胞皿细胞融合度达95%以上,数量约106-107个,收集细胞上清液,用0.22 μm的滤器过滤后加入超速离心管中,液体量超过2/3,4 ℃ 110 000g离心2 h;倒出上清液用PB重悬,液体量超过2/3,4 ℃ 110 000g离心70 min;倒出上清液,沉淀物用100 μl PB重悬,纳米颗粒跟踪分析技术(nanoparticle tracking analysis,NTA)计数外泌体浓度在5×1011/ml左右,加到200 μl EP管中,4 ℃保存备用。
1.2.2 样品制备及观察 将获取的外泌体(浓度在5×1011/ml左右)倍比稀释至少3个浓度梯度,稀释倍数分别为5倍、10倍、20倍;每个浓度各取10 μl滴加至碳覆膜铜网上,滴加时形成水滴样,样品吸附90 s,用滤纸吸去多余液体后晾干;染色时,每个铜网上滴加醋酸铀染色液10 μl,避光染色,染色时间30 s,用滤纸吸去多余液体,晾干;透射电镜下观察并拍照记录。
2 结果
结果显示,稀释倍数为5倍的铜网上外泌体的浓度为1.0×1011/ml左右,图中外泌体数量相对较多(见图1A),稀释倍数为10倍的浓度为0.5×1011/ml左右,图中外泌体数量相对较少(见图1B),稀释倍数为20倍的外泌体个数极少,已舍弃实验结果。透射电镜下可以观察到,铜网上的外泌体的膜结构完整,轮廓清晰,直径在100 nm左右,能明显看到圆盘状结构(见图1C、D)。因此,外泌体浓度控制在1.0×1011/ml左右观察效果更佳。
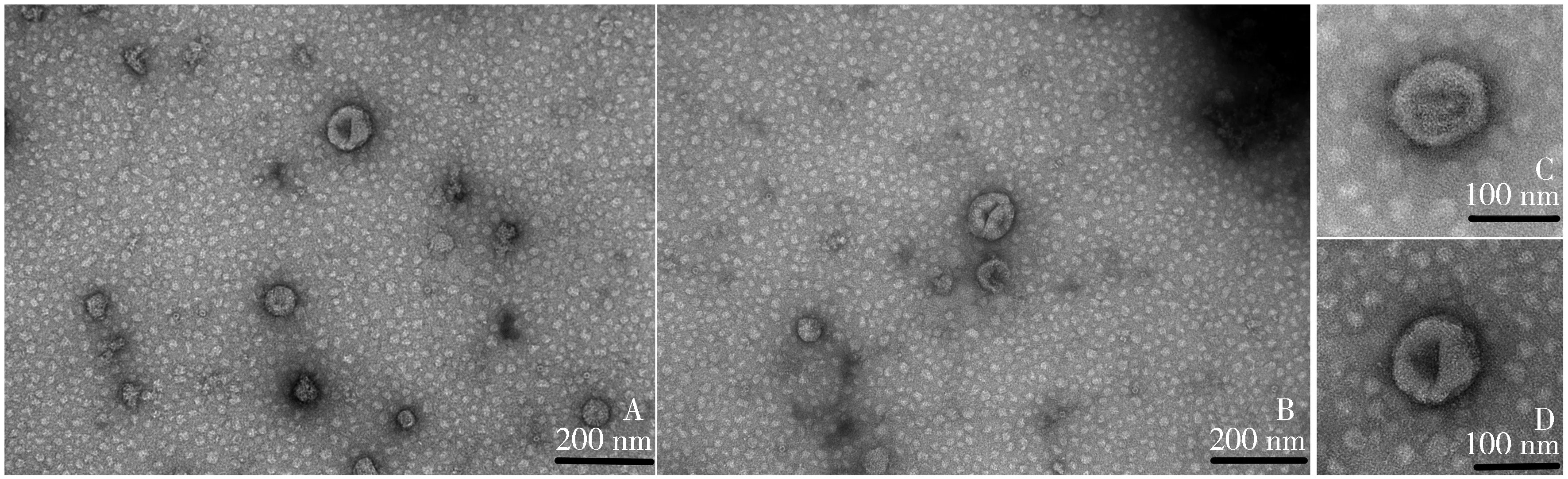
A.为200 nm下稀释5倍,浓度1.0×1011/mL左右的外泌体;B.为200 nm下稀释10倍,浓度0.5×1011/mL左右的外泌体;C、D.为100 nm下的外泌体图1 透射电子显微镜下的外泌体Figure 1 Exosomes under transmission electron microscopy(TEM)
3 讨论
在本研究中,采用超速离心法获取外泌体,其浓度较难控制,分多个梯度稀释(1倍、5倍、10倍、20倍、30倍、40倍、50),先进行预实验找到较为合适的浓度范围后再缩小到5倍、10倍、20倍3个梯度,这样能更节省时间、减少损耗,以便更有效地利用样品。通过比较4种不同孔目(200目、230目、300目、400)的铜网,结果发现300目的铜网较为合适,每个铜网上的样品10 μl,可根据样品浓度调节用量。液滴附着时间(预实验有30 s、60 s、90 s、120 s 4个时间范围)选择90 s,在液体表面张力的作用下,外泌体均匀分散在铜网上,时间过长易残留污渍,时间过短样品附着或分散不均。醋酸铀染液染色时间选择30 s,保证液滴边缘也能均匀染色,而时间过长或过短染色结果会出现黑团或泛白不着色的现象,影响结果观察。
相对于常规制备方法的固定、脱水、渗透、包埋、聚合、超薄切片等步骤需要至少1周的时间来说,本文采用的滴片法一般在几个小时到一天的时间即可观察,只需要经过吸附样品和负染,制备步骤简单,所用样品量、试剂很少,减少制剂污染,同时极大地节省了时间和成本,提高了实验效率[10];测量范围广,除外泌体外,本文中所用的悬滴法已经检测过核酸、小分子蛋白、人工合成蛋白、纤维、纳米材料[11]等超微结构样品;重复性好,在浓度不变的情况下,悬滴法制备的样品可以重复观测并观测效果误差很小;样品用量少,无需处理大量培养细胞即能获得所需样品量,降低试验成本。除外泌体外,对于核酸、细胞器、合成蛋白、生物膜等[12]亚细胞结构和小分子生物材料等也可用滴片法制备样品。
在生命科学研究中,组织和细胞等细胞水平的研究已经很广泛,而对于亚细胞或者亚显微结构的研究则主要集中在纳米等级,生物样品应用较多的透射电镜观察需要经过繁琐的制备步骤,所用制剂可能导致生物样本形态学上的改变,技术限制是其中的一个重要原因。cryo-TEM是一项应用于纳米结构观察的新技术,解决了生物样品脱水失活的问题以及不耐电子辐照损伤的问题,用于外泌体标本制作有其技术上的显著优势[13]。但是冷冻电镜技术需要的实验要求较高,而常规电镜已经非常普遍,应用也广泛,因此,从实验条件和实验成本上来考虑,在纳米级别的超微结构样品的透射电镜样品制备方法中,采用滴片法制备外泌体在目前来说仍是一种相对较好的制备方法[14],对于超微结构研究的真实性仍然具有十分重要的意义。

