甲状腺乳头状癌中异常甲基化基因筛查
曹一鸣,朱永学
复旦大学附属肿瘤医院头颈外科,复旦大学上海医学院肿瘤学系,上海 200032
甲状腺癌是临床最常见的内分泌系统恶性肿瘤,在全世界范围内约占全部恶性肿瘤的1%。近年来甲状腺癌的发病率在全球范围内以每年接近4%的速度迅速升高,已成为全球发病率增长最快的恶性肿瘤[1-4]。起源于甲状腺滤泡上皮细胞的恶性肿瘤占全部甲状腺癌的95%以上,主要包括甲状腺乳头状癌(papillary thyroid cancer,PTC)、甲状腺滤泡状癌(follicular thyroid cancer,FTC)及甲状腺低分化/未分化癌(anaplastic thyroid cancer/undifferentiated thyroid cancer,ATC/UTC),甲状腺髓样癌(medullary thyroid cancer,MTC)则起源于甲状腺滤泡旁细胞(C细胞)。甲状腺癌的发病目前认为与颈部放射线接触史、女性雌激素分泌等相关[5],临床诊断主要依赖医师的体格检查、甲状腺超声及细针抽吸细胞学检查,但良恶性肿瘤的术前鉴别仍存在一定困难。甲状腺癌的治疗以手术治疗和放射性131I治疗为主,辅以甲状腺激素抑制治疗,总体预后相对较好,其中最常见的PTC术后10年生存率可达90%以上,但临床上仍有部分病例侵袭性较强,容易出现淋巴结转移和复发[6-8]。目前临床上对甲状腺癌手术的范围、颈部淋巴结清扫的选择以及放射性131I治疗的适应证均存在争议。表观遗传学研究或许可以为我们提供甲状腺癌在早期诊断、治疗方案选择和预后评估方面的新思路。
近年来关于甲状腺癌的遗传学和表观遗传学研究逐渐增多,基因突变和甲基化改变在甲状腺癌发生、发展过程中可能发挥着重要作用。DNA甲基化是一种重要的表观遗传学的改变,它是指在DNA甲基转移酶作用下,将甲基添加到DNA分子CpG二核苷酸的胞嘧啶残基上,真核生物中CpG二核苷酸多存在于基因5’端启动子的CpG岛区域中,启动子CpG岛的甲基化改变具有调控基因表达、维持染色体完整性和调节DNA重组等作用[9]。因此在肿瘤细胞中,抑癌基因启动子的高甲基化改变可以使其表达降低,癌基因启动子的低甲基化改变可以使其表达升高,进而调控肿瘤的生物学行为,甚至可能直接导致肿瘤的发生。DNA甲基化是恶性肿瘤发生中的一种常见改变,反映了环境因素与遗传因素的相互作用,与遗传学改变不同的是DNA甲基化具有可逆性,通过药物治疗可以实现去甲基化,从而恢复抑癌基因表达,达到治疗肿瘤的作用,因此研究DNA的甲基化在肿瘤的发病机制、早期诊断和预后评估方面均具有重要意义[10]。
本研究致力于探索和发现在PTC中可能存在甲基化异常调控的基因,初步评估其在甲状腺癌发生、发展中可能发挥的作用,并且希望找到未来可用于早期诊断和预后评估的新的分子标志物。
1 材料和方法
1.1 材料
1.1.1 临床标本
收集2014年1月—2014年6月在复旦大学附属肿瘤医院头颈外科初治行甲状腺癌根治性手术的患者的甲状腺癌组织及癌旁的相对正常甲状腺组织共88对,所有标本均经病理组织学检查确诊为PTC,所有标本收集后置于-80 ℃冰箱保存,所有患者的临床和病理学特征见表1。

表1 标本临床数据统计Tab.1 Clinicopathological features of PTC patients
1.1.2 主要实验仪器和试剂
温度梯度PCR扩增仪购自美国Bio-Rad公司,生物电泳图像分析仪购自上海复日科技有限公司,紫外分光光度计购自美国NanoDrop公司,DNA提取试剂盒天根生化科技(北京)有限公司,DNA胶回收试剂盒购自美国Bio-Dev公司,PCR反应试剂盒JumpStart购自美国Sigma公司。
1.2 实验方法
1.2.1 DNA提取
取10 mg左右标本组织彻底剪碎,放入1.5 mL离心管中,加入180 μL缓冲液GA,在室温下放置使其充分混合。加入20 μL蛋白酶K,漩涡震荡混匀10 s。在56 ℃环境下水浴2 h,期间通过漩涡振荡混匀,待组织碎片完全消化后简短离心以收集附着在管壁及管盖的液体。加入200 μL的缓冲液GB和1 μL Carrier RNA储存液,充分颠倒混匀,70 ℃放置10 min,期间每3 min涡旋混匀10 s,简短离心以去除管盖内壁的液滴。加入200 μL无水乙醇,轻轻颠倒混匀样品,室温放置5 min,简短离心以去除管盖内壁的液滴。取上一步所得溶液全部转入吸附柱中,12 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中。向吸附柱中加入500 μL缓冲液GD,12 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中。向吸附柱中加入600 μL漂洗液PW,12 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中,重复1次,然后12 000 r/min离心2 min,倒掉上清液。将吸附柱置于室温放置2~5 min。然后将吸附柱转入一个干净的1.5 mL离心管中,向吸附膜中间位置悬空滴加50 μL洗脱缓冲液TB,室温放置5 min,12 000 r/min离心2 min将溶液收集到离心管中。通过紫外分光光度计检测其含量和纯度。
1.2.2 亚硫酸盐处理
取1 μg标本DNA加水至20 μL,加入3 mol/L的氢氧化钠溶液2.3 μL,充分混匀后置于37 ℃温浴15 min。加入亚硫酸盐试剂230 μL,充分混匀,置于90 ℃避光温浴30 min,简短离心以去除管盖内壁的液滴。将上一步所得溶液全部转入DNA胶回收试剂盒的吸附柱中,将吸附柱放回收集管中。向吸附柱中加入500 μL溶胶液,9 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中。向吸附柱中加入500 μL漂洗液,12 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中。加入0.3mol/L的氢氧化钠溶液300 μL,室温静置15 min,9 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中。向吸附柱中加入500 μL漂洗液,12 000 r/min离心30 s,弃上清液,将吸附柱放回收集管中,重复1次。将吸附柱置于室温放置5 min,然后将吸附柱转入一个干净的1.5 mL离心管中,向吸附膜中间位置悬空滴加75 μL洗脱缓冲液TB,室温放置5 min,12 000 r/min离心3 min,重复1次,将DNA溶液收集到离心管中。
1.2.3 甲基化特异性PCR技术(methylation specific PCR,MSP)
PCR反应体系:加入亚硫酸盐处理过的DNA溶液4 μL、10×PCR缓冲液2 μL、10 mmol/L dNTP 0.5 μL、上下游引物(5 pmol/L)各2 μL、Taq DNA聚合酶(0.05 U/μL)0.3 μL,最后补充ddH2O至20 mL。
扩增条件:94 ℃预变性3 min,94 ℃变性20 s,56~60 ℃(根据不同PCR片段的Tm)退火20 s,72 ℃延伸20s,循环35~36个周期,最后72 ℃延伸5 min。用2.5%琼脂糖凝胶电泳检测PCR产物。
每组PCR反应均包含阳性对照与阴性对照,阳性对照采用PTC组织提取的基因组DNA经5-氮杂胞苷甲基化处理再由亚硫酸盐处理制备而得,阴性对照采用ddH2O。RCP反应引物采用http://www.urogene.org/methprimer/的网上引物设计软件自行设计(MSP反应引物见表2)。
1.3 研究方法
1.3.1 PTC全基因组甲基化谱式建立
早期研究中通过对1株PTC细胞株、1例正常甲状腺组织和3对PTC组织及癌旁组织,行高通量甲基化DNA亲和纯化测序(Methylcap-Seq技术)初步建立甲状腺癌全基因组甲基化谱式,数据上传UCSC网站保存(http://genome.ucsc.edu/cgi-bin),通过生物信息学手段分析获得可能存在差异的基因位点。
1.3.2 可疑位点初筛
通过对UCSC网站上数据的主观分析,初步筛选出可疑存在异常甲基化的基因位点46个(表3)。筛选原则包括:①在基因启动子、增强子和第1外显子中;②在CPG岛中或岛旁;③与甲基化峰值区域吻合;④癌组织甲基化程度与癌旁正常组织存在显著差异。

表2 MSP引物序列Tab.2 Primer sequences of MSP
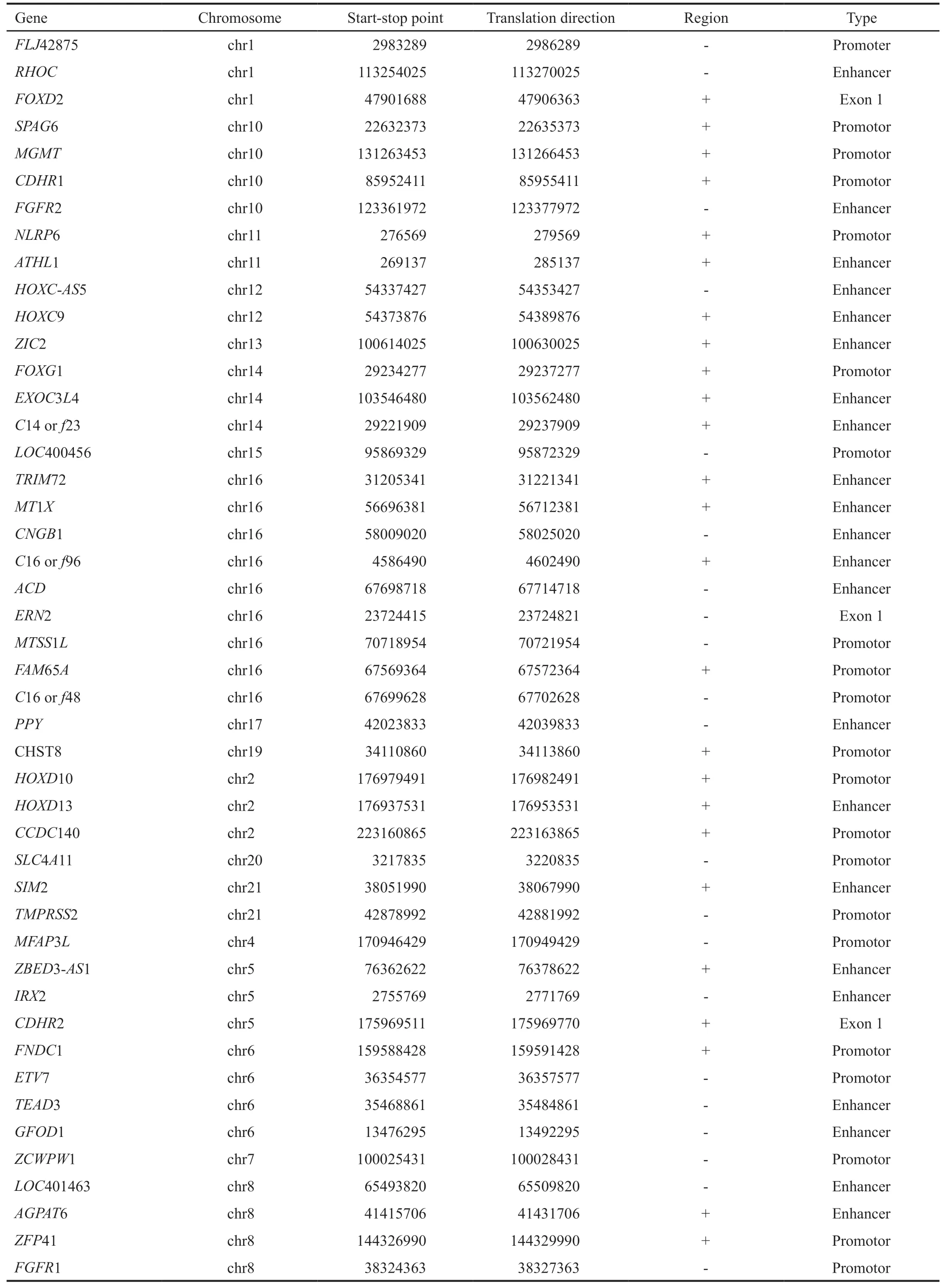
表3 初筛所得基因位点Tab.3 Aberrant methylation loci from screening
1.3.3 MSP筛查
针对初筛出的可疑基因位点分别设计MSP引物,用88对临床标本的DNA进行MSP反应检验,挑选癌和癌旁存在显著甲基化差异的基因位点,并分析基因甲基化与肿瘤临床特征的关系。
1.4 统计学处理
本研究使用SPSS 19.0软件进行统计学分析,采用χ2检验、logistic回归分析等,P<0.05为差异有统计学意义。
2 结果
根据前期工作Methylcap-Seq技术建立的甲状腺癌全基因组甲基化谱式(图1),通过生物信息学手段分析获得可能存在差异的基因位点1 856个,进一步根据主观数据分析,初步筛选出可疑存在异常甲基化的基因位点46个(表3)。
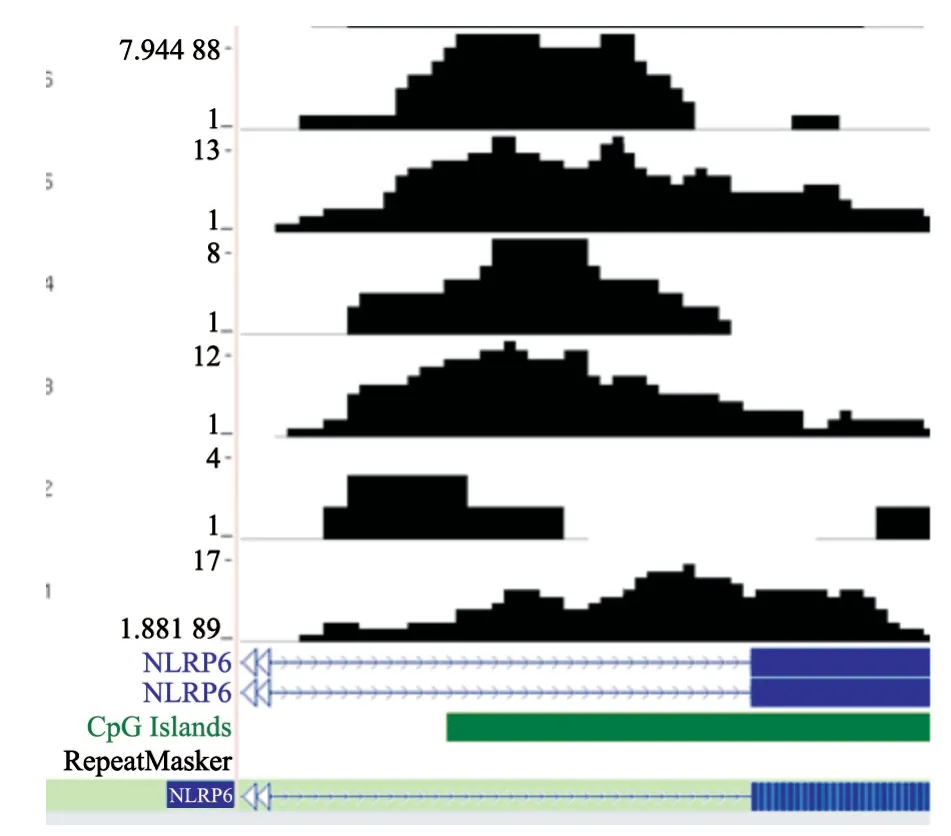
图1 甲状腺癌全基因组甲基化谱式图例Fig.1 The chromosome ideogram and methylation of NLRP6 by Methylcap-Seq
MSP结果最终提示HOXD10基因与FOXD2基因启动子区存在高甲基化改变:HOXD10基因在甲状腺癌组织中44.4%存在高甲基化改变,而在癌旁组织中仅20.5%(P<0.001);FOXD2基因在甲状腺癌组织中54.5%存在高甲基化改变,而在癌旁组织中仅38.6%(P<0.001)。其余基因位点MSP结果差异均无统计学意义(图2,表4)。

图2 MSP电泳图例Fig.2 Electrophoretogram of MSP
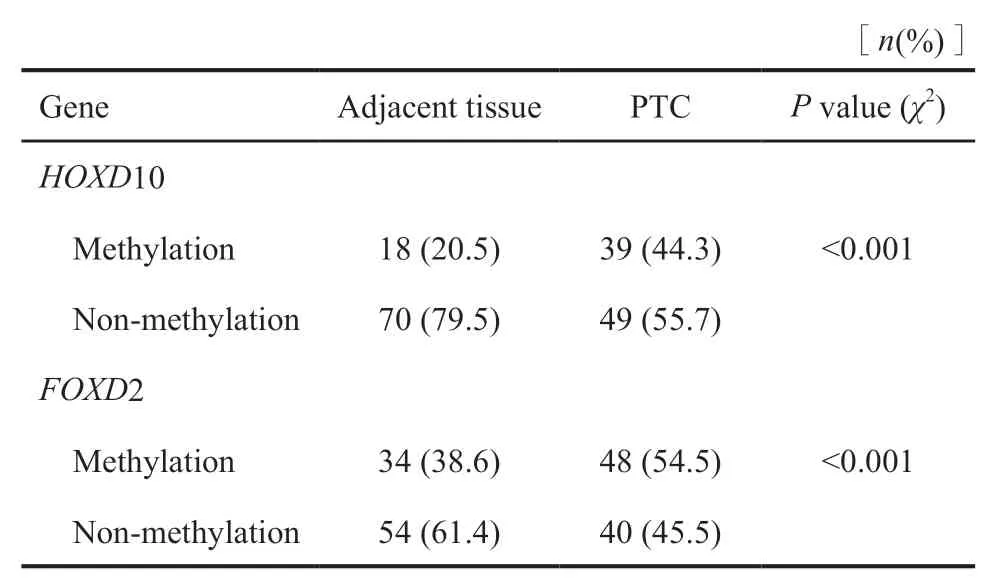
表4 HOXD10和FOXD2基因在甲状腺癌与癌旁组织的甲基化差异Tab.4 Difference in HOXD10 and FOXD2 methylation between PTC and adjacent tissue
分析HOXD10基因和FOXD2基因启动子高甲基化改变与患者临床特征(年龄、性别、原发灶大小、是否外侵、是否多灶、是否伴有桥本甲状腺炎、是否伴随颈部淋巴结转移)的相关性。HOXD10基因高甲基化改变与甲状腺癌病灶的多灶性相关(P<0.01,OR=3.71),FOXD2基因高甲基化改变与甲状腺癌病灶外侵相关(P<0.01,OR=5.91,表5)。
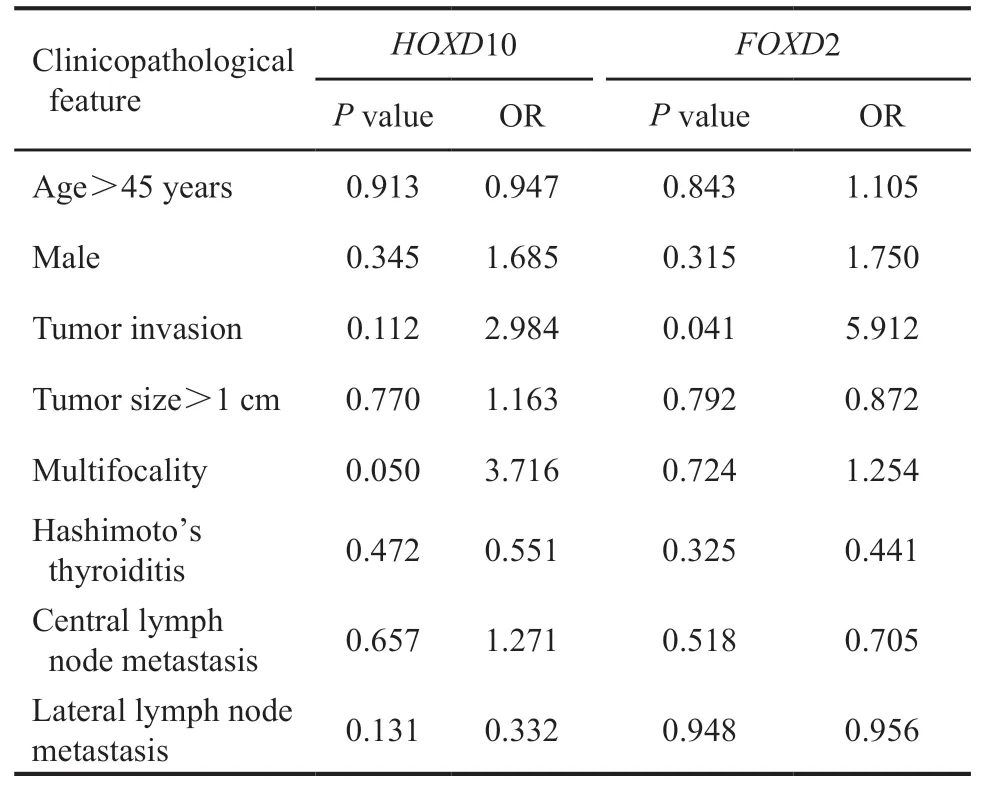
表5 HOXD10和FOXD2甲基化改变与患者临床病理学特征的相关性Tab.5 The relationship between methylation and clinicopathological features of PTC
3 讨 论
近年来PTC发病率迅速上升,成为人们关注的热点,但由于其预后相对较好,目前的研究方向多集中于甲状腺癌的早期诊断及预后评估[6,11]。甲状腺肿瘤的临床诊断主要依赖临床医师的体格检查和甲状腺超声,但难以区分良性和恶性肿瘤,细针抽吸细胞学检查是近年来开展的热门领域,对甲状腺癌术前诊断的灵敏度和特异性可达85%以上[12-13],缺点为有创性检查。另一方面虽然PTC的总体预后较好,但仍有部分患者出现反复复发,局部广泛转移以及131I治疗抵抗,临床上常称之为难治性PTC,目前临床上对这部分患者的鉴别是一个重要的课题。因而寻求一种甲状腺癌特异性的分子标志物成为我们关注的焦点,希望其可以在PTC的早期诊断、治疗方案选择和预后评估方面提供帮助。表观遗传学已成为研究恶性肿瘤发生、发展及其转归的一个新方向,其中DNA甲基化更是最常见的表观遗传学改变,在肿瘤学研究中占据重要位置。相对于遗传学研究,表观遗传学指标作为分子标志物的研究起步相对较晚,目前有研究表明,Rassf1A、TSHR、RARb2和TIMP3等抑癌基因和甲状腺特异性基因均在甲状腺癌中存在高甲基化改变和低表达调控,这与肿瘤发生、发展密切相关[14-16],但这些基因均缺乏特异性,难以作为分子标志物应用于诊断和预后评估。本研究希望通过筛查PTC中存在异常甲基化的基因来获取潜在的表观遗传学分子标志物。
本研究筛查1 856个可疑甲基化位点,最终确定HOXD10与FOXD2两个基因启动子区存在异常甲基化改变。HOXD10基因以往被认为是一种特异性的转录因子,主要在细胞分化和胚芽发育过程中发挥调控作用[17],几年来研究发现HOX家族基因在肿瘤形成和发展中发挥重要作用[18-19],部分基因(HoxB13、HoxA5、HoxC6等)已被证实在肺癌、乳腺癌、结肠癌中存在甲基化调控[20-22]。HOXD10基因也被证实在乳腺癌和胃癌中存在高甲基化改变。在甲状腺癌中目前未见HOXD10功能及甲基化调控方面的研究报道,本研究发现,HOXD10基因在PTC中存在高甲基化改变,并且与肿瘤发病的多灶性相关,推测该基因很有可能在PTC中同样发挥抑癌基因作用并受到甲基化调控,具体有待进一步实验验证。FOXD2基因是FOX转录因子家族的一员,FOX家族基因在胚胎发育过程中起着关键性的调控作用,与生长发育、免疫调控以及肿瘤的发生相关,FOXE1、FOXP1等被认为与基底细胞癌、乳腺癌和淋巴瘤发病密切相关[23]。FOXD2基因目前相关研究较少,有研究表明,在T淋巴细胞中,FOXD2基因通过调控cAMP通路依赖的蛋白激酶进而调节cAMP通路的敏感性[24],而cAMP通路正是甲状腺癌中的重要信号通路,与TSH的调控密切相关,推测FOXD2基因甲基化有可能通过cAMP通路调控PTC的发生、发展,具体有待进一步研究验证。
本研究旨在筛查出PTC中可能存在甲基化调控的基因位点。本研究的不足之处在于:第一,基因位点的选取上主观因素过多,必然存在偏差;第二,标本量不足,作为分子标志物的筛查理应尽量具备更充足的标本量,但限于时间和工作量只收集了88对样本进行检测,基因位点的筛选有可能存在遗漏和误差;第三,仅有甲状腺癌患者的标本,没有正常甲状腺组织对照,且标本均为术中收集,没有术前穿刺标本,因而对DNA甲基化的诊断预测价值难以做到客观评估;第四,标本收集过程中存在偏倚,由于大量甲状腺乳头状微癌病灶过小,难以取得足够的组织标本进行研究,因此研究对象中微癌患者比例较自然比例低;第五,MSP检验仅采用甲基化引物,而无非甲基化引物对照,由于本研究为筛查实验并非验证实验,因而仅关注其甲基化阳性结果而省略了非甲基化组的对照。
鉴于HOXD10与FOXD2基因在PTC中存在高甲基化改变,我们认为甲状腺癌的发生、发展可能受到HOXD10与FOXD2基因的甲基化修饰调控,HOXD10与FOXD2基因的甲基化修饰有望成为PTC特异性的分子标志物。

