口服维A酸联合复方黄黛片治疗非高危急性早幼粒细胞白血病的临床研究*
何秋连,刘 洋 ,魏 锦 ,邹兴立, 马春蓉, 曹 红
1.南充市中心医院 血液内科(南充 637000); 2.川北医学院附属医院 血液内科(南充 637000);3.四川省第五人民医院 血液内科(成都 610000 )
急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)是急性髓系白血病(acute myeloid leukaemia,AML)的一种特殊亚型,发病机制为特异性染色体异位t(15:17)(q22:21)形成特征性的PML-RARa融合基因,这种基因导致粒细胞分化停滞在早幼粒细胞阶段,使患者易出现弥散性血管内凝血(disseminated intravascular coagulation,DIC)而引起急性死亡[1]。近年来,随着我国血液工作者首次将维A酸(all-trans retinoic acid ,ATRA)联合三氧化二砷(arsenic trioxide ,ATO)的治疗模式应用于APL治疗中,使其从一种高危致死性疾病转化为不需要移植就可能治愈的疾病状态。非高危APL患者(白细胞计数≤10×109/ L)占APL80%左右。研究[2]表明,90%以上非高危APL患者可通过ATRA联合ATO或化疗治愈,几个大型研究中心通过临床试验[3-4]证明:对非高危APL选择ATRA联合ATO的非化疗方式也可使95%以上患者获得完全缓解而长期存活。至此,用于非高危APL治疗的ATRA联合ATO非化疗方案成为NCCN指南的一线推荐治疗方案[5]。ATO在我国俗称砒霜,其在白血病中的治疗模式被传统医学称之为“以毒攻毒”。20世纪70年代哈尔滨医科大学张亭栋教授等率先使用口服砷剂治疗APL患者,并取得满意疗效[6]。复方黄黛片(realgar-Indigo naturalis formula, RIF)是我国自主研发的口服砷剂代表方之一,该药的出现使非高危APL治疗实现了脱离静脉输液治疗的可能,为该类疾病的治疗提供了更光明的前景。本研究对南充地区38例接受不同治疗方法的非高危APL患者的治疗效果、不良反应及治疗总费用进行统计分析,以期对口服治疗模式的优越性进行论证。
1 资料与方法
1.1 临床资料
选取2014年1月至2018年11月南充市中心医院及川北医学院附属医院血液内科收治的38例非高危APL患者为研究对象,纳入标准:18~70岁;参照文献诊断标准[7]:细胞遗传学检测t(15∶17)易位或RT-PCR检测有特征性的PML-RARa融合基因且初诊时白细胞计数≤10×109/L,即诊断为中低危APL患者。排除标准:合并妊娠;精神疾病及心律失常、心脏病患者。一旦细胞形态考虑APL立即开始治疗,待3~4 d基因测试回报后随机分为口服组和静脉组进行治疗。口服组患者男11例,女9例;中位年龄37.3(17~68)岁。静脉组患者男7例,女11例;中位年龄39(23~59)岁。两组患者入组时一般临床资料比较,差异无统计学意义(P>0.05)(表1),具有可比性。本研究通过南充市中心医院伦理委员会批准,患者对治疗方案知情同意并签署知情同意书。

表1 两组患者临床特点比较[n(%)]
1.2 治疗方法
1.2.1 诱导治疗方案[8]口服组:ATRA 25 mg/m2/d联合RIF 60 mg/kg/d方案直至骨髓缓解,诱导期间出现的贫血、血小板减少、凝血功能异常、感染及分化综合征均住院处理,诱导时间29~38 d,统计诱导治疗总费用。 静脉组:ATRA 25 mg/m2/d联合ATO 0.15 mg/kg/d方案直至骨髓缓解,诱导期间出现的贫血、血小板减少、凝血功能异常、感染及分化综合征均住院处理,诱导时间27~40 d,统计诱导治疗总费用。
1.2.2 巩固治疗方案 口服组:ATRA 25 mg/m2/d连续使用14 d后停用14 d,循环7个周期后结束治疗;RIF 60 mg/kg/d使用28 d停用28 d循环4个周期后结束治疗,所有巩固治疗方案均在家中进行,统计门诊检查及治疗总费用。 静脉组:ATRA 25 mg/m2/d连续使用14 d后停用14 d,循环7个周期后结束治疗;ATO 0.15 mg/kg/d使用28 d停用28 d循环4个周期后结束治疗,所有巩固方案均住院完成,统计每疗程治疗总费用。
1.2.3 支持治疗 根据患者临床表现及实验室检查及时给予悬浮红细胞、血小板、新鲜冰冻血浆及纤维蛋白原输注,维持血小板计数≥30×109/L、纤维蛋白原>1.5 g/L。诱导化疗中白细胞≥20×109/L,则暂停ATRA,加用柔红霉素化疗,同时予以地塞米松防治分化综合症。
1.2.4 监测指标 患者在诱导治疗过程中,定期检测血常规、肝肾功、电解质、凝血试验,在外周血中白血病细胞消失,同时中性粒细胞≥1.5×109/L,血小板≥100×109/L时进行骨髓细胞学检测及PML-RARa融合基因检测,了解是否缓解。进入巩固治疗后,定期检测血常规、肝肾功电解质、凝血试验、心电图及骨髓形态、微小残留病灶(minimal residual disease,MRD)及PML-RARA融合基因定量,若MRD及PML-RARA融合基因定量转阴,则3~6个月复查1次。
1.2.5 中枢神经系统白血病预防 APL患者治疗缓解后即进行腰椎穿刺检查及1次鞘内化疗(使用化疗药物为甲氨蝶呤5 mg+地塞米松5 mg+阿糖胞苷30 mg),脑脊液检查提示中枢神经系统白血病者,进行规则鞘内化疗或放疗,对脑脊液检查正常患者每2月复查1次,直至停药。
1.3 观察指标
观察APL患者完全缓解率(complete remission rate,CR)、PML-RARa融合基因转阴时间、5年无病生存率,并统计治疗总费用。
1.4 统计学方法
采用SPSS 17.0统计软件进行数据处理,等级计数资料采用2检验,定量资料以表示,两样本间均数比较采用独立样本t检验,生存分析采用Kaplan-Meier法。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 两组患者治疗效果比较
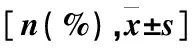
表2 两组患者疗效比较
注:*2=-0.05,P=0.074,#t=1.342 ,P=0.061
2.2 两组患者治疗费用比较
纳入统计分析的32例患者中口服组 17例,诱导治疗阶段化疗费用分别为(51 127.3±51.6)、(52 332.5±32.9)元,两组比较,差异无统计学意义(P>0.05)。两组患者7次巩固疗程治疗总费用分别为(76 331.1±21.1)、(114 153.2±45.5)元,两组比较,差异有统计学意义(P<0.05)。口服组在巩固治疗阶段治疗费用明显少于静脉组(所有费用均为医保报销前实际生成费用)(表3)。
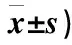
表3 两组患者治疗费用比较(元,
2.3 两组患者血液学缓解及PML-RARa融合基因转阴时间
32例APL患者PML-RARa融合基因均提示阳性。两组患者在治疗后获得血液学缓解时间、CR后3个月PML-RARa融合基因转阴率、CR后6个月所有患者监测PML-RARa融合基因转阴率比较,差异均无统计学意义(P>0.05)。5年随访,两组患者PML-RARa融合基因均提示阴性(表4)。
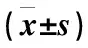
表4 两组患者血液学缓解及PML-RARa融合基因转阴时间比较
注:CR为完全缓解
2.4 两组患者生存时间及并发症发生情况
随访时间至2018年11月底,口服组5组生存率(98.92%)与静脉组(100.00%)比较,差异无统计学意义(P>0.05)(图1)。两组患者主要并发症:口服组中发生出血/DIC 6例,感染3例,早期死亡1例; 静脉组中发生出血/DIC 4例,感染3例,未发生早期死亡。两组患者并发症发生情况比较,差异无统计学意义(P>0.05)。
图1 两组患者治疗后生存曲线
3 讨论
APL发病机制是因特异性染色体异位导致形成PML-RARa融合基因,干扰了全反式维甲酸(ATRA)作用的信号转导,导致ATRA活性受到抑制。20世纪70年代,中国血液病专家开始使用维甲酸治疗APL,使这类曾经死亡率极高的白血病得到较好缓解。20世纪90年代,中国专家又将砷剂用于APL治疗,两药联合使APL成为可治愈的白血病。药物作用机制为:ATRA以RARa为靶点,通过降解PML-RARa融合蛋白,诱导早幼粒细胞分化,从而起到治疗作用[9]; ATO低浓度时诱导APL细胞分化,高浓度时诱导细胞凋亡,其发挥药力作用的具体分子机制在于ATO以PML为靶点,激发PML-RARa蛋白的降解[10]。我国传统中药RIF[5-6]主要成分为青黛、雄黄、太子参、丹参,方以雄黄为君,主要成分为As4s4,具有直接细胞毒作用,能通过诱导细胞死亡,包括诱导凋亡相关基因及干扰线粒体的能量代谢,从而抑制白血病细胞的过多增殖,还可通过抑制细胞增殖,促进细胞分化,破坏白血病患者细胞膜,抑制BNA、RNA的合成、克隆及增殖能力;青黛为臣,具有性味,咸寒,清热解毒、凉血消斑、清肝泻火、定惊功用;丹参为佐,活血通淤、凉血消肿、清心除烦之功效;太子参为使,体润性和、补气生津。四药配伍清热解毒,益气生血,成为砷剂的经典口服代表方剂。RIF Ⅱ期临床试验协作组通过区组、双盲双模、随机对照、多中心临床实验随机分组方法得出结论:RIF对初治APL有较高CR和耐受性[11]。 Zhu等[12]通过多中心数据表明,口服RIF可以替代静脉砷剂。
本研究表明,在非高危APL成人患者治疗中,口服ATRA+RIF组与静脉ATRA+ATO组在APL诱导缓解所需时间、PML-RARa融合基因转阴及持续时间、主要并发症、生存率方面比较,差异均无统计学意义,与其他学者研究结果一致[8,13-15],进一步证实这种口服、非化疗的ATRA+RIF治疗模式安全、有效,完全可以在非高危APL的治疗中替代原有治疗方式。
口服组诱导期治疗总费用与静脉组比较,差异无统计学意义,但在7次循环巩固治疗总费用中,口服组有明显优势,与实现门诊管理后其他药品费用下降、治疗费、床位及床位管理费、材料费等明显下降相关。肿瘤患者门诊管理既节约了治疗费用,同时使患者回归家庭,明显提高患者及家人生活质量;同时节约了医疗资源。
生存率是评估急性白血病新治疗方法疗效的主要指标,观察本研究中38例患者的生存曲线,32例经过2年治疗的患者终点事件并未发生,5年观察时间点仍未见终点事件发生,这可能与以下因素相关:1)患者均为中低危成年患者,治疗反应好、平均年龄较小、其他系统不良事件发生率小;2)定期进行MDR及PML-RARa融合基因检测,一旦PML-RARa融合基因出现>10-3,立即开始干预治疗,控制白血病全面复发;3)ATRA联合砷剂可靶向治疗APL的基因突变,疗效显著[16]。
研究[17-18]报道,ATRA联合砷剂不良反应包括体液潴留、肝肾功损害、胃肠道反应、皮疹、心血管系统损害、皮肤色素沉着、皮肤角化症、糖尿病、神经系统损害、第二肿瘤等。本研究药物不良反应表现并不显著,部分患者出现ALT/AST升高、心率失常:有4例患者出现早搏,但经对症处理后并未影响患者治疗方案的实施及预后。参照中国APL诊疗指南(2018年版)[19]所推荐的剂量为ATO 0.16 mg/kg /d及ATRA 45 mg/m2/d,其不良反应小的原因可能与该随访实验中所选药物使用剂量小相关(ATO 0.15 mg/kg /d,ATRA 25 mg/m2/d)。
综上,本研究结果表明,在非高危 APL中,ATRA联合RIF在疗效、CR、主要不良反应、PML-RARa融合基因转阴时间、生存率等方面与静脉砷剂方案相似。本研究进一步证实:口服ATRA+RIF治疗模式在非高危APL中完全能替代静脉砷剂,与其他医疗中心研究结果一致。同时方案简化了低中危APL治疗模式、降低了治疗费用、减少了患者穿刺次数,对提高患者生活质量有重大积极意义,值得临床推广使用。但APL发病率较低,本方案不足之处在于纳入病例数量偏少,患者随访时间较短,未来仍需更长随访时间、纳入更多病例行进一步研究。