不同剂量右美托咪定对骨科止血带患者七氟醚MACBAR的影响*
冯 艳,陈小波,杨小霖
1.南充市中心医院(南充 637000)2.川北医学院附属医院(南充 637000)
七氟醚抑制交感、肾上腺素能反应的最低肺泡浓度(minimum alveolar concentration for blocked adrenergic response,MACBAR)是指七氟醚和纯氧同时吸入时能抑制50%患者切皮时血流动力学反应和肾上腺素能反应的最低肺泡有效浓度。已有报道[1]明确了能降低七氟醚的MACBAR值,但测定时所使用的刺激均为手术切皮刺激。而以止血带为刺激对不同剂量下七氟醚的MACBAR的研究尚未见报道。本研究旨在观察不同剂量右美托咪定(dexmedetomidine,DEX)对骨科止血带患者七氟醚MACBAR及苏醒期躁动的影响,现报道如下。
1 资料与方法
1.1 临床资料
选取2017年6月至2017年11月在南充市中心医院择期全麻下行骨科下肢手术并使用止血带患者75例, 纳入标准:ASAⅠ或Ⅱ级, 年龄20~60岁, BMI 18~28 kg/m2,术前血红蛋白110~150 g/L,无心、肺、肝、肾、血液等重要系统疾病; 无药物过敏史;术前1月内未使用影响循环系统或阻断交感神经的药物;术前两周内无七氟烷麻醉史;术前无呼吸道感染症状。排除标准:有高血压、房室传导阻滞、心律失常等患者。本试验采用随机双盲法将患者随机分为3组,每组25例:D0组(不使用DEX,以0.9%氯化钠液作为对照),D1组(DEX负荷量0.5 μg/kg, 维持量0.5 μg · kg-1· h-1),D2组(DEX负荷量1.0 μg/kg,维持量1.0 μg· kg-1· h-1)。本研究经南充市中心医院伦理委员会批准, 试验前与患方签署知情同意书。
1.2 麻醉方法
1.2.1 麻醉诱导 所有患者术前常规禁食禁饮,且不用术前药。患者入室后采用多功能监测仪(Mindray,PM-9000 2.0)常规监测血压、心电图、脉搏血氧饱和度、鼻咽温度、呼末七氟烷(ETsevo)和呼末二氧化碳分压(PETCO2),同时采用脑状态指数(cerebral state index,CSI)监测仪监测麻醉深度等, 局麻下行桡动脉穿刺, 连续监测平均动脉血压 (mean arterial pressure,MAP)。建立静脉通道后输注林格氏液20 mL·kg-1·h-1。麻醉诱导前10 min均恒速输注DEX负荷量, D0、D1、D2组负荷量分别为0、0.5和1.0 μg/kg, 然后分别以0、0.5和1 μg·kg-1·h-1维持量持续泵注。负荷剂量输注完毕后开始麻醉诱导, 面罩给氧去氮5 min,静注瑞芬太尼2 μg/kg(批号:6170305,宜昌人福药业有限公司)、依托咪酯0.3 mg/kg(批号:20171029,江苏恩华药业)、顺式阿曲库铵0.2 mg/kg(批号:170817AK,江苏恒瑞医药股份有限公司)。气管插管后行机械通气(Drager Fabius GS,德国),采用辅助/控制通气模式, 潮气量8 mL/kg,呼吸频率12次/min, 新鲜气流量2 L/min,麻醉诱导后按20 mL·kg-1·h-1速度继续补充复方氯化钠注射液。
1.2.2 麻醉维持 各组均吸入七氟醚(批号:17092631,上海恒瑞医药有限公司)、泵注顺式阿曲库铵2 μg·kg-1·min-1维持麻醉,且使呼末七氟醚浓度(ETsevo)达到预设值(预实验结果确定,其浓度在预实验中接近于止血带充气后切皮刺激时血流动力学呈阴性反应的浓度),并在止血带充气前至少维持稳定20 min。然后在患者大腿根部绑上止血带(尤蓝ATS-Ⅲ型,迈迪克)。在切皮前, 从足部开始一直向近心端重叠缠绕弹力绷带, 直至止血, 随后充气,使压力达到230 mm Hg[2-3]。取麻醉诱导前、止血带充气前3 min及1 min测定的心率、血压平均值为其基础值,止血带压力达到230 mm Hg切皮开始后1 min及3 min测定的心率、血压平均值为其变化值。凡止血带充气前MAP降至50 mm Hg,心率<40次/min者退出试验。采用序贯法对七氟醚MACBAR的变化进行观察。采用气相色谱仪(agilent technologies GC7890A)测定呼末气中吸入麻醉药浓度。各组第1例患者所要达到的ETsevo预设值:R0组4%、R1组3%、R2组2%。其后各组每下1例患者所设定的ETsevo,取决于前1例患者对止血带充气后切皮刺激的MAP、心率反应结果:若引起MAP或心率的变化值升高≥基础值的20%(定义为阳性反应),则下1例患者ETsevo上调0.2%;若止血带反应引起心率或和MAP的变化值升高<基础值的20%(定义为阴性反应),则下1例患者ETsevo下调0.2%。每下1例患者ETsevo均根据上1例患者的阳性或阴性结果进行上调或下调,直至观察到从阳性到阴性的6个交叉点为止[4]。把每组6个独立交叉点中的ETsevo取均值,即为该组七氟醚的MACBAR。在此期间调节手术室的室温和变温毯的温度,维持患者鼻咽温度于(36.6±0.4)℃。在维持七氟醚预设浓度不变的前提下调整呼吸机参数使PETCO2维持在5~35 mm Hg水平。取每组6个独立交叉点中患者止血带充气后1、3 min的MAP、心率的均值为各组的最低有效MAP和最低有效心率。观察结束后, 予所有止血带充气后切皮反应为阳性的患者静脉推注0.05 mg/kg咪达唑仑,同时泵注瑞芬太尼0.1~0.2 μg·kg-1·min-1,维持麻醉深度CSI为40~60[5]。手术结束前20 min所有患者停止泵注瑞芬太尼并静脉注射芬太尼1.5 μg/kg镇痛,结束时停用七氟醚、顺式阿曲库铵、DEX,术毕患者清醒后拔管送入麻醉恢复室(post anesthesia care unit,PACU),并观察苏醒期躁动情况。术后1 d对患者进行随访。
1.3 观察指标
记录每例患者麻醉诱导前、止血带充气前的心率、MAP、CSI均值及最低有效心率、MAP。记录3组患者七氟醚的MACBAR。记录患者的止血带充气时间、DEX给药时间、手术时间、自主呼吸恢复时间T1(从手术结束至自主呼吸恢复时间)、睁眼时间T2(从手术结束至第1次睁眼时间)、拔管时间T3(从手术结束至气管导管拔除时间),PACU停留时间,并在患者拔管时,拔管后5、10、15、20、25、30 min,行Riker镇静躁动评分(sedation agitation scale, SAS)[6](表1)、记算3组患者苏醒期躁动(emergence agitation,EA)发生率。

表1 Ricker镇静-躁动评分
注:恶性刺激:指吸痰或用力按压眼眶、胸骨、甲床5 s
1.4 统计学方法
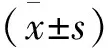
2 结果
预选75例患者纳入研究,实际参与病例64例,其中D0、D1及D2组分别为23例、21例和20例。各组患者年龄、BMI及麻醉诱导前MAP心率和CSI比较差异均无统计学意义(P>0.05)(表2)。每例患者对止血带切皮刺激的心血管反应及对应的ETsevo如下图(图1)。3组患者七氟醚MACBAR、最低有效MAP及心率如下表(表3)。其中3组七氟醚MACBAR差异明显,D0组最高(4.50±0.31)%,D2组最低(1.57±0.41)%(P<0.05),3组最低有效心率差异明显,D0组最高(104.78±4.15) 次/min, D2组最低(62.16±3.62) 次/min(P<0.05),3组最低有效MAP比较差异均无统计学意义(P>0.05)。3组患者SAS评分的比较中,D1组和D2组在拔管时低于D0组(P<0.05),D2组在拔管后5、10、15 min的SAS评分低于D0组(P<0.05)(表4)。3组患者止血带充气时间、DEX给药时间、手术时间、苏醒时间及恢复时间比较,差异无统计学意义(P>0.05)(表5)。D2组患者的EA发生率低于D0组(P<0.05)(表6)。

图1 D0组、D1组和D2组七氟醚呼末浓度变化趋势图
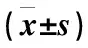
表2 3组患者麻醉前一般情况比较
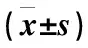
表3 3组患者七氟醚MACBAR及最低有效MAP和心率
注:与D0组相比,*P<0.05;与D1组相比,#P<0.05
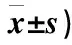
表4 3组患者SAS评分比较(分,
注:与D0组相比,*P<0.05
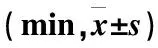
表5 3组患者止血带充气时间、DEX给药时间、手术时间、苏醒时间及恢复时间比较

表6 3组患者苏醒期躁动比较[n(%)]
注:与D0组相比,*P<0.05
3 讨论
止血带因其具有提供清晰、无血的手术视野以利于手术操作和减少术中出血而被广泛应用于临床,常用于行下肢手术的患者。止血带的膨胀和收缩往往会兴奋交感神经而引起高血压和心率增快,长时间使用可压迫远端组织而引起低体温、酸性代谢产物的堆积及高凝状态,甚至导致患者出现烦躁不安、疼痛不适[8],但目前尚无安全有效的控制方法。
以往对吸入麻醉药MACBAR的临床研究主要以单纯的手术切皮为刺激条件,也有腹腔镜气腹作为刺激条件,而本研究首次以止血带充气下手术切皮为刺激条件,并分别测定了骨科下肢手术患者不同剂量DEX的七氟醚MACBAR。当单独使用七氟醚维持麻醉时,其MACBAR比Katoh等[9](4.15%)及倪卫国等[10](3.16%)测得的七氟醚MACBAR高,但比Zou等(4.6%)[11]低。在他们的试验中前两者采用单纯的切皮刺激,后者采用气腹刺激。单纯切皮刺激为瞬间体表疼痛刺激,消失较快。本实验所采用的止血带充气下切皮刺激虽非持续体腔刺激,但止血带持续充气引起的交感神经兴奋,也会导致循环系统发生明显变化。因此要抑制该刺激所引起的应激反应必然需要维持较高的呼末吸入麻醉药浓度,所测得的七氟醚MACBAR值自然比单纯切皮刺激时的值大,但又比持续性气腹刺激时的值小。在复合使用DEX的情况下,均能使七氟醚MACBAR值降低。因DEX是一种高选择性肾上腺α2受体激动剂,作用中枢神经突触后α2受体,抑制去甲肾上腺素释放,降低血浆儿茶酚胺的水平[12]。徐文杰等[13]研究表明,麻醉诱导前分别给予DEX负荷剂量0.5 μg/kg、维持剂量0.2 μg·kg-1·h-1及负荷剂量0.8 μg/kg、维持剂量0.4 μg·kg-1·h-1可降低七氟醚抑制气腹刺激时MACBAR约34%和51%。而本实验中麻醉诱导前分别给予DEX负荷剂量0.5 μg/kg、维持剂量0.5 μg·kg-1·h-1及负荷剂量1.0 μg/kg、维持剂量1.0 μg·kg-1·h-1可降低七氟醚抑制止血带充气下切皮刺激时MACBAR约45%和65%。其主要原因不仅与DEX对交感神经活性的抑制,限制血管反应性下降有关,且DEX可引起内源性阿片类物质释放[14],七氟醚在大脑中枢水平产生镇痛作用[15],DEX增强了七氟醚的镇痛作用,导致降低了其MAC值。多项研究[13,16]表明,DEX可降低抑制气腹刺激或切皮刺激七氟醚MACBAR,呈剂量依赖性,与本次实验结果相似。
EA是七氟醚麻醉后常见的并发症[17],其发生机制目前尚不明确,目前预防EA的方法较多,其中阿片类药物、非甾体抗炎镇痛药应用较多,但可能导致患者出现呼吸抑制或苏醒延长等。DEX能产生镇静、镇痛、抗焦虑作用,且无明显呼吸抑制。目前有大量的研究[18-20]证实,DEX能降低EA的发生率,但其合理剂量的应用仍在进一步探索中。本试验中,3组患者在苏醒时间及恢复时间比较差异无统计学意义(P>0.05),可见DEX并不延长患者苏醒时间。D2组患者EA发生率低于对照组,且随着DEX剂量增加,患者的最低有效心率逐渐降低,呈剂量依赖性,可能与高剂量的DEX能够降低交感神经活性,增加乙酰胆碱的释放有关[21-22]。
综上所述,DEX的应用可有效抑制下肢骨科手术止血带刺激所导致的循环反应。随着DEX剂量的增加,七氟醚的MACBAR逐渐降低,给予负荷剂量1.0 μg/kg、维持剂量1.0 μg·kg-1·h-1可明显降低EA的发生率。