幽门螺杆菌感染与炎症性肠炎关系及危险因素分析*
李艾虹,周 欢,何 峰,张春燕,黄晓利
1.四川大学 华西公共卫生学院/四川大学 华西第四医院(成都 610000);2.成都医学院第一附属医院 消化内科(成都 610500)
幽门螺杆菌(Helicobacterpylori,HP)在20世纪80年代由美国学者Warren及Marshall首次分离[1],是目前发现唯一可在胃酸环境中长期生存的细菌,其存活时间可超过10年,对胃黏膜及胃泌素等胃肠道激素的分泌均有明显影响[2-4]。HP被认为是Ⅰ类致癌原,其感染可触发Correa级联反应而引起胃部病变,非萎缩性胃炎可发展为萎缩性胃炎、肠上皮增生,最终引起不典型增生[5]。相关调查数据[6]显示,全球约50%人群感染HP,而在发达国家中HP携带率在30%以下,发展中国家则高达50%~70%。不同学者对HP感染与炎症性肠炎的相关性研究结果存有差异,有研究[7]认为,HP感染为炎症性肠炎的保护性因素,但也有研究[8]认为,HP感染与炎症性肠炎的发生无相关性。本研究采取病例对照方法,对初诊炎症性肠炎患者中HP感染情况进行分析,以期明确二者关系,为该病的临床治疗措施提供参考依据。
1 资料与方法
1.1 临床资料
选择2017年2月至2019年2月在成都医学院第一附属医院就诊的初诊炎症性肠炎患者100例(试验组)及同期健康体检者100例(对照组)进行回顾性分析。纳入标准:1)试验组符合《成人炎症性肠炎的规范化诊断—全球实践指南》[9]的相关诊断,对照组不符合相关诊断;2)患者神志清醒,智力正常,与医护人员可正常交流;3)患者已获知情同意。排除标准:1)既往炎症性肠炎病史的患者;2)接受过HP清除治疗者;3)明确的消化系统疾病史患者;4)近期合并其他感染性疾病者;5)自身免疫疾病史的患者;6)胃肠道手术史患者。
1.2 方法
1)收集调查对象一般资料,包括:性别、年龄、体重指数(body mass index,BMI)、文化程度、吸烟史、饮酒史。吸烟史:超过3年,每天吸食超过10支香烟,认为有吸烟史。饮酒史:男性每周乙醇摄入量在140 g以上,女性乙醇摄入量70 g以上认为有饮酒史。2)HP检测:对患者进行14C-UBT检测,在空腹口服14C-尿素胶囊1粒,20 min后,对集气卡进行吹气,当显示颜色变为白色时,将卡插入检测仪(深圳市中核海得威生物科技有限公司),当检测结果在100 dpm及以上则认为HP阳性。3)抽取患者空腹外周静脉血,以酶联免疫吸附试剂盒(Sigma公司)检测C-反应蛋白(C-reactive protein,CRP)、白介素-6(interleukin-6,IL-6)、降钙素原(procalcitonin,PCT)和肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)水平。正常值参考范围:CRP<5 mg/L、IL-6<25 ng/L、PCT<0.5 μg/L、TNF-α<30 fmol/mL。
1.3 统计学方法
采用SPSS 22.0统计学软件进行数据分析,定性资料采用例数(%)表示,采用2检验,定量资料采用描述,采用t检验,多因素分析行Logistic回归分析,检验水准α除特殊说明外均设定为0.05。
2 结果
2.1 两组患者单因素分析
两组患者年龄、性别、BMI指数、吸烟史、饮酒史、受教育年限比较,差异无统计学意义(P>0.05),试验组患者HP感染率明显低于对照组,CRP、PCT、TNF-α、IL-6明显高于对照组(P<0.05)(表1)。
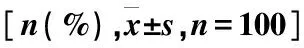
表1 两组患者单因素分析
2.2 多因素分析
纳入分析的影响因素分别为HP感染、CRP、IL-6、PCT及TNF-α。以似然比前进法筛选变量,行多因素非条件Logistic回归分析,结果显示,HP感染为炎症性肠炎保护性因素,而CRP≥5 mg/L、IL-6≥25 ng/L、PCT≥0.5 μg/L、TNF-α≥30 fmol/mL为危险因素(P<0.05)(表2~3)。
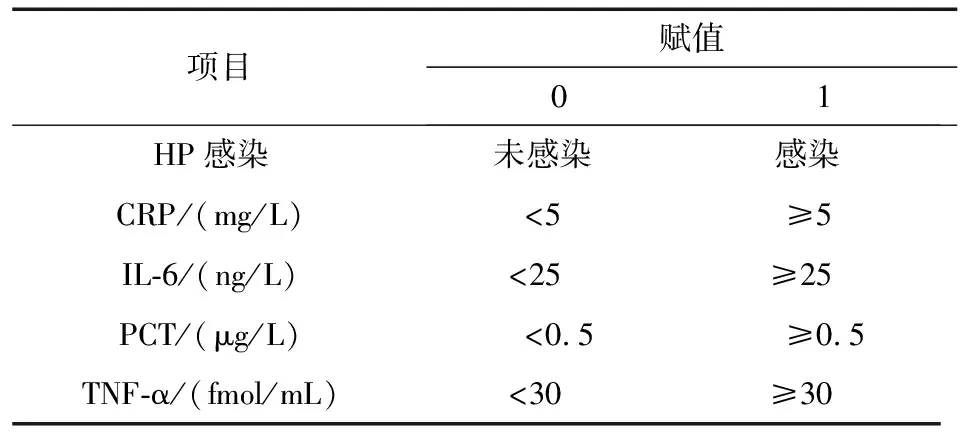
表3 Logistic回归变量赋值表
2.3 炎症性肠炎患者HP感染与炎性因子相关性分析
炎症性肠炎患者及对照组相关性分析结果显示,HP感染阴性患者CRP、IL-6、PCT及TNF-α水平均明显高于HP感染阳性者(P<0.05),而HP感染与CRP、IL-6、PCT及TNF-α水平均呈负相关(r=-0.613、-0.727、-0.593、-0.810,P<0.05)。对照组不同HP感染患者炎症因子比较,差异无统计学意义(P>0.05)(表4~7)。
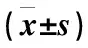
表4 炎症性肠炎患者不同HP感染情况炎性因子水平比较
表5 对照组不同HP感染情况炎性因子水平比较
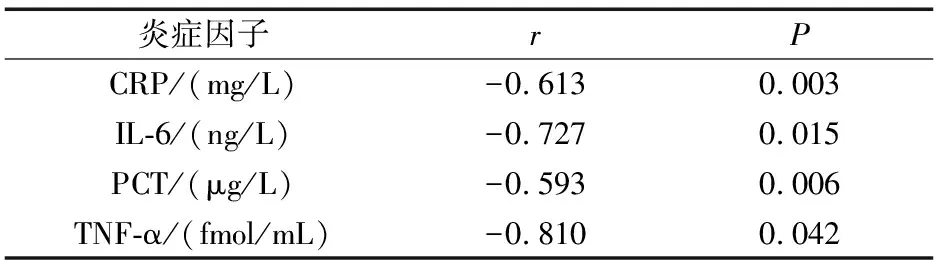
表6 炎症性肠炎患者HP感染与炎症性肠炎患者炎性因子相关性分析
表7 对照组HP感染与炎症性肠炎患者炎性因子相关性分析
3 讨论
近年来,随着对HP感染研究的深入,研究[10]证实,HP感染不仅可引起胃部病变,还与结直肠癌、硬化性胆管炎等多种胃外疾病的发生、发展密切相关。同时有研究[11]显示,HP感染对部分T细胞介导的过敏性哮喘、Ⅰ型糖尿病等疾病具有保护作用。炎症性肠炎为临床上常见的慢性复发性肠道疾病,该病的病因机制尚未完全明确,目前尚无根治方法。有研究[12]显示,炎症性肠炎患者HP感染率明显低于健康人群。流行病学调查研究[13-14]显示,西方发达国家HP感染率低于亚洲国家,但炎症性肠炎的发生率则明显高于亚洲国家,提示HP感染与炎症性肠炎发生呈负相关。考虑到炎症性肠炎复发率较高,大部分患者需长期服用药物治疗,药物对于HP感染可能产生较大的影响;因此本研究选取初次诊断为炎症性肠炎的患者进行研究以排除过往研究中治疗史这一重要因素。
本研究经单因素与多因素Logistic回归分析,结果显示,HP感染为炎症性肠炎保护性因素,可能与以下几方面因素有关:1)HP被发现与巨细胞动脉炎等自身免疫性疾病有关,自身免疫反应参与了炎症性肠炎的发病,HP可能通过影响这一过程而生效。2)HP侵袭胃肠道时,可释放出脂多糖而刺激小肠潘氏细胞,释放出菊苷及防御素两种抗菌肽,产生抗菌作用,降低肠道感染所引起的炎症性肠炎的发生率[15-16]。
异常免疫为炎症性肠炎的关键因素,在炎症性肠炎的发生、发展过程发挥着重要作用,外界抗原刺激可激活炎症性肠炎患者体内免疫系统,激活炎性细胞,释放出大量炎症因子及黏附分子,在结肠或直肠黏膜聚集而诱发炎症性肠炎[17]。本研究结果显示,CRP≥5 mg/L、IL-6≥25 ng/L、PCT≥0.5 μg/L、TNF-α≥30 fmol/mL为危险因素(P<0.05)。CRP为急性相反应蛋白之一,健康人群血清CRP水平较低,当炎症反应急性期其水平明显升高。研究[18-19]证实,炎症性肠炎患者CRP水平明显上升,且随疾病严重程度升高而升高,经过治疗后该指标水平可明显下降。PCT为机体在细菌感染、内毒素刺激下释放的炎性介质,体内炎症反应剧烈时可引起血清PCT水平上升,炎症性肠炎患者血清PCT水平升高可能与微生物刺激有关。TNF-α为T细胞、巨噬细胞等所产生的炎性介质,可刺激平滑肌细胞、内皮细胞、纤维母细胞等产生蛋白酶、前列腺素等花生四烯酸代谢产物。炎症性肠炎时,TNF-α可刺激胃肠细胞吞噬补体片段坏死,加速结肠黏膜细胞凋亡,加速局部水肿,协助干扰素改变肠道上皮细胞屏障特性及形态结构而增加肠黏膜通透性,加重病情。IL-6为多功能细胞炎症因子的一种,虽不直接对血管内皮造成损伤,但其可通过多途径提高细胞间黏附分子表达,增强肠道上皮细胞及中性粒细胞间相互作用而促进肠道炎症反应的作用。
CRP、IL-6、PCT及TNF-α均由Th1、Th2细胞调节分泌,炎症性肠炎患者炎症反应程度严重致免疫功能严重受损,使Th1/Th2细胞反应失衡而向Th2方向偏移,致CRP、IL-6、PCT及TNF-α水平明显升高。本研究结果显示,HP感染阴性患者CRP、IL-6、PCT及TNF-α水平均明显高于HP感染阳性者(P<0.05);相关性分析结果显示,HP感染与CRP、IL-6、PCT及TNF-α水平均呈负相关(P<0.05)。推测可能与胃肠道HP感染初期,胃黏膜上皮细胞可分化诱导T细胞Th1促炎症反应应答的树状突、细胞样专职免疫应答功能而起到抗炎的作用,因而HP感染时炎症性肠炎被抑制。调节性T细胞介导外周免疫耐受,为辅助持续感染的关键因子。多项研究[20-21]证实,人感染HP后调节性T细胞及DCs在介导系统免疫调节作用时有免疫耐受活性,HP感染科清除DCs而有效打破免疫耐受,加强机体对感染的控制及促进T细胞介导的免疫反应。
综上所述,HP感染为炎症性肠炎保护性因素,CRP≥5 mg/L、IL-6≥25 ng/L、PCT≥0.5 μg/L、TNF-α≥30 fmol/mL为危险因素。炎症性肠炎患者HP感染与CRP、IL-6、PCT及TNF-α水平均呈负相关。临床上对于未检出HP感染的炎症性肠炎患者在治疗时,应避免使用甲硝唑等抗生素,以减少炎症性肠炎发生。