水稻卷叶矮化突变体rld的表型鉴定及基因精细定位
葛倩雯, 金宝花, 傅小进, 顾志敏, 陈析丰, 马伯军
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 图文信息中心,浙江 金华 321004)
叶片是植物光合作用的主要器官,合适的叶形态会增加植物的受光面积,促进光合作用.在超级杂交稻株型模式中,袁隆平将水稻功能叶的形态归结为“长、直、窄、厚、凹”,其中“凹”是指叶片内卷.适度的内卷叶有助于叶片保持直立,改善群体生长后期的受光条件,提高光透射率,提高水稻的产量[1].因此,研究植物的卷叶调控基因对作物的生产具有重要意义.
植物叶片卷曲的程度是受基因调控的,迄今在水稻中已经克隆了13个卷叶调控基因[2].其中大部分基因通过影响泡状细胞的大小及数量,参与叶片卷曲程度的调控,如RL14[3],SRL1[4],ADL1[5],NAL7[6],NRL1[7],ROC5[8],OsZHD1[9],REL1[10]和ACL1[11]等.还有一部分基因通过影响维管束鞘延伸区和主脉薄壁细胞数量、维管束韧皮部的变化,导致叶片卷曲,如LC2[12],CFL1[13]和SLL1[14]等.本研究从水稻诱变库中筛选到一个典型的内卷叶矮化突变体rld,并对该突变体进行表型分析和基因定位,结合氨基酸序列与蛋白结构分析确定该基因突变后引起卷叶突变表型的原因.为进一步研究水稻叶片发育的分子机制提供参考.
1 材料与方法
1.1 供试材料
水稻rld卷叶矮化突变体是从籼稻(OryzasativaL. ssp.indica)品种镇恢084的60Co-γ辐射诱变库中筛选获得.以rld卷叶矮化突变体为母本与粳稻(OryzaSativaL. spp.japonica)野生型品种日本晴杂交,获得F1代,F1代自交获得F2代.5月份,水稻种子37 ℃催芽2 d,将种子均匀点播于苗床上,30 d后插秧,常规大田管理.以上材料均种植于浙江省金华市水稻大田.
1.2 卷叶性状测定方法
在成熟期,测量剑叶叶片最宽处自然卷曲状态下叶缘间距(Ln)和展开后最宽处叶缘间距(Lw),计算叶片卷曲度LRI=(Lw-Ln)/Lw×100%.
1.3 叶片的石蜡切片观察
采用王承林[15]的方法进行石蜡切片,取新鲜叶片,用FAA固定液体(V(福尔马林)∶V(冰醋酸)∶V(70%乙醇)=1∶1∶18)固定,经脱水、透明、浸蜡、包埋、切片,脱蜡、番红、固绿染色,然后在显微镜下观察、扫描成像.
1.4 卷叶矮化突变基因的遗传分析
在成熟期,调查F1与F2群体的表型,统计F2群体中野生型和卷叶矮化突变型的单株数,采用χ2检验分析F2群体中野生型与卷叶矮化突变型植株的分离比.
1.5 卷叶矮化突变基因的连锁分析
采用群分法[16]进行基因的连锁分析.选取卷叶矮化突变体、野生型日本晴、F2群体中20株野生型单株和20株卷叶矮化突变型单株,采用Murray等[17]的方法分别提取叶片总DNA,并将20株野生型单株的DNA等量混合成野生池,将20株卷叶矮化突变型单株的DNA等量混合成突变池.用覆盖水稻12条染色体的多态性SSR、Indel标记[18-19]对卷叶矮化突变体、野生型日本晴,杂交F2代野生池和突变池的DNA进行PCR扩增.PCR采用Taq PCR Master Mix试剂盒(南京博尔迪生物科技有限公司),程序为:94 ℃预变性5 min;94 ℃变性30 s,55~60 ℃退火(不同引物)30 s,72 ℃复性30 s,35个循环;72 ℃延伸10 min.PCR产物在3%琼脂糖凝胶电泳分离,经EB染色后,在凝胶成像仪中扫描成像,筛选在野生池和突变池的PCR条带之间具有多态的标记,进行目的基因的连锁分析.
1.6 卷叶矮化突变基因的精细定位
在目的基因连锁的染色体区段,寻找和设计更多的多态性SSR、Indel标记(见表1).

表1 基因定位所用Indel标记引物序列
扩大定位群体的数目,选取F2群体中所有的卷叶矮化突变型单株,采用Murray等[17]的方法分别提取叶片总DNA,用多态性分子标记按照1.5的PCR方法对每个单株进行分析,检测目的基因与分子标记间的染色体重组率,将目的基因精细定位在2个紧密连锁的标记之间.
1.7 候选基因的PCR扩增与测序
采用PrimeSTAR®HS DNA Polymerase试剂盒(TaKaRa),50.0 μLPCR体系为:10.0 μL 5×PrimeSTAR缓冲液,4.0 μL dNTP混合物,2.0 μL 10 μmol/L引物(见表2),2.0 μL模板DNA,0.5 μL PrimeSTAR HS DNA保真酶,31.5 μL无菌水.程序为:95 ℃预变性5 min;98 ℃变性10 s,58 ℃退火5 s,72 ℃复性90 s,35个循环;72 ℃延伸10 min.PCR产物委托生物技术公司进行测序.

表2 候选基因PCR扩增引物序列
2 结果与分析
2.1 卷叶矮化突变体rld的表型特征
在水稻正常生长条件下,从5叶期开始rld突变体的叶片沿主脉向内卷曲成圆筒状,之后叶片始终表现高度卷曲,在成熟期进行测量,自然卷曲状态下叶缘间距为(3.96±0.82) cm,展开后最宽处叶缘间距为(9.83±1.74) cm,叶片的卷曲度为59.7%.与野生型对照品种镇恢084相比,rld突变体植株明显矮小,发育迟缓且叶色加深,穂小而稀疏,结实率非常低,籽粒发育不良、畸形(见图1).

a:水稻成熟期的植株;b:叶片;c:穗;d:籽粒
叶片组织的石蜡切片观察表明,rld突变体叶片泡状细胞的结构、数目与野生型对照没有明显的差异,但是维管束间下表皮细胞的面积明显大于野生型对照(见图2).
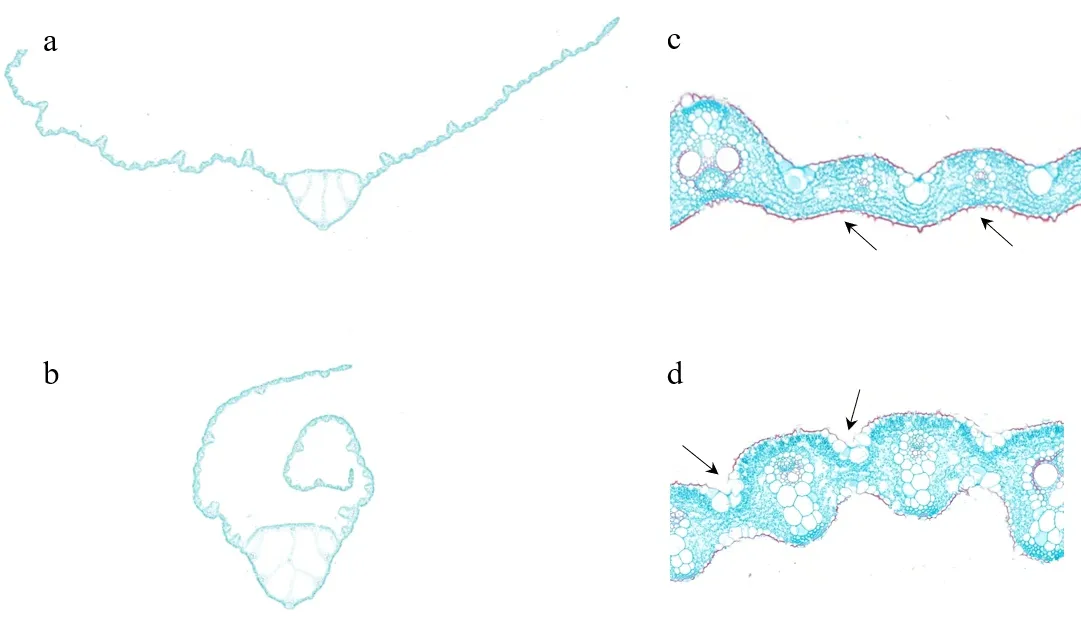
a:野生型镇恢084叶片横切面;b:rld突变体叶片横切面;c:图a放大部分;d:图b放大部分(箭头表示突变细胞)
2.2 卷叶矮化突变体rld的遗传分析
用rld突变体做母本,与野生型日本晴杂交,其F1代植株均为野生型.F1代自交后获得F2群体,F2植株的叶片出现野生型和卷叶矮化突变型,一共2 887个单株,其中2 195株为野生型,692株为卷叶矮化突变型.经过χ2检验,F2群体中野生型与卷叶矮化突变型的比例为3∶1(χ2=1.23;P<0.05),符合孟德尔遗传.该结果表明rld突变体卷叶矮化性状由一个隐性单基因控制.
2.3 卷叶矮化基因的连锁分析和精细定位
用水稻中已公布的300多个SSR、Indel标记对亲本日本晴与rld突变体进行多态性分析,筛选到86个分布在12条染色体的多态SSR标记.采用群分法进行目的基因的连锁分析,通过以上86个SSR标记对F2群体的野生型和突变型2个DNA混池进行分析,发现9号染色体上标记R9M20与目的基因存在明显的连锁.
利用R9M20标记及其两侧的多态标记,对F2群体中20株突变型单株进行分析,将目的基因初步定位在RM24134和RM24303标记之间(见图3a).为了精细定位目的基因,在RM24134和RM24303标记之间筛选了7个SSR多态标记,并设计了5个Indel多态标记,对F2群体中卷叶矮化突变型单株进行分析,最终将rld基因精细定位在Indel2和Indel5标记之间,物理距离约为32.3 kb(见图3b).
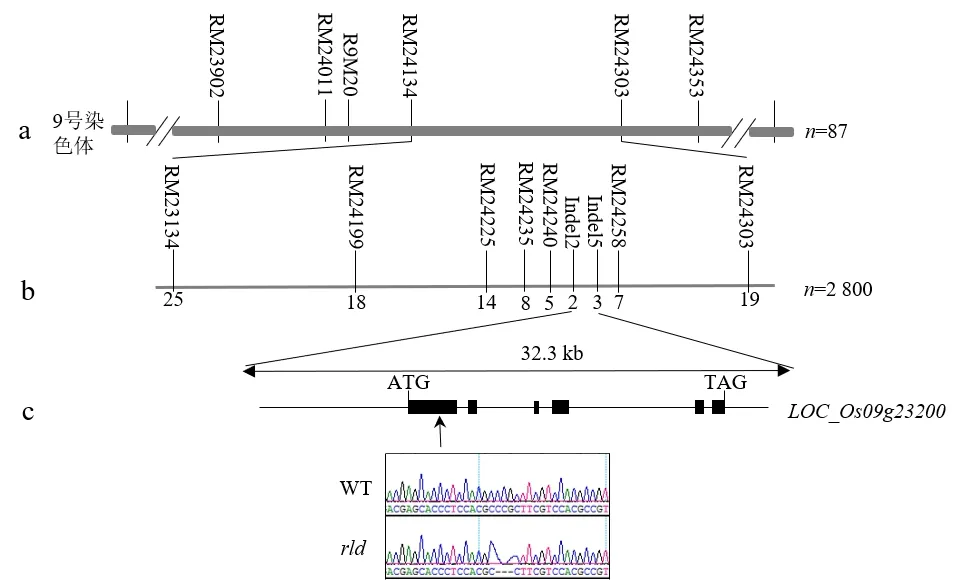
a:rld的初定位;b:rld的精细定位;c:候选基因及突变位置;
2.4 候选基因的预测与测序分析
根据Gramene网站(http://www.gramene.org/Oryza_sativa/location/)提供的基因注释信息,在rld基因的32.3 kb定位区间内含有3个候选基因,分别是LOC_Os09g23180,LOC_Os09g23190,LOC_Os09g23200.其中,LOC_Os09g23200基因为已克隆的卷叶基因RL9[20].通过设计引物和PCR扩增,本实验对rld突变体及其野生型对照镇恢084的LOC_Os09g23200基因进行了测序分析,发现在该基因第一个外显子处,rld突变体比镇恢084少了3个碱基(见图3c),并导致第181位的精氨酸丢失.
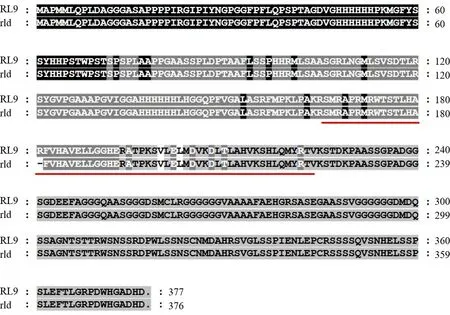
划红线区域代表GARP-DNA结合保守结构域;-表示缺失的氨基酸;.表示终止密码子
2.5 候选基因的蛋白序列分析
根据氨基酸序列比对,发现第181位的精氨酸位于该基因编码的GARP-DNA结合功能保守结构域上(见图4).通过swiss-model网站(https://www.swiss-model.expasy.org/)提供的蛋白质3D结构模型和功能预测信息,将野生型编码的RL9蛋白和突变体rld编码的蛋白进行结构模型建立(见图5a~5b),显示这一精氨酸的丢失,引起了蛋白质的空间结构的变化.经过不同物种间的同源氨基酸序列比对显示,RL9与KAN家族成员有很高的同源性,结构组织分析显示,KAN蛋白和RL9蛋白都具有高度保守的GARP结构域,在不同物种间,RL9基因编码的第181位精氨酸同样显示高度保守(见图6).
3 讨 论
卷叶是一种重要的农艺性状,与光合作用和作物产量直接相关.直立的半卷水稻叶片导致增强的光捕获能力和增加的叶绿素含量,因此,提高了光合效率和产量,叶片适度卷曲同样可以减少蒸腾作用,提高植株在干旱条件下的忍耐性.对玉米、甘蔗和谷物高粱的研究表明,叶片维管束和叶肉细胞的排列与光合效率密切相关.本实验室发现的卷叶矮化突变体rld所带的卷叶基因在生产上具有一定的应用价值.
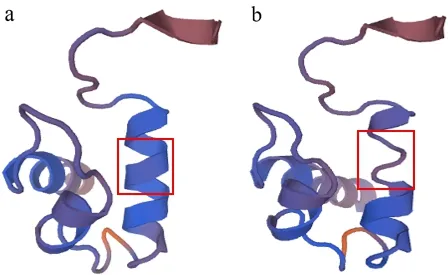
a:RL9基因编码蛋白结构模型;b:rld编码蛋白结构模型
图5RL9及rld突变基因编码蛋白的3D结构模型预测

划红线区域代表GARP-DNA结合保守结构域;箭头处表示rld的突变位点
本文鉴定的卷叶矮化突变体rld,属于内卷,从五叶期开始始终表现高度卷曲,并且伴随着叶色加深,结实率下降等表型,通过石蜡切片观察到其维管束之间的下表皮叶肉细胞面积明显增大泡状化从而导致叶片发生内卷.对rld突变体进行了基因精细定位和候选基因测序,表明该突变表型是由于RL9基因的第一个外显子缺失了3个碱基,这3个碱基编码该基因上的第181位的精氨酸.RL9基因是水稻的转录因子,编码一个SHAQKYF类MYB转录因子,属于KANADI家族,该转录因子包含一个GARP结构域,其是高度保守螺旋-环-螺旋DNA结合结构域,研究表明,GARP结构域对于调节下游基因的转录具有关键性作用[21],KANADI家族中该GARP结构域的共有标识高于85%.RL9通过调控水稻叶片远轴面厚壁组织细胞的程序化死亡来调控水稻叶片的形状,该基因的突变导致远轴面叶肉细胞程序性细胞死亡不能正常进行而抑制叶片内卷的形成[14].在拟南芥中,KAN家族成员中功能突变的组合丧失导致远轴同一性的逐渐丧失,kan1或者kan2单独突变具有非常有限的或没有形态学的改变,kan1kan2双突变体明显出现了叶片形态的改变,kan1kan2kan3三突变体更进一步增加了叶片的卷曲度且显示更完全的轴向化[21].本研究中,发现rld突变体不仅影响叶片表型,而且导致畸形小穗,叶片显示完全的内卷,而在拟南芥中,kan1kan2kan3三突变体才显示完全内卷,表明KAN基因可能在水稻中发挥更大的作用.
通过氨基酸序列比对分析发现,rld突变体由于缺失了一个精氨酸导致叶片出现高度内卷,并且该氨基酸位于RL9蛋白的GARP-DNA结合保守结构域中,进一步的蛋白质3D结构预测分析发现,该氨基酸的缺失导致RL9蛋白中GARP结构域蛋白空间结构形态发生改变,也导致GARP保守结构域功能改变,从而影响水稻叶片形态正常发育.通过不同物种间同源氨基酸序列比对分析发现,RL9基因编码的第181位的精氨酸在不同物种间一致高度保守,表明该氨基酸在RL9蛋白的正常功能行使过程中是必要的,对维持水稻叶片表型具有至关重要的作用.

