星点设计-效应面法优化盐酸罗沙替丁醋酸酯胃漂浮缓释片制剂处方*
段颐珊,李雪怡,张桂芝
(湖北中医药大学药学院,武汉 430065)
盐酸罗沙替丁醋酸酯(roxatidine acetate hydrochloride,ROX)为第4代H2受体拮抗剂[1],口服后吸收良好,在小肠、血浆和肝脏内经酶化反应转换为活性代谢物罗沙替丁[2]。ROX临床上用于治疗和预防胃溃疡、十二指肠溃疡、吻合部溃疡、反流性食管炎、胃炎或溃疡的急性发作等因胃酸分泌过多所导致的消化系统疾病[3-4]。该药除了抑酸作用较强,还可抑制胃蛋白酶分泌,对泌乳素和血清胃泌素等无明显影响,并对消化系统的组织结构具有一定保护作用[5]。由于治疗消化系统溃疡性疾病常需要长期给药,而ROX的生物半衰期较短(约0.74 h),需反复多次给药,因此降低了患者用药顺应性[6-7]。笔者在本实验采用星点设计-效应面法(central composite design-response surface methodology,CCD-RSM)优化制剂处方并制备了ROX胃漂浮缓释片[8-9],旨在延长ROX作用时间,提高ROX的生物利用度以及患者的顺应性。
1 仪器与试药
1.1仪器 1200LC高效液相色谱仪(Agilent,G1315B可变波长检测器);十万分之一天平(上海赞维衡器有限公司,型号:ZA305AS,感量:0.1 mg,0.01 mg);单冲压片机(上海天九机械制造厂,型号:TDP-5);智能药物溶出仪(天津盛达三合光学仪器有限公司,型号:RC-806)。
1.2试药 ROX原料药(北京丰德医药科技有限公司,含量>99%,批号:150301);ROX对照品(本实验室自制,原料药精制,批号:160321,含量>99%);羟丙基甲基纤维素(HPMC,100M)、十八醇、碳酸氢钠(NaHCO3)、乳糖、微粉硅胶均购于安徽山河药用辅料股份有限公司,药用规格;人工胃液(自制,0.1 moL· mL-1盐酸);乙腈和甲醇等试剂为色谱纯;实验用水为超纯水。
2 方法与结果
2.1ROX胃漂浮缓释片的制备 按制剂处方分别称取主药与辅料,过筛孔内径125 μm筛(120目),并按等量递增法逐步混匀;按片质量0.5%加入润滑剂,混匀;采用粉末直接压片法压制成ROX胃漂浮缓释片(规格:ROX 每片75 mg,片质量:400 mg,片径:10 mm)。
2.2体外释放度测定
2.2.1色谱条件 采用高效液相色谱法(HPLC)检测ROX含量。色谱柱:Agilent C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-0.02%磷酸缓冲液(三乙胺调pH值至5.20)(1:1);检测波长:275 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:20 μL;以外标法定量。
2.2.2溶液的配制 储备液:精密称取ROX 0.0203 g,置100 mL量瓶,加人工胃液适量,振摇溶解,加人工胃液至刻度,作为储备液。对照品溶液:精密称取ROX对照品约17 mg,置100 mL量瓶,加流动相溶解并稀释至刻度,摇匀,制成ROX浓度为0.1732 mg·mL-1对照品溶液。供试品溶液:取ROX胃漂浮缓释片10片,研碎混匀,精密称取粉末400 mg,置1000 mL量瓶,加流动相溶解并稀释至刻度,摇匀,经孔径0.45 μm滤膜滤过;取续滤液,即得供试品溶液。阴性对照溶液:按照ROX胃漂浮缓释片处方(除ROX外),制成空白制剂10片,研碎混匀,精密称取粉末400 mg,同上述供试品溶液制备方法制成阴性对照溶液。
2.2.2线性关系和方法学考察 分别精密量取储备液0.5,1,2.5,3,5 mL,分别加人工胃液,稀释至10 mL,摇匀,配制成10.15,20.30,50.75,60.90,81.20,131.95 μg·mL-1ROX待测溶液,并按色谱条件进行测定。根据测定结果可知ROX在10.15~131.95 μg·mL-1范围内,其回归方程为A=0.005C-0.000 8;R2=0.999 8(n=6),ROX峰面积(A)与ROX浓度(C)线性关系良好。分别取对照品溶液、供试品溶液、阴性对照溶液,按色谱条件进行测定,记录色谱图。ROX保留时间约8.30 min,且色谱峰峰形良好;阴性对照在ROX峰位置无干扰;供试品中ROX与其他组分达基线分离,分离度不低于1.5,理论板数以ROX峰面积计不低于5000;精密度实验中RSD=0.09%(n=6);稳定性试验中样品溶液室温放置24 h的峰面积RSD=0.27%(n=6);按处方量80%,100%,120% 精密称取ROX,并按处方比例加入其他辅料,制备成3种不同浓度的ROX溶液,平均回收率分别为98.89%,99.86%,99.68%,RSD分别为0.89%,1.06%,0.94%(n=3),均符合要求。
2.2.3释放度测定方法及漂浮性能考察 按《中华人民共和国药典》2015年版第四部0931项下第一法(转篮法)进行体外释放度测定,转速为100 r·min-1,温度(37±0.5)℃,以人工胃液900 mL为释放介质;分别于1,4,8 h取样5 mL,同时补加等体积同温的人工胃液;取上述5 mL样液经孔径0.45 μm微孔滤膜滤过,取续滤液适量,按色谱条件进行测定并计算药物的浓度和累积释放度;同时将缓释片置于该释放条件下,观察并记录起漂与续漂时间。
2.3处方优化
2.3.1实验设计 分别以X1、X2、X3表示ROX胃漂浮缓释片每一片中HPMC、十八醇及NaHCO3用量,通过单因素实验和预实验可知,X1、X2、X3是影响ROX胃漂浮缓释片的漂浮性能和药物释放的主要因素。因此,利用CCD-RSM设计了三因素五水平实验[10-11];表1设置了实验因素水平及其对应的物理量,表2显示了实验设计及结果;并确定1,4,8 h累积释放度Q1h(15%~25%)、Q4h(45%~55%)、Q8h(75%~85%)为考察指标,即于第1小时时累积释放度达15%~25%,于第4小时时累积释放度达45%~55%,于第8小时时累积释放度达75%~85%。综合评分Y(%)=|Q1h-20%∣+∣Q4h-50%∣+∣Q8h-80%∣,其中∣Q1h-20%∣、∣Q4h-50%∣、∣Q8h-80%∣分别表示在1,4,8 h释放度与评价标准的偏差,因此Y值越小越好。
表1 考察因素水平及其对应物理量
Tab.1Independentvariablesandtheirvaluesincodedandphysicalform
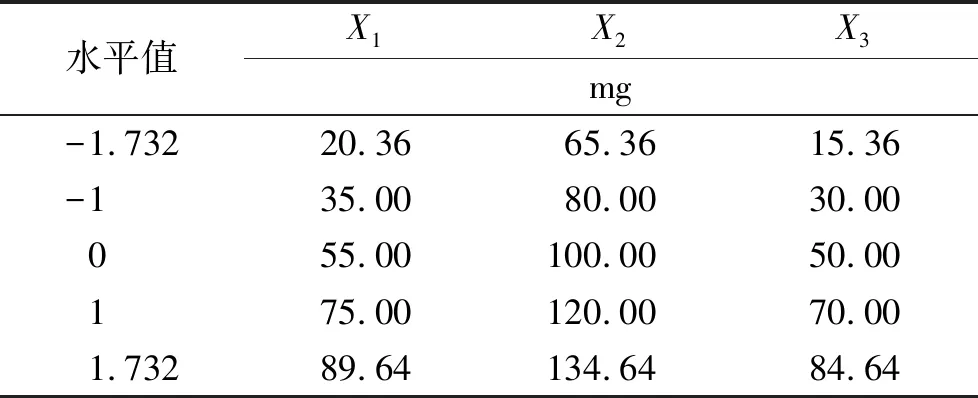
水平值X1X2X3mg-1.73220.3665.3615.36-135.0080.0030.00055.00100.0050.00175.00120.0070.001.73289.64134.6484.64
2.3.2模型拟合 用Design Expert 8.0.6版软件将实验数据进行模型拟合,按显著性(P<0.05)、r2最大原则,优选出最佳拟合方程为二次模型方程[12]。表3为对拟合方程各项系数的方差分析结果,t检验在P<0.02水平上经简化得到以下拟合方程。
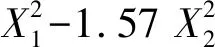
表3结果表明,简化后的模型方程P<0.05,R2>0.90,方程可信度较高。
2.3.3响应面 运用Design Expert 8.0.6版软件,分别以1,4,8 h累积释放度Q1h、Q4h、Q8h对各辅料的用量X1,X2,X3做三维响应面图、等高线图和等高线叠加图(NaHCO350.00 mg),以Q8h为例(图1,2)。
2.4处方优化与处方验证 通过Design Expert 8.0.6版软件拟合及预测,从效应面或重叠等高线图上筛选最优效应域,通过非线性模型拟合并优选出最佳制剂处方[13]。综合考虑,最佳制剂处方为:HPMC 55 mg、十八醇100 mg、NaHCO350 mg、乳糖118 mg、微粉硅胶2 mg。按照最佳制剂处方制备了3批ROX胃漂浮缓释片进行处方验证。1,4,8 h累计释放度实测值分别为20.2%,51.4%,79.8%,预测值分别为20.8%,51.2%,78.9%(n=3),结果表明经CCD-RSM优化的处方在1,4,8 h释放度符合标准,且模型预测性良好;起漂时间<5 min,持续漂浮时间>8 h,满足设计要求且重复性良好[14]。
2.5释药机制考察 缓释制剂体外释放可按零级动力学、一级动力学、Higuchi和Ritger-Peppas等释放模型进行拟合,将ROX胃漂浮缓释片(按最佳处方制备)体外释放数据按上述模型进行拟合,结果见表4。
对表4结果分析可知,制剂体外释放曲线与Ritger-Peppas方程拟合程度较高[15]:ln(Q/100)=0.668 1 lnt-1.605 5,R2=0.999 8;n=0.668 1;该模型中的n描述了释放机制:当n≤0.45时,药物主要以Fick扩散机制释放;当0.45
表2 实验设计及结果表
Tab.2Experimentaldesignandtestresultsn=3
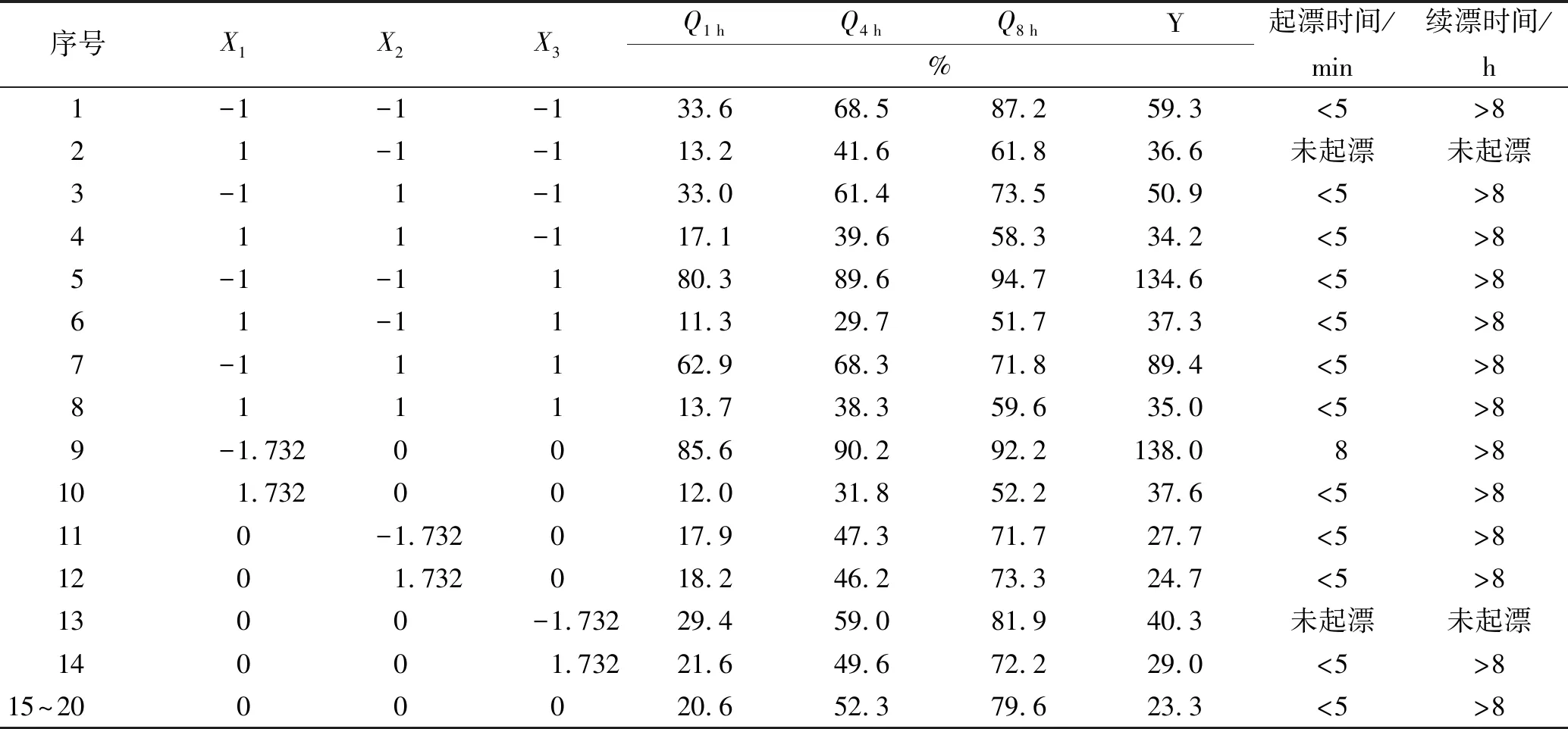
序号X1X2X3Q1 hQ4 hQ8 hY%起漂时间/min续漂时间/h1-1-1-133.668.587.259.3<5>821-1-113.241.661.836.6未起漂未起漂3-11-133.061.473.550.9<5>8411-117.139.658.334.2<5>85-1-1180.389.694.7134.6<5>861-1111.329.751.737.3<5>87-11162.968.371.889.4<5>8811113.738.359.635.0<5>89-1.7320085.690.292.2138.08>8101.7320012.031.852.237.6<5>8110-1.732017.947.371.727.7<5>81201.732018.246.273.324.7<5>81300-1.73229.459.081.940.3未起漂未起漂14001.73221.649.672.229.0<5>815~2000020.652.379.623.3<5>8
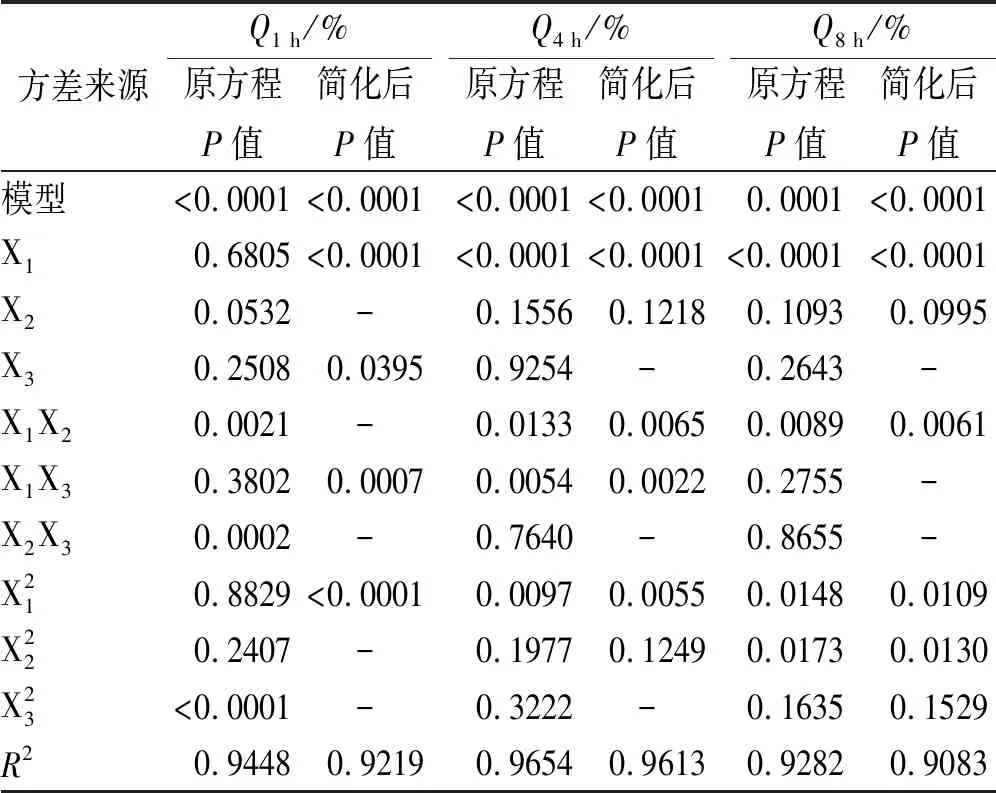
表3 回归模型方差分析
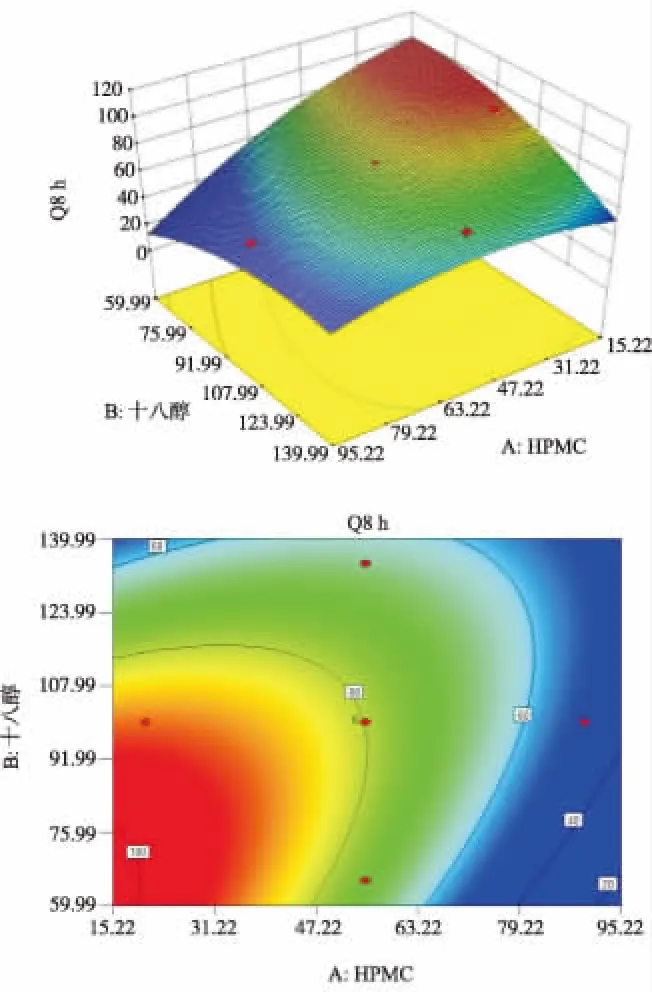
图1X1、X2对Q8 h影响的响应面图(A)和等高线图(B)
Fig.1Responsesurfaceplot(A)andcontourdiagram(B)ofX1andX2versusQ8h
3 讨论
笔者在本实验对制剂处方中HPMC、十八醇、NaHCO3三者用量进行考察,并通过CCD-RSM设计实验安排并对其结果进行拟合分析,以较少试验次数,准确建立了数学模型,拟合了效应变量对考察因素变量的效应面。模型具较好预测性,实验结果较理想。
处方中选用高黏度HPMC作为ROX胃漂浮缓释片骨架材料,是因为高黏度HPMC比低黏度HPMC水化速率低,且具有密度较小、膨胀体积较松大的特点,有助于片剂的漂浮。亲水凝胶在释放介质中能够快速水化并形成凝胶层,该凝胶层内包裹着许多细小气泡使片剂体积增大而密度降低,使其能持续漂浮于介质表面。选用十八醇作助漂剂可提高片剂的漂浮性能。选用NaHCO3作为发泡剂,其与胃酸反应生成CO2气体,增加漂浮力;同时CO2的释放,使片剂产生大量孔道,有利于水分渗入和药物释出。制剂中乳糖作为填充剂;由于ROX具一定引湿性,加入适量微粉硅胶作助流剂,压片时不仅可防止黏冲、降低颗粒间摩擦力,还可使片面光滑美观。该制剂采用粉末直接压片法,其制备工艺简单、便于工业化生产。
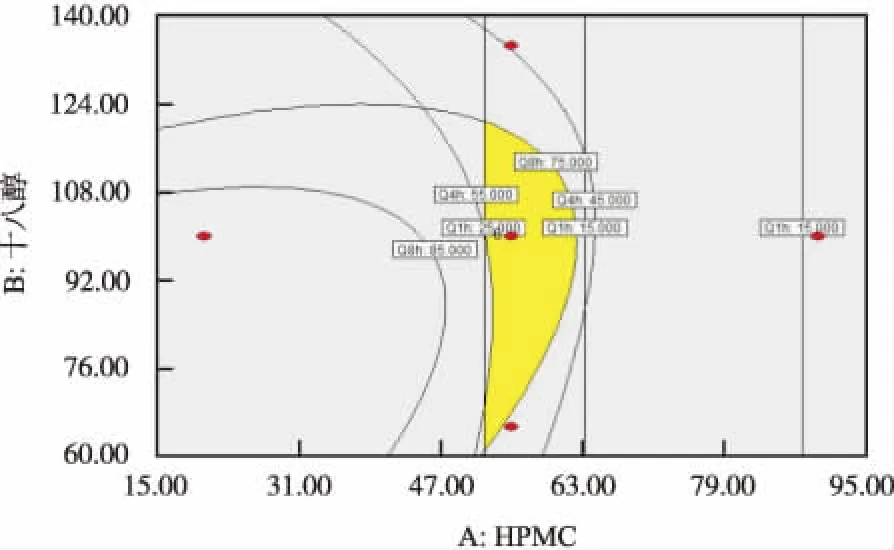
图2 ROX于 1,4,8 h累积释放百分率等高线图
Fig.2ContourmapofcumulativereleasepercentageofROXat1,4or8h
表4 漂浮片释放曲线的拟合结果
Tab.4Fittingresultsofthereleasecurveofgastricfloatingtablets

拟合模型拟合方程R2零级动力学模型Q=8.4762 t+14.85710.978 1一级动力学模型ln(100-Q)=-0.2623 t+5.09460.996 2Higuchi方程Q=35.0806 t 1/2-14.59560.928 2Ritger-Peppas模型ln(Q/100)=0.6681 lnt-1.60550.999 8

