术前外周血中纤维蛋白原水平与肾癌患者预后的关系
王永辉,宋永胜,李原学,马天明,郭 昊,徐 奔
(1.辽宁省健康产业集团抚矿总医院泌尿外科,辽宁抚顺 113008;2.中国医科大学附属盛京医院泌尿外科,辽宁沈阳 110000;3.北京大学第一医院泌尿外科,北京 100034)
肾癌是泌尿系统最常见的恶性肿瘤之一,占成人所有恶性肿瘤的2%~3%[1]。尽管肾癌的诊断和治疗手段在不断进步,但仍有约1/3的肾癌患者在诊断之初就已有局部进展或者转移,且此类患者的预后仍然堪忧,如转移性肾癌的5年生存率只有大约10%,因此,寻求对肾癌的预后有预测价值的标志物以识别高危患者,对此类患者的临床决策和后续积极监测至关重要。
血浆中纤维蛋白原是一种糖蛋白,主要产生于肝脏。近年来的多项流行病学研究表明,纤维蛋白原不仅参与凝血机制,其在肿瘤的发生发展中也发挥作用,许多研究证实术前血浆纤维蛋白原可以作为预后因子预测多种肿瘤的生存结局[2-5]。本研究旨在探讨术前血浆纤维蛋白原的水平与肾癌临床病理特征和肾癌手术患者预后的关系。
1 资料与方法
1.1 临床资料收集北大医院泌尿外科2010至2012年诊断为肾癌并行肾根治性切除或肾部分切除术的患者共280例,所有病例均经术后病理证实诊断。所有患者术前均无其他类型恶性肿瘤病史、无淋巴结转移及远处转移,且均无血栓性疾病,均未接受抗凝治疗。临床病理资料从患者电子病历中获取,所有病例病理及临床资料完整。
患者术后随访在术后前2年内每3个月1次,2年后每6个月1次。随访项目包括血常规、生化、胸片、腹部超声/腹部计算机断层扫描(computed tomography,CT)。随访方式包括电话随访,门诊随访等,本研究随访时间2~75个月,中位随访时间65个月。
本研究研究终点为总体生存时间(overall survival,OS)、肿瘤特异生存时间(cancer-specific survival,CSS)和无病生存时间(disease-free survival,DFS)。OS是术后到任何原因导致的死亡的时间,CSS是指从术后到由肾癌引起的死亡的时间,DFS是指术后至肿瘤出现复发或转移的时间。
1.2 统计学方法使用SPSS 24.0软件对所得数据进行分析。采用受试者工作特征曲线(receiver operator characteristic,ROC曲线)计算外周血纤维蛋白原水平的最佳临界值。根据最佳临界值将所有患者分为两组,比较两组患者之间的临床及病理学特征。计数资料组间比较采用2检验。以Kaplan-Meier法计算生存率,并绘制生存曲线,用log-rank检验比较组间生存差异。采用Cox风险回归模型对预后影响因子进行多因素分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 ROC曲线确定术前外周血中纤维蛋白原的最佳临界值根据ROC曲线(图1),确定351 mg/dL为术前外周血中纤维蛋白原的最佳临界值。
2.2 术前外周血中纤维蛋白原水平与肾癌临床病理因素的关系以351 mg/dL为临界值将所有患者分为两组。280例患者有184例术前外周血纤维蛋白原水平≤351 mg/dL,有96例>351 mg/dL。高水平的血浆纤维蛋白原与高龄、高血压、更高的肿瘤分级以及更晚的病理分期相关。而与性别、糖尿病以及肾癌组织学类型无关(表1)。
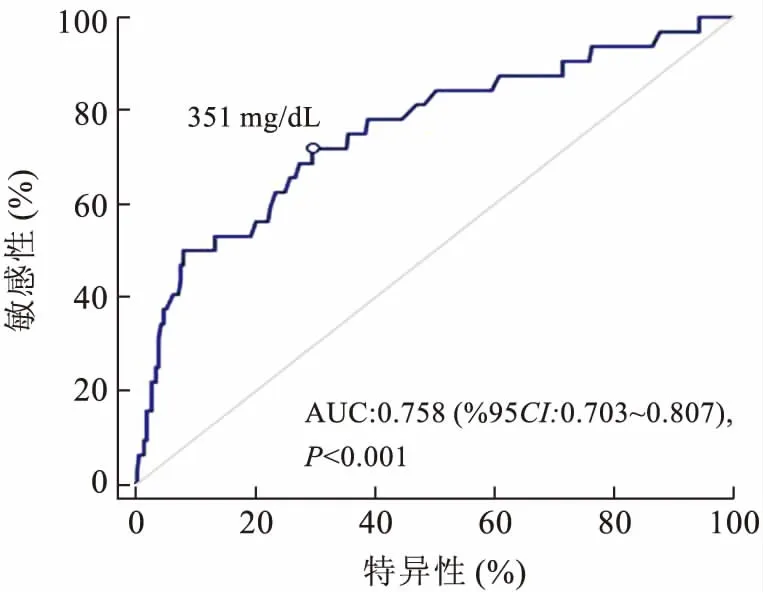
图1 ROC曲线对外周纤维蛋白原最佳临界值的提示

表1 不同血浆纤维蛋白原分组的临床资料比较 [例(%)]
2.3 临床病理特征与肾癌患者预后的关系Kaplan-Meier法生存分析结果显示,高水平的外周血纤维蛋白原与更差的OS、CSS及DFS有关(表2、图2)。此外,较高的肿瘤分级(G3~G4)与较低的肿瘤分级(G1~G2)相比有更差的OS、CSS和DFS。较晚的肿瘤病理分期(pT3~pT4)与较早的肿瘤病理分期(pT1~pT2)相比预后更差。
表2 肾癌术后患者预后因素的单因素生存分析

预后因素总体生存时间HR(95%CI)P值肿瘤特异生存时间HR(95%CI)P值无复发生存时间HR(95%CI)P值年龄1.571(0.706~3.497)0.2201.037(0.435~2.471)0.9351.146(0.576~2.279)0.688性别0.899(0.423~1.909)0.0740.965(0.425~2.192)0.9331.584(0.821~3.056)0.136高血压1.106(0.547~2.236)0.7760.972(0.452~2.091)0.9430.891(0.487~1.632)0.711糖尿病2.202(0.789~6.139)0.0472.314(0.758~7.068)0.0491.246(0.519~2.987)0.594术前血浆纤维 蛋白原5.490(2.608~11.556)<0.0015.114(2.274~11.503)<0.0013.003(1.579~5.710)<0.001肿瘤分级8.978(2.832~28.460)<0.00111.349(3.214~40.083)<0.0016.157(2.232~16.984)<0.001病理分期9.044(3.166~25.834)<0.0018.949(2.833~28.270)<0.0016.186(2.492~15.356)<0.001组织学类型1.261(0.401~3.965)0.6641.525(0.439~5.293)0.4320.863(0.327~2.278)0.779
HR:风险比;CI:可信区间。

图2 不同术前血浆纤维蛋白水平肾癌患者的生存曲线
2.4 临床病理特征预测肾癌预后的多因素分析使用Cox风险回归模型进行多因素分析,结果显示无论对于OS还是CSS,术前纤维蛋白原水平和病理分期都是独立预后因子。然而对于DFS,只有肿瘤分级和病理分期是其独立预后因子(表3)。
表3 肾癌术后患者预后因素的多因素分析
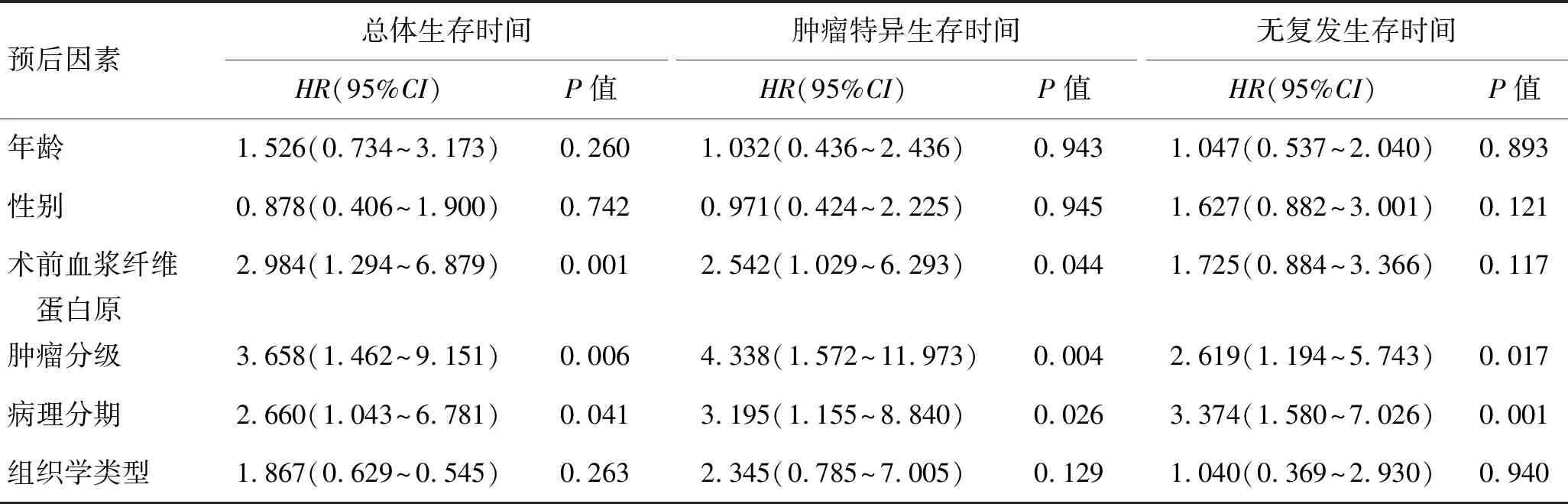
预后因素总体生存时间HR(95%CI)P值肿瘤特异生存时间HR(95%CI)P值无复发生存时间HR(95%CI)P值年龄1.526(0.734~3.173)0.2601.032(0.436~2.436)0.9431.047(0.537~2.040)0.893性别0.878(0.406~1.900)0.7420.971(0.424~2.225)0.9451.627(0.882~3.001)0.121术前血浆纤维 蛋白原2.984(1.294~6.879)0.0012.542(1.029~6.293)0.0441.725(0.884~3.366)0.117肿瘤分级3.658(1.462~9.151)0.0064.338(1.572~11.973)0.0042.619(1.194~5.743)0.017病理分期2.660(1.043~6.781)0.0413.195(1.155~8.840)0.0263.374(1.580~7.026)0.001组织学类型1.867(0.629~0.545)0.2632.345(0.785~7.005)0.1291.040(0.369~2.930)0.940
HR:风险比;CI:可信区间。
3 讨 论
长久以来,肿瘤的核分级、病理分期以及病理类型是临床常用的评估癌症患者预后的重要指标[6]。然而这些指标都是术后病理获取。如何在术前更加准确地识别那些预后较差的肿瘤患者,进行肿瘤的危险分层,对于治疗方案的选择和术后随访的指导都有着重要的意义。因此寻找能够精准预测肿瘤预后的生物标志物成为目前临床研究的一大热点。
近年来许多研究表明,术前外周血纤维蛋白原水平与多种恶性肿瘤的生存结局有关,较高的血浆纤维蛋白原水平与肺癌、卵巢癌、肝癌、胰腺癌、结肠癌、上尿路尿路上皮癌、前列腺癌等多种肿瘤更差的病理学特征相关,并可以预测这些肿瘤术后的生存结局[2-4]。纤维蛋白原影响肿瘤生存结局进而影响患者预后的可能机制包括:①纤维蛋白原及其降解产物可以增强血小板对癌细胞的粘附,从而有利于癌细胞转移,故而纤维蛋白原水平由高到低可作为肿瘤受到抑制的一个信号,而纤维蛋白原水平继续升高,往往预示肿瘤转移的可能[7];②恶性肿瘤能够通过相关因子激活凝血酶原[8],从而增加纤维蛋白原的活性,纤维蛋白原活性升高可以使血液处于高凝状态,为癌细胞聚集、附着和浸润提供基础,因此纤维蛋白原水平越高,癌细胞广泛附着及转移的可能性越大[9]。
肿瘤患者外周血纤维蛋白原水平升高的具体机制包括[10]:①肿瘤患者合成功能往往比较活跃,可以合成更多的纤维蛋白原,同时肿瘤细胞通过诱导血管内皮细胞分泌大量纤溶酶原激活物,刺激机体合成大量的纤维蛋白原[11];②肿瘤作为一种消耗性疾病,消耗体内大量蛋白,肝脏代偿性合成蛋白增多,间接也会引起纤维蛋白原合成增加[12];③机体对抗肿瘤是一种系统性炎症反应,纤维蛋白原作为一种急性期反应蛋白会出现升高[13];④机体受肿瘤侵袭刺激,体内释放的IL-6及糖皮质激素增多,在二者的共同刺激下,肝外纤维蛋白原合成组织合成的纤维蛋白原明显增加;⑤肿瘤患者体内可出现肿瘤细胞脱落,进而形成癌栓,导致部分循环受阻形成血栓,引起继发性纤溶亢进,这一过程中产生的纤维蛋白原降解产物反馈刺激,可以引起纤维蛋白原升高[14];⑥肿瘤细胞释放入血后,与内皮细胞及血小板相互作用,释放活性物质可以激活血小板,散在的a颗粒含有的纤维蛋白原分子被释放进入血液循环;⑦血小板亦可分泌富组氨酸糖蛋白,与纤维蛋白原结合从而阻止纤维蛋白原向纤维蛋白的转变[15]。
对于肾癌,ERDEM等[16]认为,血浆纤维蛋白原水平与肾癌的肿瘤大小、肿瘤分级、TNM分期以及转移与否相关,并可以作为CSS和DFS的独立预后因子。DU等[17]的研究也表明术前血浆纤维蛋白原水平是OS和DFS的独立预后因子。本研究结果表明,术前血浆纤维蛋白原水平与年龄、高血压、肿瘤分级、肿瘤病理分期密切相关(P=0.035,P=0.006,P<0.001,P<0.001),这提示纤维蛋白原可能参与了肾癌的疾病进展过程,这与之前的的研究结论一致。单因素分析结果显示,血浆纤维蛋白原水平、肿瘤的分级、病理分期与患者总生存时间显著相关(P均<0.001)。进一步通过Cox回归模型分析发现,术前血浆纤维蛋白原水平是肾癌术后患者总体生存时间和肿瘤特异生存时间的独立预后因子(HR=2.984,P=0.001;CSS:HR=2.542,P=0.044),但不是无病生存时间的独立预后因子。本组临床实验中,部分术前分期考虑为T1的肾癌采用了肾部分切除术治疗,众多循证医学证据及Meta分析结果已充分证明[18-20],对于T1期肾癌,行肾部分切除术并不会对患者预后造成影响,患者的总生存期取决于肿瘤本身的分期分级,而与采用何种术式无关,故未将280例肾癌患者按术式分类讨论,因为具体术式并不会对肾癌的预后产生有统计学意义的影响。
血浆纤维蛋白原水平作为术前常规的检测指标,其结果易得,因此采用术前外周血纤维蛋白原对肾癌患者的预后进行评估简单、敏感,并不增加患者的经济负担和躯体痛苦。这一研究具有相应的临床意义。本研究同样存在一定的缺陷,如研究属于回顾性队列研究,并不能得出确定的因果关系。而且因没有对患者术后进行固定随访,故无法获取患者术后的纤维蛋白原水平,如果患者术后纤维蛋白原水平显著降低,可能更会证实血浆纤维蛋白原在肿瘤发生发展或侵袭转移中的重要作用,目前笔者研究团队已在另一组肾癌人群中进行此项工作的相关数据搜集,结论将在后续的研究中予以公布。另外,研究样本量较少,随访时间相对较短,发生终点事件的人数较少等,未来需进一步设计前瞻性队列研究,增加样本量并延长随访时间,以进一步验证术前血浆纤维蛋白原与术后生存的相关性和预测价值。

