程序性细胞死亡配体1在非小细胞肺癌手术切除标本及配对组织芯片中的表达分析*
苗茜,林根,徐海鹏,吴标,郑晓彬,蒋侃,力超
350014 福州,福建省肿瘤医院·福建医科大学附属肿瘤医院 胸部内科(苗茜、林根、徐海鹏、吴标、郑晓彬、蒋侃),病理科(力超)
免疫治疗是目前肺癌治疗领域里继手术、化疗、放疗、靶向治疗后新出现的极有潜力的新型治疗方法。该方法通过使肿瘤免疫正常化,减少抗肿瘤的豁免,从而让患者得到持续性的临床获益。程序性死亡受体1-蛋白及程序性死亡配体1(programmed death-ligand 1,PD-1/PD-L1)抗体是在非小细胞肺癌(non-small cell lung cancer,NSCLC)中研究最多的免疫检测点抑制剂。目前,PD-1及PD-L1抗体已被批准在晚期NSCLC临床一线及二线使用。PD-L1检测可用于预测PD-1/PD-L1抑制剂的优势人群,PD-L1表达越高,治疗效果越好。Atezolizumab是针对PD-L1的人源化的IgG1单克隆抗体,目前已被批准在NSCLC中一线及二线使用[1-3]。PD-L1(SP142)VENTANA法是美国食品药品监督管理局批准的针对Atezolizumab使用PD-L1补充诊断检测方法。与其他PD-L1检测方法不同,该方法除了检测肿瘤细胞(tumor cells,TC)中PD-L1的表达情况,还检测了免疫细胞(immune cells,IC)中PD-L1表达情况,高表达的患者(即评价≥ 50% TC或者≥ 10% IC)可能从Atezolizumab的治疗中延长生存[1]。我们通过检测手术切除标本及其配对微陈列组织标本(tissue microarrays,TMA)的PD-L1(SP142 VENTANA法)表达情况,了解肿瘤内PD-L1表达的一致性,并且进一步分析PD-L1的表达与临床病理特征之间的关系。
1 材料与方法
1.1 标本收集及临床资料
纳入2008年10月至2010年12月在福建省肿瘤医院接受手术的NSCLC患者,收集到经福尔马林固定及石蜡包埋的手术标本129例。术后分期根据第8版美国癌症联合会(American Joint Commitfee on Cancer,AJCC)TNM系统进行分期,病理类型根据2015年世界卫生组织肺癌诊断标本进行分类。患者均未在手术前接受过治疗,所有患者未使用过免疫治疗。
1.2 配对TMA的构建
所有供体组织蜡块行常规病理切片后做HE染色,病理专家作二次诊断,并在HE 切片上根据典型病理形态区域作标记,阵列制作利用组织芯片制作仪(Beecher Instruments.Inc)在受体蜡块(空白蜡块)上打孔(直径2.0mm),然后根据HE片上精确范围在供体组织蜡块相应位置获取所要组织芯放入受体蜡块阵列孔中,并记录组织编号,重复上述步骤制成阵列块4块(共150点),所得的组织芯片的每个点都经过病理诊断。
1.3 染色与判读
在获得手术标本和配对的TMA后,将每个FFPE组织和TMA切成4μm,并使用兔单克隆抗体(克隆SP142; Ventana,Roche Group,Tucson,AZ)在自动染色平台上进行免疫组织化学(immunohistochemistry,IHC)检测(Benchmark ULTRA; Ventana),使用浓度为1:60[1]。使用OptiView DAB IHC检测试剂盒(Ventana)和OptiViewAmplification Kit(Ventana)来显示结合的抗PD-L1一抗; 切片用苏木精复染。IC表达被划分为IC0vsIC1vsIC2vsIC3,TC1/2/3或IC1/2/3定义为肿瘤细胞或肿瘤微环境浸润性免疫细胞中PD-L1表达大于等于1%,TC2/3或IC2/3定义为PD-L1表达大于等于5%;TC3定义为肿瘤细胞中PD-L1表达大于等于50%,而IC3定义为肿瘤微环境浸润性免疫细胞中PD-L1表达大于等于10%;TC0与IC0为PD-L1表达不到1%。总体判读时以TC与IC高分作为判读,如TC3分及IC0分时,总体判读仍为3分。
1.4 统计学方法
使用SPSS22.0软件进行统计学分析,描述性统计数据用于总结患者的人口统计学和结果。协议统计(Cohen的κ系数)用于评估配对病变之间PD-L1表达的异质性。一致性水平被归类为差(≤0.4)、一般(0.40~0.75)和良好(≥0.75)。Fisher精确检验用于比较组内的比例。以P<0.05为结果有统计学意义。
2 结 果
2.1 患者一般临床特征
129例患者中年龄大于60岁患者50例,占全部人群38.8%,小于60岁患者79例,占全部人群61.2%;男性88例,占全部人群68.2%,女性41例,占全部人群31.8%;既往吸烟史患者55例,占全部人群42.6%,不吸烟患者74例,占全部人群57.4%;病理鳞癌、肉瘤样癌、腺癌及腺鳞癌分别45例、1例、70例及13例,占全部人群34.9%、0.8%、54.3%及10.1%;TNM(AJCC分期第7版)I期、II期、III期、IV期分别为28例、26例、60例及15例,占全部人群21.7%、20.2%、46.5%及11.6%(表1)。
表1 患者的一般临床特征、病理类型及TNM分期
Table 1. General Clinical Characteristics, Pathological Types and TNM Stage of Patients

VariableNN %Age≤60y7961.2>60y5038.8

VariableNN %Sex Male8868.2Female4131.8Smoking historyNo7457.4Yes5542.6HistologySquamous cell carcinoma4534.9Sarcomatoid carcinoma10.8Adenocarcinoma7054.3Adenosquamous carcinoma1310.1TNM stageⅠ2821.7Ⅱ2620.2Ⅲ6046.5Ⅳ1511.6
2.2 手术标本与配对TMA中PD-L1表达比较
所有的标本中有59例(46.0%)手术标本判读阳性(TC1/2/3和/或IC1/2/3),而在相应配对的TMA中只有31例(24.0%)判读阳性(TC1/2/3和/或IC1/2/3);24例(18.7%)手术标本判读阳性(TC2/3和/或IC2/3),而在相应配对的TMA中只有18例(14.0%)判读阳性(TC2/3和或IC2/3);10例(8.7%)手术标本判读强阳性(TC3和/或IC3),在相应配对的TMA中有8例(6.2%)判读强阳性(TC3和或IC3),见表2和图1(手术标本及TMA的TC均判读强阳性)。总体不一致率为41.9%,k值等于0.235(一致性差)。 IC的不一致率远高于TC(39.5%vs15.5%),k值为0.113vs0.489(一致性差与中等一致性)。总体阴性(TC0/IC0)显示出中度的不一致性为49.6%,100例(77.5%)在手术标本和配对TMA中均被认为是TC 0,然而,只有74例(57.4%)显示出IC0的一致性。有3例手术标本判读为IC3,但在配对TMA中未观察到IC3。与低评分组(TC1/IC1)相比,可以看到高PD-L1评分组(TC3/TC2/IC3/IC2)具有更好的一致性。不同组织学亚型不一致率之间存在趋势差异,鳞状细胞癌(squamous cell carrcinoma,SCC)中TC1-3/IC1-3评分不一致率为33.3%(手术标本为46.7%阳性表达,配对TMA为26.7%阳性表达),k值等于0.408;腺鳞癌(adenosquamous corr cinoma,ADC)中TC1-3 /IC1-3评分不一致率为48.5%(手术标本为45.2%阳性表达,配对TMA为22.6%阳性表达),k值等于0.134(一致性差);其他病理类型中TC1-3/IC1-3评分不一致率为为35.7%(手术标本为57.1%阳性表达,配对TMA为28.6%阳性表达),k值等于0.444,详见表2~4。在大部分标本中,配对TMA较手术标本都低评了PD-L1的表达,详见图2(手术标本的IC判读强阳性,TMA的IC判读阴性)。但是在少数几个样本中见到手术标本阴性或弱阳性而配对TMA判读阳性,详见图3手术标本的TC判读弱阳性,TMA判读强阳性)。6例在手术标本中判读阴性(TC0/IC0)的标本在配对TMA中判读为阳性,2例判读为TC1,4例判读IC1。与TC相关的不一致率为31%,而与IC相关的不一致率为69%。分析中可见,在手术标本中IC阳性率(39%)高于TC阳性率(19%),但是在TMA标本中IC与TC的阳性率都为15%,TC3与IC3的样本并无关联。
表2 手术标本与配对TMA标本最终 SP142判读
Table 2. Final Interpretation of SP142 Stain in Surgical Specimens and Paired Tissue Microarrays

Surgical sampleChip sample-1+2+3+-1003101+273502+53333+2125
2.3 PD-L1表达与总生存曲线的关系
就总生存期而言,无论是通过手术标本IHC染色结果来进行判断(图4),还是通过配对TMA标本结果进行判断,与PD-L1表达阴性的患者相比,表达PD-L1阳性(TC1/2/3和或IC1/2/3)的患者都没有无优势,差异无统计学意义(55.2 个月vs55.1 个月,P=0.624;53.5个月vs55.2 个月,P=0.833)。
表3 手术标本与配对TMA标本TC SP142判读
Table 3. Interpretation of SP142 Stain in Tumor Cells in Surgical Specimens and Paired Tissue Microarrays

Surgical sampleChip sample-1+2+3+-1003101+61102+22333+2005
表4 手术标本与配对TMA标本IC SP142判读
Table 4. Interpretation of SP142 Stain in Immune Cells in Surgical Specimens and Paired Tissue Microarrays

Surgical sampleChip sample-1+2+3+-1003101+61102+22333+0125

图1 手术标本强阳性,配对TMA标本强阳性(TC)
Figure1.StronglyPositiveExpressioninBothSurgicalSpecimensandPairedTissueMicroarrays(TumorCells)
Panel A and B show hematoxylin and eosin stain and immunohistochemical staining of PD-L1 (SP142) in surgical specimens and paired tissue microarrays. The red circle indicates the area of tissue microarrays in corresponding resected specimens. PD-L1 expression is highly concordant between surgical specimens and paired TMA.

图2 手术标本强阳性,配对TMA阴性 (IC)
Figure2.StronglyPositiveExpressioninSurgicalSpecimensandNegativeExpressioninPairedTissueMicroarrays(ImmuneCell)
Panel A and B show hematoxylin and eosin stain and immunohistochemical staining of PD-L1 (SP142) in surgical specimens and paired tissue microarrays. The red circle indicates the area of tissue microarrays in corresponding resected specimens. PD-L1 (SP142) expression in TMA specimens underestimate that in matched resected surgical specimens.
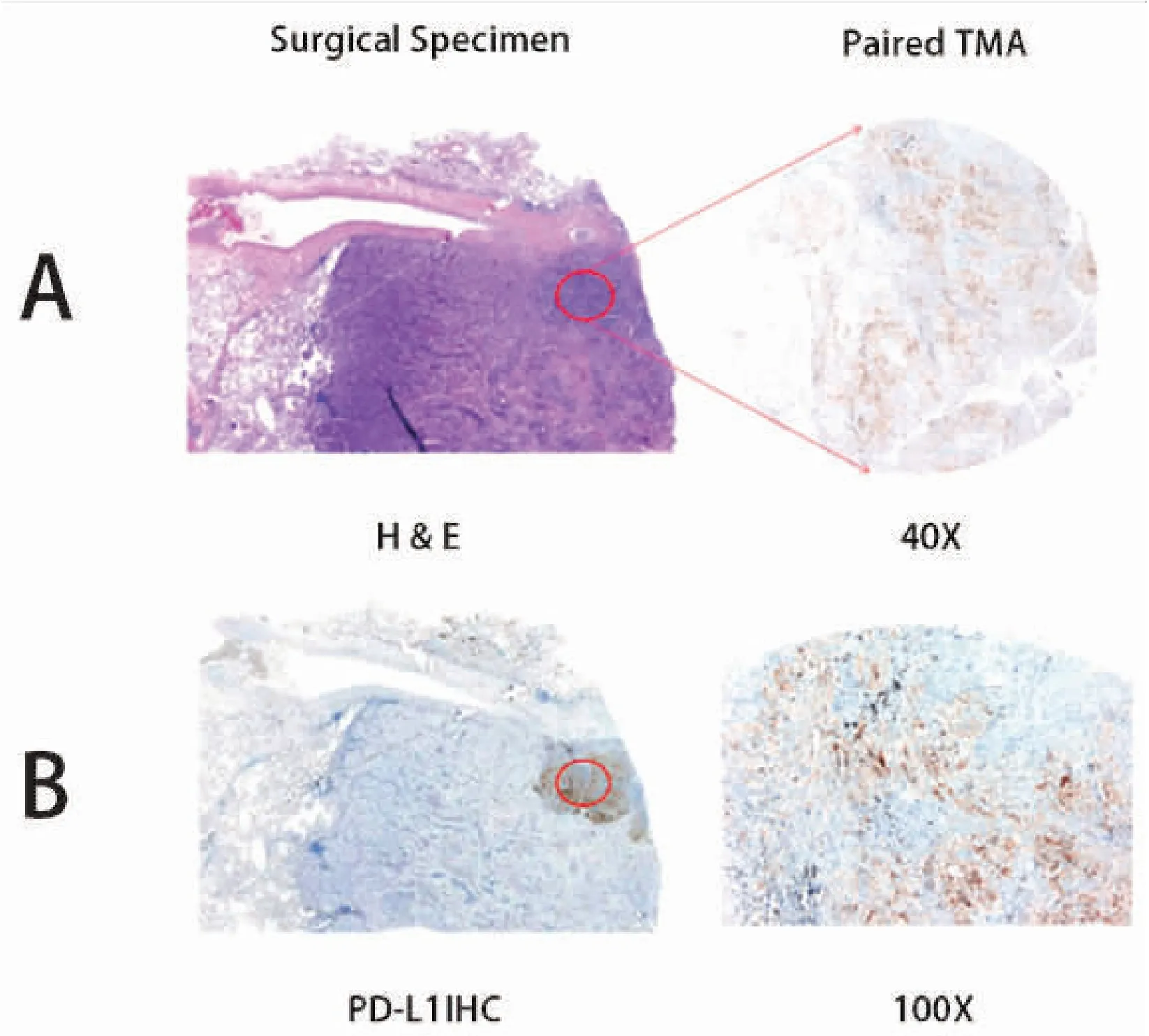
图3 手术标本弱阳性,配对TMA强阳性(TC)
Figure3.WeaklyPositiveExpressioninSurgicalSpecimensandStronglyPositiveExpressioninPairedTissueMicroarrays(TumorCells)
Panel A and B show hematoxylin and eosin stain and immunohistochemical staining of PD-L1 (SP142) in surgical specimens and paired tissue microarrays. The red circle indicates the area of tissue microarrays in corresponding resected specimens. PD-L1 (SP142) expression in TMA specimens underestimate that in matched resected surgical specimens.

图4 总生存期与手术标本中PD-L1表达情况的相关性
Figure4.CorrelationbetweenOverallSurvivalandPD-L1ExpressionofSurgicalSpecimen
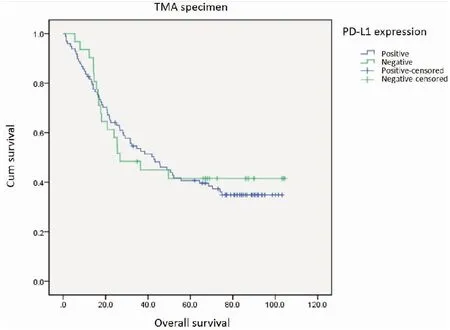
图5 总生存与TMA标本中PD-L1染色情况的相关性
Figure5.CorrelationbetweenOverallSurvivalandPD-L1ExpressionofTMASpecimen
3 讨 论
在免疫治疗的运用中,有效的疗效预测因子有助于筛选能够获得最佳疗效受益人群,也是广受关注的热点之一。PD-L1是目前研究和临床中应用最多的生物标志物[4-5],但是,由于PD-L1本身检测试剂克隆号较多,不同检测平台以及不同的判读标准等问题导致其“预测角色”需要谨慎而辩证地对待[6]。PD-L1主要表达在肿瘤细胞表面或肿瘤浸润的微环境中,但不是所有肿瘤细胞都有表达PD-L1[3],并且PD-L1的表达本身存在时间与空间的异质性,即同一个患者不同时期的PD-L1的表达可能是不一致的,不同病灶之间甚至同一病灶之间都存在这种表达不一致的异质性。因此,以检测PD-L1表达情况作为预测免疫治疗疗效的指标时存在一定局限性,尤其目前临床上对晚期肺癌患者往往使用穿刺小标本进行检测,这会导致更加明显的不稳定性[7-8]。
目前临床在进行PD-L1检测时送检的病理标本往往为气管镜或肺穿刺及淋巴结穿刺的小标本,小标本是否能够完全代表整个肿瘤的PD-L1表达情况呢?本研究基于这个想法进行了初步探索。我们收集了129例手术标本,以手术标本来模拟整个肿瘤,配对TMA来模拟临床送检的小标本,通过检测PD-L1表达的情况,探讨两者间一致性问题。TMA技术是将若干石蜡包埋块上的各种组织转移到一个新石蜡块上重新构建微型化高通量组织阵列的方法,可以有效地进行各类临床病理组织的观察和研究。TMA技术可以在一块切片上同时放置几十到一百个样品,进行高通量的基因和蛋白质分析,且能够充分利用组织资源,将多个样品的平行实验一次性完成。这项技术近些年主要用于鉴定肿瘤特征的生物标志物,并可用于进行预测标志物筛选或通过回顾性研究寻找生物疗法的潜在靶点[9-11]。
有几项研究对NSCLC的手术标本及相应穿刺小标本进行了PD-L1表达的一致性探索,但大多数研究的结果都表现出不一致性。其中,仅有Kitazono等[12]的研究显示了良好的一致性,该研究纳入了79例患者,其手术标本与活检小标本的一致性高达92%。但llie等[9]开展的另外一项研究纳入了160例NSCLC患者,分析了手术前诊断小标本与术后标本的PD-L1表达情况,无论在TC还是IC的判读上都有较差的一致性,在判读阴性的小标本中与术后标本判读的不一致性(57/128,46%)。Kitazono的研究使用的PD-L1检测试剂与llie使用的检测试剂克隆号不一致可能是导致结论差异较大的原因,Kitazono的研究使用的PD-L1检测抗体为catalog no.4059,llie使用的PD-L1检测抗体为SP142。本研究结果与llie研究相似(总体不一致率为41.9%)。在所有标本中,小标本均较手术标本低判了PD-L1的表达,这一点与绝大多数研究相似。本研究除了发现配对TMA低判PD-L1的表达的情况外,还发现了配对TMA标本高判的情况,这主要与肿瘤的异质性特别是空间异质性有关。本研究与llie均使用SP142进行PD-L1检测,不同之处则在于本研究使用手术标本与其配对TMA进行比较,而非术前穿刺小标本,这在最大限度上减少了肿瘤的空间异质性与时间异质性。
另外,我们的研究还发现IC的不一致率远高于TC(39.5%vs15.5%),k值为0.113vs0.489(一致性差与中等一致性)。这种差异主要是病理学家对于IC的判读困难造成的,TC通常显示为膜染色,IC显示为细胞质染色,与小淋巴细胞形态难以鉴别,均表现为点状信号,因此病理学家对于IC的判断似乎更加困惑,这一点在既往研究及我们的研究中都可以看到[3]。
另外TC是阳性肿瘤细胞与肿瘤细胞总数的比值,IC的判读是对于阳性细胞占肿瘤区域的比值,区域主观性更强更模糊,除此之外,病理医师对免疫细胞的观察能力的不同,这些都导致不同病理科医生的判读结果一致性差。这一点在蓝印计划中同样得到证实,病理学家在对任何抗体染色的TC进行评分时显示出极好的一致性,但对用任何抗体染色的IC评分差异较大[7]。
在石蜡包埋组织的IHC研究中,在使用5%的细胞染色阈值判读阳性标准时,不同文献报道的PD-L1阳性表达范围从19.6%到57.5%[12-14]。在我们的研究中,以同样5%的细胞染色作为阈值判读的阳性率仅为24例(18.7%)(TC3/2和/或IC3/2),远低于其他研究数据,这可能与本研究使用SP142抗体有关。Rimm等[13]的研究在2个独立的染色平台上评估了4种不同的PD-L1抗体,由多名病理科医生盲态下对4种不同克隆号的PD-L1检测判读的一致性进行了比较,研究中比较了DakoLink 48平台上的28-8抗体,Dako Link 48平台上的22c3抗体,Ventana Benchmark平台上的SP142抗体和Leica Bond平台上的E1L3N抗体。在90个样本中,SP142抗体的判读与其余三个克隆号的判读结果显示了统计学上低判差异,而另外3个克隆号的判读结果显示了较好的一致性。一些研究发现PD-L1的表达率可能与肿瘤分期、预后有关[14-17],但2019年发布的EXPRESS研究结果则显示PD-L1的表达与人种、年龄、性别、病理类型、吸烟史、原发灶或转移灶都没有相关性,而是主要跟EGFR及ALK是否突变状态有关,这是目前真实世界研究中关于PD-L1(22C3抗体)最大样本量的数据。本研究为中国较大样本量的真实数据研究,结果显示,PD-L1的表达情况与患者的总生存情况也无相关性,与EXPRESS研究类似[18]。由于本研究样本量较小,该结果尚需在规模更大的患者组中验证。
PD-L1在TMA样本中往往出现低判,这部分解释了临床治疗时部分PD-L1阴性的患者接受免疫治疗仍可能有效,因此在临床活检标本出现阴性的情况下,我们需慎重对待,尽可能多结合其他免疫预测指标综合考虑,比如需要结合TMB等其他标志物避免遗漏获益患者。本研究在避免了时间异质性的基础上手术标本与配对TMA仍表现出不一致性,这可能与空间异质性有关,因此如果临床操作可行的话,进行多点穿刺送检标本的PD-L1表达可能更有指导意义。
我们的研究未对标本的表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)及鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene homolog,KRAS)情况进行评估,因此并未进一步分析PD-L1表达与EGFR、ALK及KRAS之间的关联。有证据表明,驱动基因EGFR的突变激活免疫逃避,此外,EGFR酪氨酸激酶抑制剂治疗可下调PD-L1在NSCLC细胞系中的表达。这与目前研究中EGFR突变的患者PD1/PD-L1单抗治疗效果欠佳有一定相符性[18],EXPRESS中也提到EGFR突变患者免疫治疗效果不好,各大指南中目前也是排除EGFR、ALK突变患者在一线使用免疫治疗。另外,本研究为术后标本,生存预后主要与分期有关,因此在统计权重上占过多比例可能导致其他因素与预后的相关性不强。最后,本研究最大的局限性在于回顾性研究,且没有PD-1/PD-L1单抗后续治疗的进一步研究。
总体而言,在不尽如人意的临床数据中大家认识到,尽管PD-L1不是一个最佳的生物标志物,但是在目前有限的预测指标中仍是可用的生物标志物。在强阳性的判读中仍然有较好的指导意义,但是在中等阳性及阴性的判读中,小标本是否能够代表全身PD-L1表达状态的意义需要慎重考虑,对于选择优势人群或者剔除非优势人群仍然存在较大的困扰。多点穿刺标本减少空间异质性可能值得在临床进行推荐,这需要更多的临床研究进一步证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

