矮牵牛PhPYL4基因的克隆与表达分析
董 冬,王雪娣,刘同瑞,尹 伟,谢 宛,董丽丽
(1.淮南师范学院 生物工程学院/资源与环境生物技术安徽普通高校重点实验室,安徽淮南 232038;2.安徽农业大学 园艺学院,合肥 230036)
逆境胁迫对植物的生长发育会产生严重的影响,如干旱和盐等非生物胁迫[1-2]。因此,培育抗逆性强的植物新品种对提高农业生产力、提升生产效率以及节约利用水和土地等自然资源均具有重要意义。脱落酸(Abscisic acid,ABA)作为一类重要的植物激素,不但参与植物的生长发育,如种子萌发和休眠、开花、气孔关闭等,还能够参与植物的多种逆境胁迫[3-4]。
PYRABACTIN RESISTANCE1(PYR1)/PYR1-LIKE(PYL)/REGULATORY COMPONENTS OF ABA RECEPTORS(RCAR)是最先在拟南芥中鉴定的ABA受体,在ABA信号转导中发挥着重要作用[5-6]。研究表明 PYR1/PYLs/RCAR家族共有14个成员,分别命名为PYR1和PYL1-13(RCAR1- RCAR14)。其中,PYL4被认为是泛素化蛋白[7],能够与RING FINGER OF SEED LONGEVITY1(RSL1)相互作用,且RSL1促进其体内降解[8]。而FYVE1/FREE1能够与PYL4相互作用,介导其向液泡降解途径的传递[9]。此外,转基因试验发现:拟南芥PYL4的过量表达能够提高植物的抗旱性[10],烟草NtPYL4在毛状根中的过表达引起生物碱积累的下降[11]。上述研究结果表明PYL4参与植物的抗逆及次生代谢过程。然而,PYL4是否参与矮牵牛对植物的逆境胁迫响应,目前并不清楚。
矮牵牛(PetuniahybridaVilm.)是一种重要的园林观赏植物和模式植物,培育抗逆性强的新品种是矮牵牛育种的重要方向。本研究从矮牵牛中分离PYL4的同源基因,并对该基因的生物学信息及其在不同组织及不同逆境处理下的表达特性进行分析。以期为丰富PYL4调控植物的抗逆机理奠定理论基础,并为培育抗逆性强的矮牵牛新品种提供基因储备。
1 材料与方法
1.1 试验材料
将供试材料矮牵牛W115系(Petunia×hybrida‘Mitchell’)实生苗种植于组培室中,培养条件:昼夜温度为25 ℃/23 ℃,光照强度为300 μmol·m-2·s-2,光周期为16 h/8 h。
1.2 PhPYL4的克隆
根据公布的腋花矮牵牛(Petuniaaxillaris)基因组序列(https:∥solgenomics.net/),分别设计全长引物PYL4-F:ATGCTTCCTAATTCTC AAAGCTCAT和PYL4-R:TCAAGTAGCCTTTCTTCTGCTCAAA。将矮牵牛叶片经液氮研磨后,使用TRIzol(Invitrogen,美国)试剂提取RNA,选取OD260/OD280>1.8且无降解的RNA,使用TransScript○ROne-Step gDNA Removal and cDNA Synthesis SuperMix(全式金)反转录合成第一链cDNA。使用高保真酶KOD-Plus-Neo(TOYOBO,日本)进行扩增获得PhPYL4序列。扩增条件为:94 ℃预变性2 min;98 ℃变性10 s,58 ℃退火30 s,68 ℃延伸60 s,共35个循环。将克隆获得的序列连接到pEASY-Blunt Simple载体(全式金),鉴定阳性克隆送由通用生物系统(安徽)有限公司进行测序。
1.3 生物信息学分析
使用DNAMAN 6.0软件对蛋白相似性比进行分析。使用Protparam tool (http:∥web.Expasy.org/protparam/)对蛋白质的分子质量、等电点、分子式、氨基酸组成及疏水性等进行分析。使用Clustal X 2.0和MEGA 5.0等软件进行蛋白遗传聚类分析。
1.4 PhPYL4的表达分析
表达分析试验均以30 d株龄的矮牵牛作为试材。分别取矮牵牛的根、嫩茎、叶片,提取RNA并反转录合成cDNA,用于PhPYL4的组织特异性表达分析;将矮牵牛幼苗根系于8:00置于含有200 mmol·L-1NaCl的霍格兰氏营养液中[12],分别于处理12 h和24 h后取叶片,提取RNA并反转录,用于盐胁迫下PhPYL4表达水平的检测;将矮牵牛幼苗根系于8:00置于含有体积分数为10% PEG-6000(Polyethylene Glycol 6000)的霍格兰氏营养液中[12],分别于12 h和24 h后取叶片,提取RNA进行反转录,用于干旱胁迫下PhPYL4基因的表达水平分析;于8:00对矮牵牛叶面喷施ABA(Abscisic acid,50 μmol·L-1)[13],分别于12 h和24 h后取叶片,提取RNA并进行反转录,用于检测ABA处理下基因的表达水平。以上所有试验每个处理取10株苗,并设置3个生物学重复。
为获得的PhPYL4的全长序列作为参考,利用Primer primer 5软件设计荧光定量PCR引物:PYL4-RT-F:TAAACCACCTCAACAACTACAA,PYL4-RT-R:AACAAAAACACACG- TCTCATCC。取2 μg RNA,使用TransScript○ROne-Step gDNA Removal and cDNA Synthesis SuperMix(全式金)试剂盒进行反转录,获得cDNA模板。按照ChamQTMUniversal SYBR○RqPCR Master Mix(诺唯赞)的操作步骤,分别使用ABI 7500 Fast实时PCR系统和7500软件(version 2.0.4)进行荧光定量PCR和数据分析。以矮牵牛ACTIN作为内参基因,采用2-ΔΔCT方法计算基因的相对表达量[14]。
2 结果与分析
2.1 PhPYL4基因全长序列的克隆及序列分析
根据已经公布的腋花矮牵牛基因组序列,设计引物扩增获得PhPYL4的cDNA序列(图1)。测序结果表明,PhPYL4基因序列全长为645 bp,共编码214个氨基酸。推测PhPYL4蛋白的分子质量为23.60 ku,等电点为8.67,分子式为C1022H1662N306O316S10,不稳定系数为43.62,脂溶指数为89.11,亲水性平均值(GRAVY)为 -0.239。该蛋白中相对含量较多的氨基酸依次为Val (11.7%)、Thr (9.3%)、Ser (8.4%)、Arg (7.0%)、Ile (6.5%)、Leu (6.5%)。总的带负电荷的残基(Asp+Glu)为18个,总的带正电荷的残基(Arg+Lys)为22个。

M.DL2000
2.2 PhPYL4蛋白的序列分析
将PhPYL4推测的蛋白序列与已公布的烟草、苜蓿、蓖麻、拟南芥等蛋白序列进行比对,序列相似性分别为91.63%、68.22%、62.44%和 57.08%(图2),推测PhPYL4是PYL4的同源蛋白。利用NCBI Conserved Domains软件对PhPYL4序列进行分析,PhPYL4序列具有保守的疏水性配体结合结构域,隶属于SRPBCC(START/RHOalphaC/PITP/Betv1/CoxG/CalC)超家族,推测可能具有该基因家族的生物学功能 (图3)。

NaPYL4.烟草(XP_019243979)Nicotianatabacum(XP_019243979);MtPYL4.苜蓿(XP_003623366.1)Medicagotruncatula(XP_003623366.1);RcPYL4.蓖麻(XP_002526675.1)Ricinuscommunis(XP_002526675.1);PYL4.拟南芥(NP_565887.1)Arabidopsisthaliana(NP_565887.1)
图2 PhPYL4与其他物种PYL4的比对
Fig.2 Alignment of PhPYL4 with other PYL4

图3 PhPYL4蛋白质结构域分析Fig.3 Structure domain analysis of PhPYL4
2.3 PhPYL4的系统发育分析
为研究PhPYL4与其他物种中PYL4的亲缘关系,利用MEGA 5.0软件,将矮牵牛PhPYL4与已公布的烟草、杨树、向日葵、裂叶牵牛、棉花、黄瓜等15个物种的PYL4序列进行聚类分析,并构建系统发育进化树。结果表明:PhPYL4与其他物种中的PYL4起源相同,但在进化的不同时期逐渐与其他物种分离开来。PhPYL4和烟草NtPYL4聚为一枝,亲缘关系最近,而与胡杨PePYL4和橡胶HbPYL4亲缘关系较远(图4)。
2.4 PhPYL4的组织特异性表达分析
为研究PhPYL4的表达特性,利用荧光定量PCR技术,对PhPYL4在矮牵牛不同组织中的表达水平进行检测。如图5所示:PhPYL4在矮牵牛的根、茎、叶中均有表达。PhPYL4的表达水平从高到低依次为:叶>茎>根。叶片中的表达量约为根中的14倍,而茎中的表达量约为根中的6倍。说明PhPYL4的表达具有明显的组织特异性。

图中的分支点数字表示基于500次重复该节点的自展支持率 The nodes in the figure show the bootstrap values based on 500 replications; 标尺代表遗传距离 The scale represents the genetic distance;PePYL4.胡杨 (XP_011019068.1)Populuseuphratica(XP_011019068.1); HbPYL4.橡胶 (XP_021669328.1)Heveabrasiliensis(XP_021669328.1); CsPYL4.黄瓜 (XP_004148626.1)Cucumissativus(XP_004148626.1); GaPYL4.棉花 (XP_017603732.1)Gossypiumarboreum(XP_017603732.1); TcPYL4.可可 (XP_007026589.1)Theobromacacao(XP_007026589.1); OePYL4.橄榄 (XP_022882332.1)Oleaeuropaea(XP_022882332.1); SiPYL4.芝麻 (XP_011095066.1)Sesamumindicum(XP_011095066.1); HaPYL4.向日葵 (XP_021987876.1)Helianthusannuus(XP_021987876.1);LsPYL4.莴苣(XP_023760467.1)Lactucasativa(XP_023760467.1);CaPYL4.辣椒 (XP_016543230.1)Capsicumannuum(XP_016543230.1); InPYL4.裂叶牵牛 (XP_019161230.1)Ipomoeanil(XP_019161230.1); StPYL4.马铃薯(XP_006363617.1)Solanumtuberosum(XP_006363617.1);NtPYL4.烟草(XP_016465801.1)Nicotianatabacum(XP_016465801.1); DcPYL4.胡萝卜 (XP_017253785.1)Daucuscarota(XP_017253785.1);EsPYL4.山俞菜 (XP_006411045.1)Eutremasalsugineum(XP_006411045.1)
图4 不同物种PYL4的系统进化分析
Fig.4 Phylogenetic analysis among different PYL4
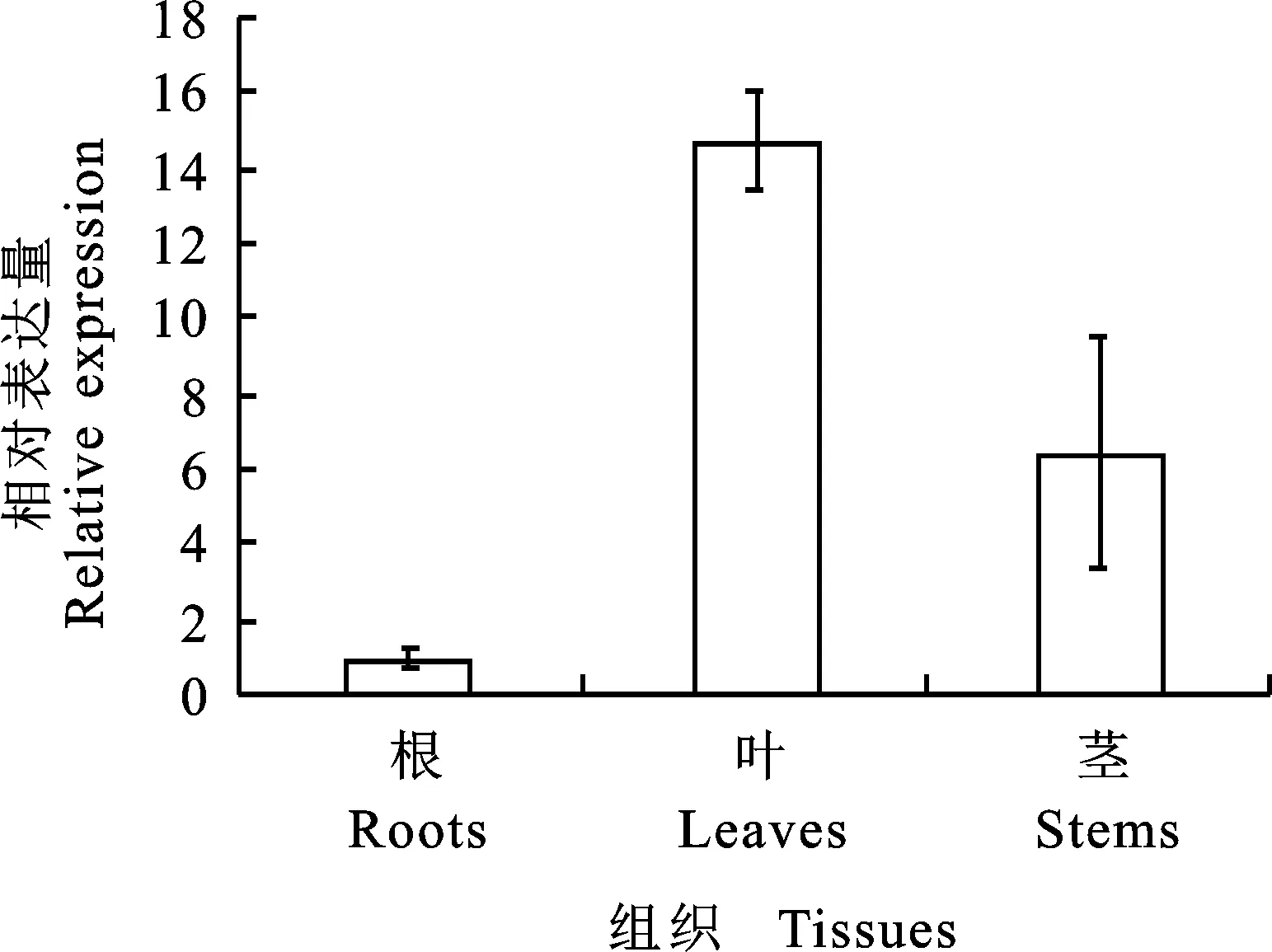
图5 矮牵牛不同组织 PhPYL4的相对表达量Fig.5 Relative expression of PhPYL4 in different tissues of Petunia
2.5 PhPYL4在不同胁迫下的表达分析
2.5.1 盐胁迫 为研究盐胁迫对PhPYL4的调控,对矮牵牛进行NaCl处理,分别于处理后 12 h和24 h对PhPYL4的表达水平进行检测,以置于营养液中的矮牵牛作为对照。结果表明:盐胁迫处理12 h后,PhPYL4的表达水平迅速上调为对照的6倍,而24 h后PhPYL4的表达水平逐渐下降为对照的4倍(图6)。说明PhPYL4参与了矮牵牛盐胁迫应答途径。
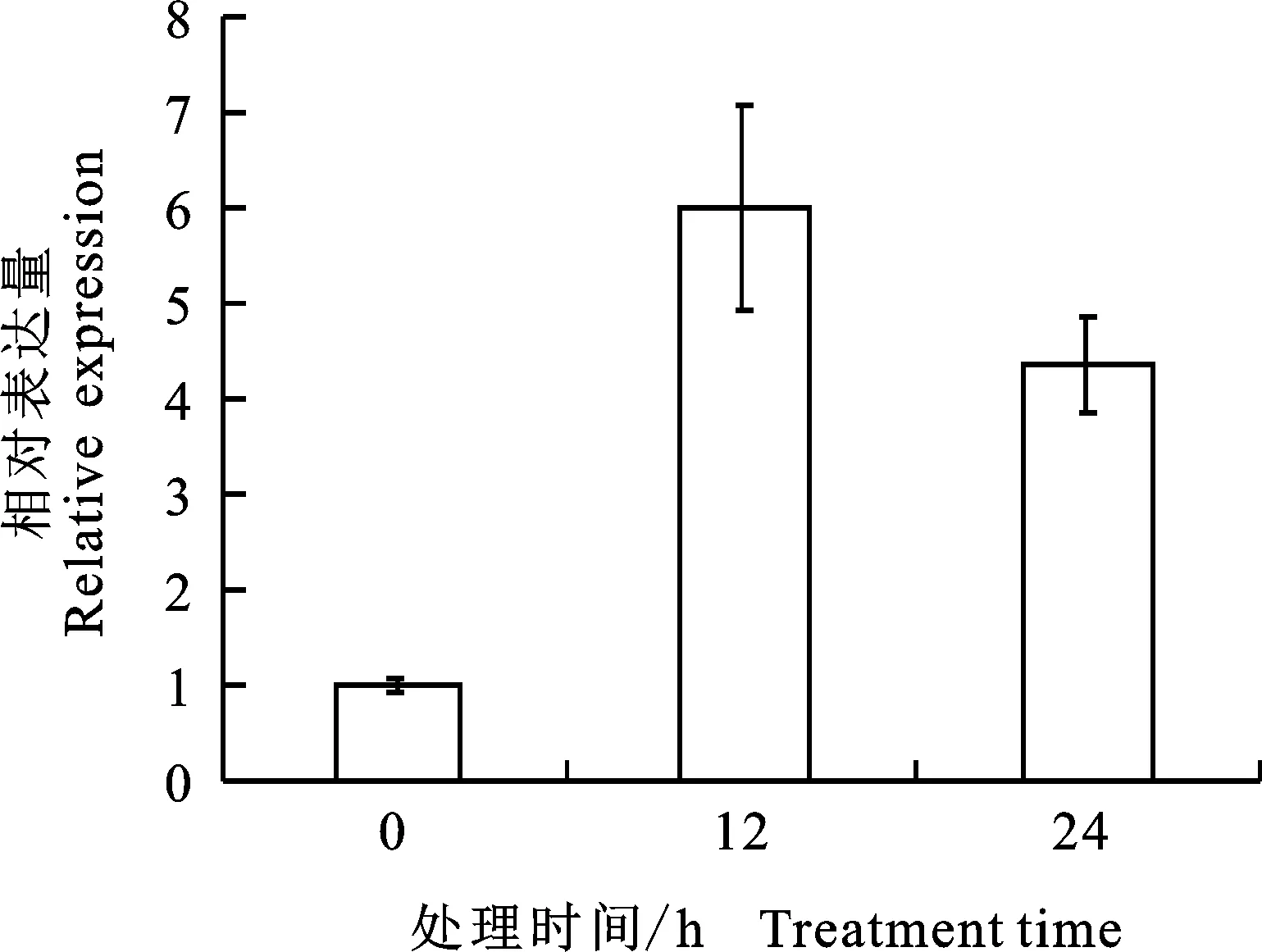
图6 PhPYL4在盐胁迫下的表达分析Fig.6 Expression analysis of PhPYL4 under salt stress
2.5.2 干旱胁迫 研究表明PYL的多个家族成员经过表达后提高了干旱胁迫耐性,为揭示PhPYL4是否能够响应干旱胁迫,分别在PEG模拟干旱处理12 h和24 h后检测该基因的表达水平,以置于营养液中的矮牵牛作为对照。结果显示:10% PEG-6000处理12 h后,PhPYL4的表达水平上升至对照的13倍。而处理24 h后,PhPYL4的表达水平为对照的10倍,相对于12 h时,表达水平有所下降(图7),说明干旱胁迫能够显著诱导PhPYL4的表达。
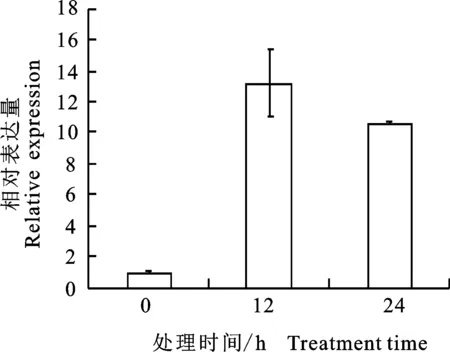
图7 PhPYL4在模拟干旱胁迫下的表达分析Fig.7 Expression analysis of PhPYL4 under drought stress
2.5.3 ABA处理 为研究ABA对PhPYL4的调控作用,分别在叶面喷施50 μmol/L ABA,于12 h和24 h后检测该基因的表达水平,并以未喷施ABA的矮牵牛作为对照。结果(图8)显示:ABA处理12 h后,PhPYL4的表达水平上调至对照的29倍。而处理24 h后,PhPYL4的表达水平为对照的11倍,相对于12 h时,表达水平显著下降。说明PhPYL4能够显著响应ABA信号的诱导,且随着处理时间的延长,响应减弱。
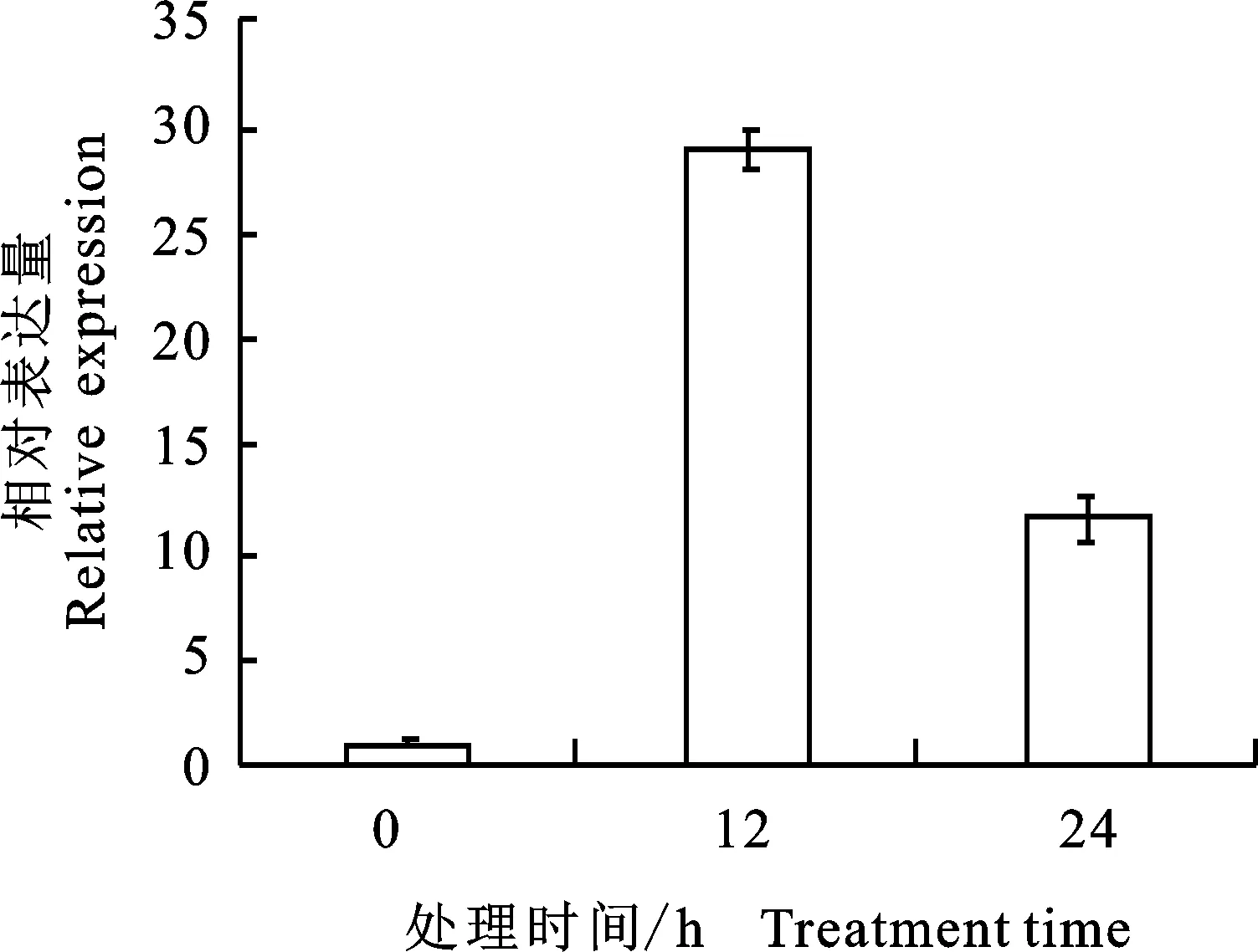
图8 PhPYL4在ABA处理下的表达分析Fig.8 Expression analysis of PhPYL4 under ABA treatment
3 讨 论
近年来,PYR/PYL/RCAR家族成员在毛果杨[15]、水稻[16]、短柄草[17]和棉花[18]等多个物种中得以鉴定,并被证明参与了干旱、盐及寒冷等非生物胁迫响应。本研究中,克隆了矮牵牛PhPYL4的全长序列,通过对PhPYL4蛋白序列的生物信息学分析,发现PhPYL4具有一个保守的疏水性配体结合结构域。相关研究表明,该结构域是PP2C蛋白磷酸酶的结合位点,PP2Cs能够与ABA受体相互作用从而抑制其活性[19],并激活下游路径。通过序列比对显示,PhPYL4与蓖麻、苜蓿等物种同源序列的整体相似性为 70.84%,表明PYL4在不同物种间具有较高的保守性。PhPYL4的系统发育分析表明,PhPYL4与同科物种烟草NtPYL4亲缘关系最近。综合以上结果,可以证实所克隆的PhPYL4属于PYR/PYL/RCAR蛋白家族成员,为PYL4的同源基因。
组织特异性表达分析显示,PhPYL4在茎、叶片、根中均有表达,而在叶片中的表达量最高,显著高于茎和根,这与杜梨PbPYL4在根、茎、叶中表达量差异较小的研究结果不同[20],说明PYL4在不同物种中的表达特性存在差异。对矮牵牛进行盐胁迫处理,结果显示PhPYL4的表达水平在12 h时上调,24 h时开始下降,说明PhPYL4参与了矮牵牛对高盐胁迫的响应过程。然而,对杜梨的研究发现:盐胁迫12 h时,叶片与根中PbPYL4表达量均上调,盐胁迫24 h时,根中PbPYL4表达量下降,而叶片中PbPYL4直到72 h时表达量开始下降[20]。此外,对拟南芥的研究发现,盐胁迫引起PYL4表达量的下调[21]。综合上述不同的研究结论,推测不同物种中PYL4的作用机制并不相同。PGE及外源ABA处理下,PhPYL4的表达水平同样呈现先上升(12 h)后下降(24 h)的趋势,说明PhPYL4能够快速对干旱及ABA处理作出应答。但PhPYL4的变化趋势与干旱及ABA处理引起拟南芥PYL4表达量下调的结果相反。然而,PYR1基因在盐、模拟干旱胁迫及ABA处理下分别上调了6.73、 14.72、10.78倍[21],这与矮牵牛PhPYL4对3种逆境条件下的响应趋势相似。该研究结果说明PYR/PYL/RCAR家族成员在不同物种中的作用机制不同。
综合上述研究结果,PhPYL4参与了矮牵牛响应干旱、盐胁迫及ABA信号途径,在调控矮牵牛的逆境响应机制中具有重要作用,但详细的分子调控机制需进一步探索。该研究为后续揭示PhPYL4的功能奠定了理论基础,同时为培育抗逆性强的矮牵牛新品种提供了候选基因。
——矮牵牛

