罗非鱼无乳链球菌环介导等温扩增LAMP检测技术的建立及应用
余艳玲 彭昊 冯世文
摘要:针对罗非鱼无乳链球菌Sip基因建立了LAMP检测方法,并对野外样本进行了无乳链球菌的调查研究。结果表明,目标Sip基因可在63 ℃ 40 min内被LAMP检测到,比PCR快约2 h,其DNA检测最低浓度为3.55×10-5 ng/μL,灵敏度比PCR高100倍,且对参考细菌无扩增。野外样品检测结果表明,运用LAMP检测技术对GBS的检出率为81.3%,比PCR高约20.0%。应用LAMP和PCR分别检测健康罗非鱼GBS检出率4.4%和2.2%,检测池塘水样品GBS检出率分别为10.0%和6.7%。
关键词:罗非鱼;无乳链球菌(GBS);环介导等温扩增(LAMP)
中图分类号:S917 文献标志码: A 文章编号:1002-1302(2019)13-0200-04
链球菌病已成为全球罗非鱼最严重的疾病之一[1],每年造成的经济损失达4 000多万美元[2-3]。过去数十年,我国罗非鱼链球病逐年增长,其优势种类已经从海豚链球菌(Streptococcus iniae)转变为无乳链球菌(S. agalactiae,也称B族链球菌或GBS)。过去5年,由链球菌导致的罗非鱼死亡率达15%~95%[2]。GBS不仅会引起水生或半水生生物[4-5],包括野生鱼类[6-7]和养殖鱼类[8-9]严重的疾病,也可导致新生儿严重的脑膜炎[10]和成人败血症[11-12]。人类或牲畜的GBS对罗非鱼具有潜在的感染性[13],而来自罗非鱼的GBS也可能导致人类感染[14]。因此,罗非鱼和/或水环境中GBS菌株的存在增加了公共卫生安全的风险,这就需要研发采取一种快速、灵敏和可靠的污染链球菌检测方法,通过采取适当的防控措施,保护易感染群体免受这种人畜共患病原体的侵袭。
环介导等温扩增技术(LAMP)是一种敏感、快速和低成本的检测方法,在等温条件下扩增靶基因核苷酸,通常在 1 h 内完成[15-16],扩增产物可通过浊度或荧光染料监测。此外,LAMP检测可在野外进行,因此可用于现场测定[16]。基于LAMP的优点,本研究开发了一种针对GBS Sip基因可用于野外现场检测的单步LAMP法,并对其特异性和灵敏性进行评价。
1 材料与方法
1.1 试验材料
1.1.1 细菌菌株 罗非鱼GBS菌株、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、嗜水气单胞菌(Aeromonas hydrophila)、维氏气单胞菌(Aeromonas veronii)、爱德华氏菌(Edwardsiella ictaluri)、哈氏弧菌(Briohatveyi)、创伤弧菌(Vibrio vulnificus)与海豚链球菌(S. iniae),均由广西水产遗传育种与健康养殖重点实验室鉴定和保存。
1.1.2 主要试剂 细菌全基因组DNA提取试剂盒购自北京康为世纪生物科技有限公司;Loopamp DNA扩增试剂盒购自日本荣研生物科技公司;PCR Master Mix、DNA Marker、钙黄绿素等,购自天根生化科技(北京)有限公司。
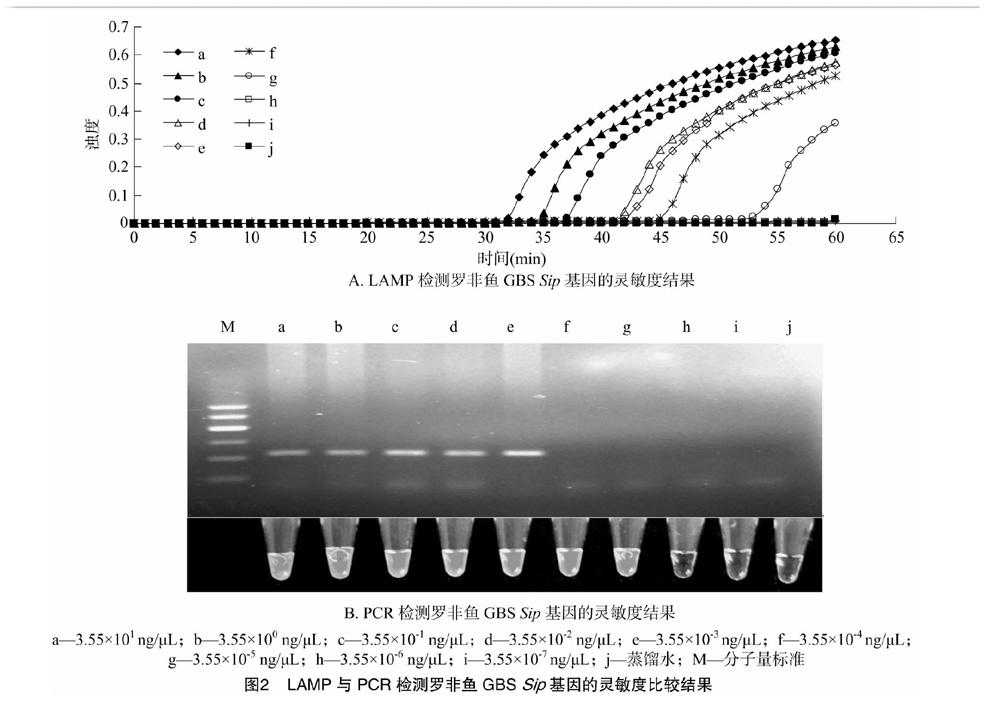
1.1.3 待检样品 2014年7—9月,从野外共收集样品490份,其中健康罗非鱼样品45份,患病罗非鱼样品415份及养殖罗非鱼的池塘水样品30份(表1)。
1.2 试验方法
1.2.1 基因组DNA的制备 将GBS接种到胰蛋白酶大豆肉汤(TSB)中,28 ℃下培养18 h,12 000 r/min离心10 min,沉淀重悬于200 μL PBS中,采用基因组DNA提取试剂盒提取细菌基因组DNA。取10 mg罗非鱼脑组织于0.9 mL PBS中清洗,无菌研钵研磨,采用基因组DNA提取试剂盒提取DNA。池塘水经离心沉淀后提取DNA。
1.2.2 引物设计与合成 根据GBS Sip基因序列(GenBank:HQ878436.1、DQ914255.1-DQ914274.1),采用Primer Explorer version 4(http:/primerexplorer.jp/lamp)设计GBS的LAMP引物。外部正向引物(F3)引物和反向引物(B3)序列分别为F3:5′-GTAGCAGCCCCTAGAGTG-3′,B3:5′-GTTGTGCTACCGGTGTTG-3′;内部正向引物(FIP)和反向引物(BIP)序列分别为FIP:5′-AGCTGATACATGCTCTGGTGATGGCAAGTGTTAAAGTAGTCACTC-3′,BIP:5′-GTTCCTGTGACTACGACTTCAACTTTTGTGCTACCGGAAGG-3′。NCBI BLAST程序检查引物序列的特异性。引物F3和B3用于PCR扩增,以对比LAMP的灵敏性和特异性。引物由生工生物工程(上海)股份有限公司合成。
1.2.3 LAMP反应检测 采用Loopamp DNA扩增试剂盒进行LAMP反应,反应体系为25 μL,其中FIP和BIP各 40 pmol,F3和B3各5 pmol,2×Reaction Mix 12.5 μL,钙黄绿素25 μmol/L,Bst DNA聚合酶1 μL,以及3.55×101 ng/μL基因组DNA 2 μL。LAMP反应在LA-320C实时浊度计中进行,在63 ℃测定60 min,然后在80 ℃灭活5 min。以蒸馏水代替DNA模板作为阴性对照。
1.2.4 PCR擴增检测 采用F3和B3为扩增引物进行GBS的PCR检测,扩增长度为196 bp。PCR反应总体积为25 μL,包括PCR Master Mix 12.5 μL,引物F3和B3各1 μmol/L、3.55×101 ng/μL基因组DNA 2 μL。反应条件为:94 ℃预变性2 min;94 ℃变性20 s,55 ℃退火30 s,72 ℃延伸30 s,30次循环;72 ℃最终延伸10 min。采用10 g/L琼脂糖凝胶电泳检测PCR产物,溴化乙锭染色,Bio-Rad Gel Doc EQ凝胶成像系统成像分析。
1.2.5 LAMP檢测的特异性 以GBS菌株作为阳性对照,以蒸馏水作为阴性对照,以大肠杆菌、沙门氏菌、嗜水气单胞菌、维氏气单胞菌、爱德华氏菌、哈氏弧菌、创伤弧菌和与海豚链球菌作为参考细菌,进行LAMP的特异性检测。
1.2.6 LAMP和PCR检测灵敏度比较 将罗非鱼GBS DNA连续10倍稀释,稀释后的浓度范围为3.55×101~3.55×10-7 ng/μL。应用LAMP和PCR方法分别对其进行检测,比较2种检测技术对GBS DNA的最低检测浓度。同时,采用直接目视检测法,LAMP反应在水浴中进行,当LAMP反应终止约1 h后,加入钙黄绿素染料进行终止反应,利用紫外光照射观察反应结果。
1.2.7 野外样本的检测 采用LAMP和PCR检测技术,分别对收集的490个野外样本进行了GBS检测。
2 结果
2.1 LAMP检测的特异性
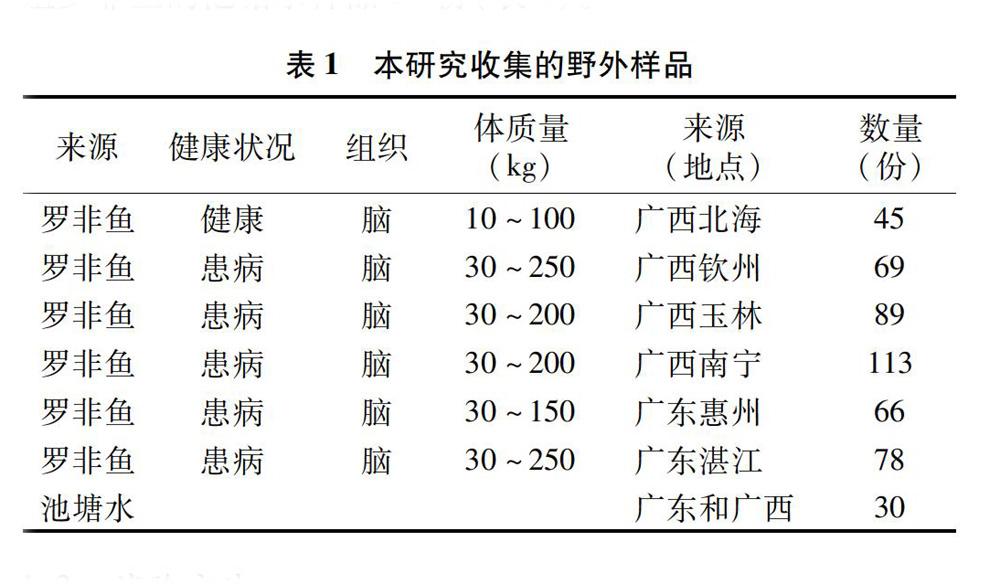
以GBS为阳性菌株,蒸馏水为阴性对照,8株罗非鱼养殖池塘中常见的细菌为参考菌株,对LAMP引物进行特异性检测,结果发现,仅GBS能检测到扩增产物,其他8种参考细菌及阴性对照均无扩增产物(图1),表明该引物组可用于无乳链球菌Sip基因的扩增,因此将引物FIP和BIP用作LAMP反应的引物。
2.2 LAMP检测的灵敏度
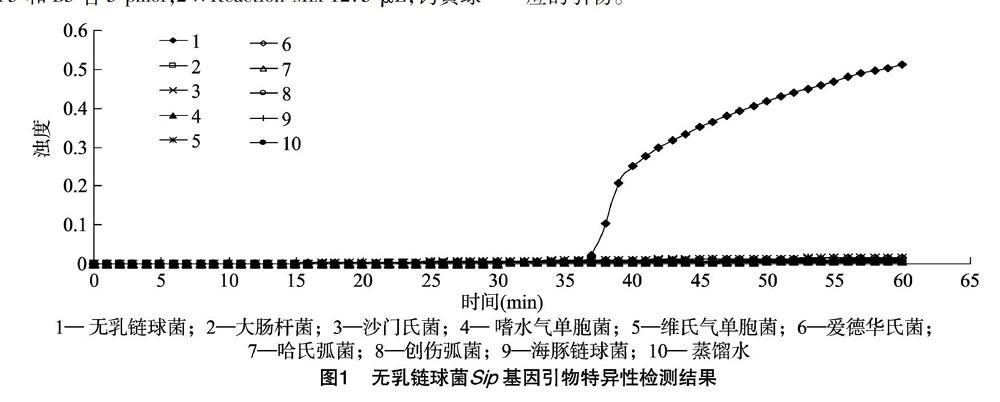
由图2可知,LAMP和PCR对罗非鱼GBS DNA的最低检测浓度分别为3.55×10-5ng/μL和3.55×10-3 ng/μL,即LAMP检测灵敏度为PCR的100倍。罗非鱼GBS DNA浓度在3.55×101~3.55×10-5 ng/μL间的7个浓度,LAMP反应孵育期分别为33、35、37、41、42、45、53 min(图2A),可检测GBS存在的最早时间点小于 40 min。通过直接目视检测法研究发现,LAMP检测GBS DNA的最低检测浓度也为3.55×10-5 ng/μL。
2.3 野外样本的检测和测序
采用LAMP和PCR检测技术,分别对收集的490个野外样本进行了GBS检测,结果发现,患病罗非鱼样品中,LAMP检测技术对GBS的检出率为81.3%,而PCR对GBS的检出率为60.72%,LAMP方法对GBS的检测比PCR更敏感。同时,健康罗非鱼样本中也检测到GBS,LAMP和PCR技术的检出率分别为4.4%和2.2%,其检测差异较小。利用LAMP和PCR检测技术分别对罗非鱼养殖池塘水样品进行检测,结果显示,池塘水的GBS检出率分别为10.0%、6.7%(表2)。对20个LAMP检测阳性样品进行了测序,经序列比对发现,样品序列与GBS Sip基因部分序列的相似性为100%。
3 讨论
目前,已建立了核糖体基因分型、随机扩增多态性DNA(RAPD)[17-18]和脉冲场凝胶电泳(PFGE)等多种GBS检测方法[19],然而仅通过表型检测GBS可能会有误导性。一些实验室将CAMP(Christie-Atkins-Munch-Peterson)作为检测GBS的一种方法,但CAMP需要连续2 d过夜培养,非常耗时。PCR或实时荧光定量PCR也被用于GBS检测[20-21],同时PCR方法需要昂贵的专业仪器设备和试剂消耗,不适用于野外检测,而且本研究建立的LAMP方法较PCR方法敏感性提高100倍,更适用于GBS的检测。尽管有关罗非鱼GBS的LAMP检测方法也有相关报道[22],但本研究针对鱼类和哺乳动物GBS中高度保守Sip基因序列开发LAMP检测方法,与前人建立的比色LAMP测定方法相比,更能进行实时LAMP测定,不需要打开反应管即可获得检测结果,降低了阳性产物污染实验室的风险。
本研究分别采用LAMP和PCR法检测了罗非鱼和池塘水中的GBS,发现LAMP检测灵敏度高于PCR,同样的样品,LAMP对罗非鱼GBS的检出率为81.3%,而PCR仅为 60.7%,提示LAMP法更适用于实地检测GBS,也意味着先前采用PCR检测罗非鱼GBS可能低估了GBS的传播范围或GBS引起的死亡率。另一方面,本研究中罗非鱼GBS的平均检出率为81.3%,低于Chen等报道GBS的平均检出率(97.7%)[2],这可能是由于2项研究所收集样品的时间段不同造成的。Chen等收集样品的时间段为2009—2011年[2],是我国罗非鱼链球菌发病的高峰期,而本研究样品收集时间为2014年,与其相比,罗非鱼链球菌病的发病率较低,故检出率较低,此外还可能是2项研究中样本量的差异导致的。
Li等研究发现,无典型临床症状或死亡的罗非鱼或为GBS的载体[23]。本研究的野外样品检测结果显示,应用LAMP和PCR在健康无症状的罗非鱼大脑样品检测到GBS,与Li等研究的结果[23]一致,表明罗非鱼可能为GBS病原体的无症状携带者。此外,采用LAMP和PCR分别从池塘水中检测到GBS,表明GBS可能在野生环境中正常生长,当罗非鱼的免疫反应较弱时才可能感染。虽然目前尚无罗非鱼源GBS菌株对人类感染性的研究报道,但应高度关注野生环境中GBS能在罗非鱼与人类之间传播,并采取一些切实可行的措施以防止该病发生。
参考文献:
[1]Klesius P,Evans J,Shoemaker C,et al. Rapid detection and identification of Streptococcus iniae using a monoclonal antibody-based indirect fluorescent antibody technique[J]. Aquaculture,2006,258(1/2/3/4):180-186.
[2]Chen M,Li L P,Wang R,et al. PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in China[J]. Veterinary Microbiology,2012,159(3/4):526-530.
[3]Mian G F,Godoy D T,Leal C G,et al. Aspects of the natural history and virulence of S.agalactiae infection in Nile tilapia[J]. Veterinary Microbiology,2009,136(1):180-183.
[4]Evans J J,Bohnsack J F,Klesius P H,et al. Phylogenetic relationships among Streptococcus agalactiae isolated from piscine,dolphin,bovine and human sources:a dolphin and piscine lineage associated with a fish epidemic in Kuwait is also associated with human neonatal infections in Japan[J]. Journal of Medical Microbiology,2008,57(11):1369-1376.
[5]Evans J J,Klesius P H,Pasnik D J. Human streptococcus agalactiae isolate in Nile tilapia (Oreochromis niloticus)[J]. Emerging Infectious Diseases,2009,15(5):774-776.
[6]Bowater R O,Forbes-Faulkner J,Anderson I G,et al. Natural outbreak of Streptococcus agalactiae(GBS)infection in wild giant Queensland grouper,Epinephelus lanceolatus(Bloch),and other wild fish in northern Queensland Australia[J]. Journal of Fish Diseases,2012,35(3):173-186.
[7]Jafar Q A,Sameer A Z,Salwa A M,et al. Molecular investigation of Streptococcus agalactiae isolates from environmental samples and fish specimens during a massive fish kill in Kuwait Bay[J]. African Journal of Microbiology Research,2009,3(1):22-26.
[8]Pereira U P,Mian G F,Oliveira I M,et al. Genotyping of Streptococcus agalactiae strains isolated from fish,human and cattle and their virulence potential in Nile tilapia[J]. Veterinary Microbiology,2010,140(1):186-192.
[9]Ye X,Li J,Lu M X,et al. Identification and molecular typing of Streptococcus agalactiae isolated from pond-cultured tilapia in China[J]. Fisheries Science,2011,77(4):623-632.
[10]Manning S D,Springman A C,Lehotzky E,et al. Multilocus sequence types associated with neonatal group B streptococcal sepsis and meningitis in Canada[J]. Journal of Clinical Microbiology,2009,47(4):1143-1148.
[11]Chaiwarith R,Jullaket W,Bunchoo M,et al. Streptococcus agalactiae in adults at Chiang Mai University Hospital:a retrospective study[J]. BMC Infectious Diseases,2011,11(1):149.
[12]Lambertsen L,Ekelund K,Skovsted I C,et al. Characterisation of invasive group B streptococci from adults in Denmark 1999 to 2004[J]. European Journal of Clinical Microbiology & Infectious Diseases,2010,29(9):1071-1077.
[13]Herbst K,Bujara M,Heroven A K,et al. Intrinsic thermal sensing controls proteolysis of yersinia virulence regulator RovA[J]. PLOS Pathogens,2009,5(5):e1000435.
[14]Delannoy C M,Crumlish M,Fontaine M C,et al. Human Streptococcus agalactiae strains in aquatic mammals and fish[J]. BMC Microbiology,2013,13(1):41.
[15]Nagamine K,Hase T,Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Molecular and Cellular Probes,2002,16(3):223-229.
[16]Tomita N,Mori Y,Kanda H,et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nature Protocols,2008,3(5):877-882.
[17]王健胜,侯桂玲,谢永凤. 国内外苜蓿品种遗传多样性RAPD分析[J]. 江苏农业科学,2017,45(13):35-38.
[18]李 红,李 超,张 敏. 金针菇菌株遗传多样性的RAPD分析[J]. 江苏农业科学,2018,46(1):19-22.
[19]Toranzo A E,Magarios B,Romalde J L. A review of the main bacterial fish diseases in mariculture systems[J]. Aquaculture,2005,246(1/4):37-61.
[20]Emaneini M,Mirsalehian A,Beigvierdi R,et al. High incidence of macrolide and tetracycline resistance among Streptococcus agalactiae strains isolated from clinical samples in Tehran[J]. Maedica,2014,9(2):157-161.
[21]Poncelet-Jasserand E,Forges F,Varlet M N,et al. Reduction of the use of antimicrobial drugs following the rapid detection of Streptococcus agalactiae in the vagina at delivery by real-time PCR assay[J]. BJOG,2013,120(9):1098-1109.
[22]鄭 磊,樊海平,吴 斌,等. 罗非鱼无乳链球菌LAMP快速检测方法的建立[J]. 福州大学学报(自然科学版),2015,43(4):572-576.
[23]Li Y W,Liu L,Huang P R,et al. Chronic streptococcosis in Nile tilapia,Oreochromis niloticus (L.),caused by Streptococcus agalactiae[J]. Journal of Fish Diseases,2014,37(8):757-763.

