电针对血管性痴呆大鼠行为学及脑内海马区MAPK通路的影响*
马 莉,封 宇,艾莉伟△
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
血管性痴呆(Vascular Dementia,VD)是与脑血管损伤相关的血管性认知障碍综合征中的痴呆亚型。血管性痴呆约占痴呆总患病率的30%,是老年人发生痴呆最常见的原因之一[1],其发病机理与治疗手段目前尚无明确指南[2]。VD的最常见病因是缺血性卒中,而神经元的凋亡是脑缺血引发脑组织损害的重要原因之一。研究表明,丝裂原活化蛋白激酶(MAPK)级联信号通路是介导细胞反应的重要信号系统,能够对多种细胞生长因子和促有丝分裂物质做出反应,把细胞外信号从细胞表面传导到细胞质内部,在细胞增殖、分化和凋亡过程中发挥重要作用[3]。MAPK家族中细胞外信号调节激酶(ERK)的突触可塑性在形态和功能上的修饰,可以影响到神经系统的生长发育、损伤修复以及学习记忆等多种脑功能[4]。p38丝裂原活化蛋白激酶(p38MAPK)通路的激活则主要介导炎症及应急反应中的细胞凋亡[5]。通过临床观察可发现,电针治疗可改善血管性痴呆患者的认知与学习记忆能力[6]。本研究以血管性痴呆大鼠为模型,观察了电针调节对MAPK通路中ERK1/2、p-ERK1/2、p38、p-p38及Bcl-2、Bax指标的影响,现报道如下。
1 实验材料与方法
1.1 实验材料
1.1.1 动物 纯系Wistar健康雄性大鼠60只,18~20月龄,体质量为(500±20)g,均由黑龙江中医药大学实验动物中心提供。
1.1.2 主要仪器与试剂 一次性无菌针灸针,直径0.25 mm×25 mm(贵州安迪药械有限公司);脑复康吡拉西坦片0.4 g(杭州民生药业集团有限公司);KWD-808Ⅰ脉冲电针仪(常州市武进长城医疗器械有限公司);大鼠程控穿梭箱DCS-2型(中国医学科学院药物研究所);兔抗Phospho-p44/p42 MAPK(Erk1/2)Antibody、兔抗p44/p42 MAPK(Erk1/2)Antibody、兔抗p38 MAPK Antibody、兔抗Phospho-p38 MAPK Antibody、兔抗GAPDH(美国CST公司);兔抗Bcl-2、Bax 、HRP-羊抗兔IgG二抗、BCA蛋白定量试剂盒、ECL化学发光试剂盒(武汉博士德生物工程有限公司)。
1.2 造模方法
60只大鼠适应性喂养3周后,随机分组法分为模型组、假手术组、电针组、西药组4组,每组各15只。采用分次结扎颈总动脉法造模,即改进的2-VO法[7]:术前12 h禁食水,小容器乙醚棉球罩头麻醉,保证术间自主呼吸,消毒,一侧颈总动脉上方处切开,钝性分离该侧颈总动脉及神经,以4号丝线双重结扎,缝合切口。7天后行另一侧结扎,与上法相同。放回笼中保温饲养,术后大鼠肌内注射青霉素20万单位,连续5天,以防感染。假手术组仅分离双侧颈总动脉后缝合。
1.3 治疗方法
待术后7天,伤口完全愈合后进行治疗。电针组按照于致顺老师头穴针法,分别于VD大鼠头部从额区神庭至囟会(参照《实验动物针灸穴位图谱》及《实验针灸学》)及其左右各1寸、2寸的平行线处丛刺,各5针,将左右最外侧两针连接电针仪,波形选用疏密波,频率2 Hz,大鼠耳部轻微颤抖为度,持续20 min,电针结束后留针30 min,每日1次。西药组术后7天,给予浓度为40 mg/mL的脑复康水溶液灌胃,每日1次。余两组分别给予等量生理盐水灌胃,每日1次。4组均于3天后停止治疗。
1.4 行为学测试
各组大鼠治疗前及治疗后均进行穿梭箱实验,测评4组大鼠的行为学变化。将大鼠先移入实验环境中适应性训练3 min,测试时间为5 min。实验开始后,当电源开启发出蜂鸣声后,穿梭箱底部左侧通电,遭受电刺激的大鼠被动逃避至穿梭箱右侧;再次警鸣后,穿梭箱底部右侧通电,大鼠被电刺激被动逃避至左侧。重复上述步骤,大鼠听到警鸣后主动逃避,即从一侧逃至另一侧。实验记录仪分别记录下大鼠遭受电击次数与电击时间等。
1.5 蛋白质免疫印迹(WB)试验
穿梭箱实验后,各组大鼠在规定时间内以10%水合氯醛(40 mg/kg)腹腔麻醉,开胸暴露心脏后用0.9%生理盐水和4%PBS缓冲液快速冲洗灌注。参照孙晓彩等的方法[5]分离取出双侧海马CA1区组织,碾碎裂解提取总蛋白,根据BCA蛋白定量试剂盒进行定量,凝胶电泳,转移至硝酸纤维素膜。将膜置于5%脱脂奶粉封闭,室温下孵育1 h,与一抗兔抗ERK1/2、p-ERK1/2、p38、p-p38、Bcl-2、Bax(1∶1 000)及内参GAPDH(1:1 000)4℃孵育过夜,后滴加羊抗兔二抗孵育60 min,TEST洗膜,ECL显色曝光,将所得底片扫描存档,并用Image-Pro Plus进行蛋白灰度分析。
1.6 统计学方法
采用统计学软件SPSS 22.0进行数据分析,多组间样本均数的比较用One-Way ANOVA检验,各组间两两比较采用t检验,P<0.05为有统计学意义。
2 结果
2.1 各组行为学检测比较
表1结果显示:治疗前,与模型组相比假手术组电击次数与电击时间显著降低(P<0.05),说明造模成功。治疗后,与模型组相比电针组、西药组均能够降低电击次数与电击时间(P<0.05),提示两种治疗手段对VD大鼠病情均有改善;西药组与电针组相比差异无统计学意义(P>0.05)。
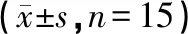
表1 各组大鼠行为学结果比较
注:与模型组对比,*P<0.05;与电针组对比,▼P>0.05。
2.2 各组凋亡通路蛋白Bcl-2、Bax表达比较
图1、表2结果显示:假手术组中与模型组比较大鼠海马CA1区Bcl-2与Bax均有一定量蛋白表达。假手术组与模型组相对比,Bcl-2蛋白表达差异无统计学意义(P>0.05),假手术组中Bax蛋白表达显著下调(P<0.05)。电针组、西药组与模型组相对比,电针组与西药组中的Bcl-2蛋白表达显著上调(P<0.05),Bax蛋白表达显著下调(P<0.05);电针组与西药组两之间比较Bcl-2与Bax蛋白表达差异无统计学意义(P>0.05)。
图1 各组大鼠海马CA1区Bcl-2和Bax的蛋白表达
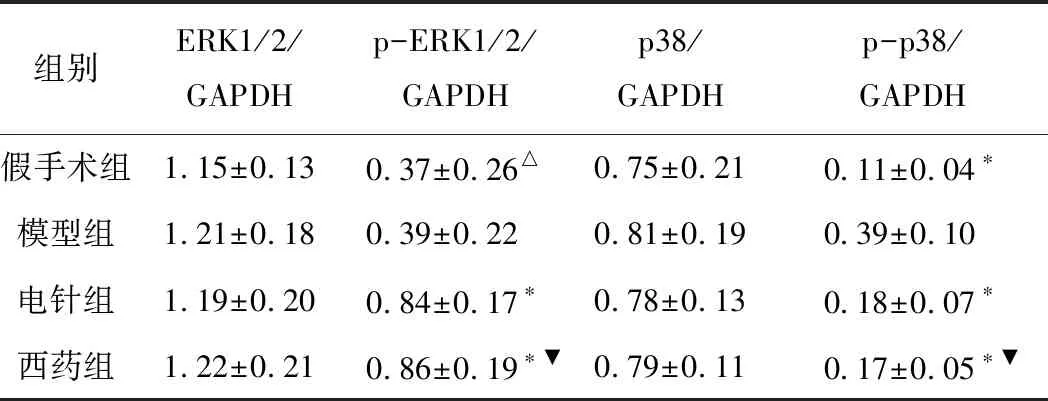
2.3 各组MAPK/ERK通路蛋白ERK1/2、p-ERK1/2、p38、p-p38表达比较
图2、表3结果显示,VD模型组大鼠海马CA1区ERK1/2与p38的蛋白总表达无明显变化。假手术组与模型组比较p-ERK1/2蛋白表达差异无统计学意义(P>0.05),假手术组中p-p38蛋白表达水平显著降低(P<0.05)。电针组、西药组与模型组比较:电针组、西药组的p-ERK1/2蛋白表达水平显著升高(P<0.05),p-p38蛋白表达水平显著降低(P<0.05);西药组与电针组比较,西药组的p-ERK1/2、p-p38蛋白表达差异无统计学意义(P>0.05)。
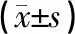
表2 各组大鼠海马CA1区Bcl-2和Bax蛋白表达比较
注:与模型组对比,*P<0.05,△P>0.05;与电针组对比,▼P>0.05。
图2 各组大鼠海马CA1区ERK1/2、p-ERK1/2、p38、p-p38的蛋白表达
组别ERK1/2/GAPDHp-ERK1/2/GAPDHp38/GAPDHp-p38/GAPDH假手术组1.15±0.130.37±0.26△0.75±0.210.11±0.04∗模型组1.21±0.180.39±0.220.81±0.190.39±0.10电针组1.19±0.200.84±0.17∗0.78±0.130.18±0.07∗西药组1.22±0.210.86±0.19∗▼0.79±0.110.17±0.05∗▼
注:与模型组对比,*P<0.05,△P>0.05;与电针组对比,▼P>0.05。
3 讨论
血管性痴呆(VD)在中医学属于“痴呆”“呆病”“中风”范畴,病位在脑。《灵枢·海论》即有记载:“脑为髓之海,其输上在于其盖,下在风府。”又“……髓海不足,则脑转耳鸣,胫酸眩冒,目无所见,懈怠安卧。”我院于致顺老师通过选取头部体表及其周围腧穴或功能区治疗脑源性疾病[8]。近年来电针治疗因其疗效明显,方法简便,于临床应用广泛。评估啮齿类动物学习记忆能力,常用可定量描述实验大鼠主动回避反应等特征的行为学测量工具穿梭箱来进行[9]。本实验中采取电针治疗VD大鼠额区,通过穿梭箱实验检测,证实了电针对于大鼠认知学习能力的提升。
神经细胞凋亡及炎症反应被认为是造成血管性痴呆的认知障碍的重要因素,如何通过治疗手段来调节细胞的动态凋亡过程,以增加细胞存活率是当前重要研究方向。研究发现针刺可通过调节一氧化氮(NO)含量及其他诱发细胞凋亡因素起到疗效[10]。Zuowei L等发现早期进行针刺干预与Bcl-2和Bax基因表达有关,这两个基因表达的变化与其阳性细胞数的变化一致,而表达率的变化与Bcl-2阳性细胞数量变化正相关,而Bax基因表达的变化则与之相反[11]。丝裂原活化蛋白激酶(MAPKs)是一系列相关的丝氨酸/苏氨酸激酶和信号转导介质,调节各种细胞功能。MAPK由4个亚家族组成:细胞外信号调节激酶(ERK1/2,也称为p44/p42);jun-NH2-末端激酶1/2(JNK1/2,也称为应激激活蛋白激酶或p54/p46);p38 MAPK和ERK5[12],这些信号通路参与介导脑缺血损伤中神经细胞周期控制、细胞凋亡和细胞凋亡分化[13]。研究证明ERK1/2被激活磷酸化后在下游发挥作用,通过调节抗凋亡或促凋亡途径Bcl-xL、Bax和AIF的表达,来抑制神经细胞凋亡和梗塞体积[14]。杨忠华等的研究表明,p-ERK1/2的高表达可能只限于缺血缺氧的早期[15]。而p-p38长期活化参与神经细胞凋亡[16],p-p38抑制剂促进体外多种神经元的存活[17]。p38的激活会阻碍ERK1/2的保护性通路,从而导致凋亡[18]。细胞凋亡是生物发育过程中的必经之路,同时存在于生理和病理过程中。可见,ERK1/2与p38MAPK之间通过动态平衡来调节细胞的凋亡[19],若此动态平衡失衡则可能加速细胞凋亡。p-ERK 1/2和p-p38的动态调节在血管性痴呆疾病的发生发展中起重要作用。实验结果显示,治疗后血管性痴呆模型组大鼠的行为学检测中电击次数和电击时间明显多于治疗前模型组,表明治疗有效;而经过额区电针治疗的电针组VD大鼠行为检测结果明显优于模型组,免疫印迹试验中因GAPDH在组织中表达恒定,故被广泛用作细胞蛋白质标准化内参,通过将目的蛋白含量与样本GAPDH含量相除来矫正误差。其结果显示经电针治疗后Bax蛋白表达率比模型组明显降低,Bcl-2蛋白表达率明显升高,证明电针治疗有对神经细胞的凋亡有抑制作用。WB实验中,ERK1/2、p38蛋白表达量在假手术组、模型组、电针组及西药组4组的表达大致相同,而电针组与模型组相比p-ERK1/2升高而p-p-38 MAPK降低,证明了通过调控磷酸化的ERK1/2、p38的表达,电针和西药均对VD大鼠的治疗效果显著。研究表明,针灸影响VD病理过程的多个方面,其通过保护大脑神经元免受氧化应激、细胞凋亡和神经炎症,调节葡萄糖代谢和神经递质来改善认知功能。针灸还可以改善突触可塑性和血管功能[20]。并由此推测,电针治疗可调控MAPK通路使其磷酸化,通过升高p-ERK1/2蛋白表达水平和降低p-p38MAPK蛋白的表达水平,抑制大鼠海马区CA1神经细胞的凋亡,促进了神经元功能的恢复。而电针组和西药组的治疗效果无明显差别,但电针由于其无副作用、操作简便,故综合评比优于西药组。
综上所述,额区电针治疗对血管性痴呆具有脑保护作用,其机制可能上调表达p-ERK1/2蛋白,下调表达p-p38MAPK蛋白有关,动态调节了两条信号通路,从而通过降低神经元的坏死来发挥脑保护功能。而ERK、p38的动态平衡是维持及调节细胞存活的重要条件。该实验结果为临床应用电针治疗血管性痴呆提供了理论依据,也为该病的研究与治疗提供了新的思路。

