内镜下全层切除术治疗胃间质瘤术后并发膈下脓肿1例报道
佘美佳,宋 莹,姜东强,田月丽,刘佰纯
吉林大学第二医院胃肠内科及消化内镜中心,吉林 长春 130041
胃间质瘤(gastric stromal tumor,GST)是一种未定的多潜能的间叶组织来源的黏膜下肿瘤,具有低度恶性潜能[1]。GST早期症状隐匿,缺乏特异性临床表现,早期发现和诊断较困难[2]。随着内镜技术的发展,内镜下微创治疗[内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)和内镜下全层切除术(endoscopic full-thickness resection,EFR)]已经广泛应用于GST的诊断和治疗[3]。EFR治疗成功的关键是内镜下成功修补术中发生的治疗性穿孔[4]。本例患者瘤体直径2.5 cm,采用EFR治疗,术后患者恢复良好,术后3个月并发膈下脓肿,现特将此病例作相关报道。
病例患者,男,48岁,因“上腹部隐痛4余年,加重20 d”入院。患者4年前始无明显诱因出现上腹部隐痛,疼痛与进食无关,腹痛为持续性,程度中等,偶有背部放散。无腹胀、恶心、呕吐、呃逆、反酸、黑便。2016年8月于当地医院行胃镜检查提示:慢性非萎缩性胃炎伴糜烂,胃底见一球状黏膜下隆起,大小约2.5 cm×3.5 cm(见图1)。2016年8月于我院行超声胃镜检查见:该隆起部位胃壁超声结构第4层见一低回声占位,回声不均,局部可见高回声区,内见无回声,未探及明显血流信号,边界尚清,纵轴切面大小约23.3 mm×19.8 mm。提示符合胃底固有肌层占位超声(2.5 cm×2.5 cm,胃肠道间质瘤?)(见图2)。患者于2016年8月17日收治入院,入院后体格检查仅有上腹部轻度压痛,无反跳痛及肌紧张,余查体未发现异常,血常规、血生化及肿瘤标志物未见异常。胃部平扫+增强CT扫描提示:胃底部可见结节状软组织密度影,大小约21 mm×23 mm,CT值约为37 HU,增强扫描动脉期呈轻度强化,静脉期病灶进一步强化(见图3)。
患者于2016年8月20日行胃占位EFR。患者取左侧卧位,全麻插管生效后,循腔进境至胃底见一大小约2.5 cm隆起性病变,表面可见凹陷,于基底黏膜下注射加美蓝、肾上腺素的生理盐水约3 ml,用切开刀沿标记点切开,逐渐剥离,术中出血,用止血钳电凝止血,至病变完全剥离,全层切除,瘘口直径约2.0 cm(见图4),用止血钳处理创面裸露的血管及周边,并用尼龙绳及12枚钛夹荷包缝合创面(见图5~6)。用圈套器圈套切除组织携带出体外,示家属后送病理,待患者清醒后安返病房。给予禁食水、胃肠减压、抑酸、抗感染、止血、营养等对症治疗。瘤体病理活检:(胃底)胃肠道间质瘤,低危险组,梭形细胞型,分裂象约1/50 HPF,直径约2.2 cm,无坏死(见图7)。免疫组化染色结果:CD117(+)、H-Caldesmon(+)、SMA(-)、DOG-1(+)、CD34(+)、Desmin(-)、Ki67(阳性率1%)、NSE(-)、S-100(-)(见图8~10)。术后患者病情平稳,未出现黑便、腹痛等表现,于2016年8月29日出院。3个月后该患者因“腹部疼痛3 d,加重1 d”于2016年11月21日来我院急诊,疼痛性质为间断性锐痛,行立位腹平片示:右侧膈下见新月状气体密度影,腹腔肠管积气,可见液气平面,急诊以“消化道穿孔、肠梗阻”收入结直肠肛门外科。体格检查全腹硬,全腹肌紧张,腹部有压痛、反跳痛。叩诊鼓音,移动性浊音阴性,肠鸣音弱,约2次/min,急诊在全麻下行“腹腔镜探查术”,术中大量脓性分泌物位于胃表面。无法探查清楚穿孔位置。术中与家属沟通后,中转开腹。取右上腹经腹直肌切口,长约15 cm,进入腹腔内大量温盐水进行冲洗。冲洗后未见明确穿孔处。术中请内镜科会诊,行电子胃镜检查,胃镜充气后找到穿孔处,穿孔较小且被脓性分泌物包裹。将脓性分泌物清洗后,缝合穿孔处,大量温盐水冲洗腹腔3次,置引流管,逐层关腹,术终。术后给予抗感染、抑酸、补液、祛痰等对症支持治疗。患者术后恢复良好,无腹痛、黑便,无发热。于2016年12月5日出院。电话随访该患者,未再出现黑便、腹痛等表现。
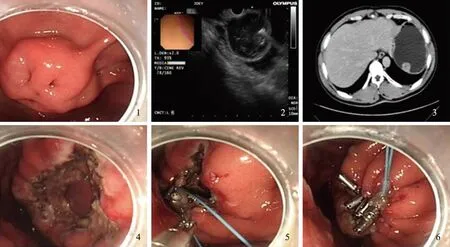
图1 胃镜检查胃底见一大小约2.5 cm×3.5 cm球状黏膜下隆起,表面可见凹陷;图2 术前超声胃镜检查见该隆起部位胃壁超声结构第4层见一低回声占位,回声不均。提示符合胃底固有肌层占位超声;图3 术前胃部增强CT见胃底部可见结节状软组织密度影,大小约21 mm×23 mm;图4 术中剥离瘤体后的瘘口,瘘口直径约2.0 cm;图5~6 用尼龙绳及12枚钛夹荷包缝合创面Fig 1 Gastroscopy revealed a spherical submucosal eminence of about 2.5 cm×3.5 cm in size and a depression on the surface; Fig 2 Preoperative ultrasonographic gastroscopy revealed a hypoechoic mass on the 4th layer of the gastric wall in the protrusion site, with uneven echoes. It was suggested that the ultrasonography conformed to the space-occupying ultrasonography of the proprial muscular layer of the fundus of stomach; Fig 3 Preoperative enhanced CT scan of the stomach showed nodular soft tissue density inthe bottom of the stomach, which was about 21 mm×23 mm in size; Fig 4 The diameter of the fistula was about 2.0 cm;Fig 5-6 The wound was sutured with nylon rope and 12 titanium wallets
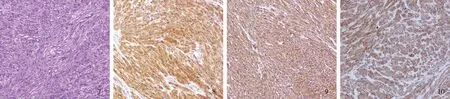
图7 瘤体病理活检:(胃底)胃肠道间质瘤,低危险组,梭形细胞型,分裂象约1/50 HPF(放大100倍);图8 瘤体免疫组化:CD117(放大100倍);图9 瘤体免疫组化:CD34(放大100倍);图10 瘤体免疫组化:DOG-1(放大100倍)
Fig 7 Tumor pathological biopsy: (fundus of stomach) gastrointestinal stromal tumor, low risk group, spindle cell type, mitoticfigure about 1/50 HPF; Fig 8 Immunohistochemical: CD117; Fig 9 Immunohistochemical CD34;Fig 10 Immunohistochemical: DOG-1
讨论GST是最常见的消化道间叶组织源性肿瘤,起源于胃壁黏膜肌层或固有肌层,是具有潜在恶性倾向的侵袭性肿瘤,约占胃肿瘤的2%[5]。临床建议早期发现、早期切除[6]。以往胃固有肌层间质瘤因临近浆膜层,内镜切除容易穿孔,传统认为是消化内镜的手术禁忌证,多主张外科腹腔镜或经腹手术切除治疗,或定期复查[1]。近年来随着消化内镜技术的发展,EFR、ESD等技术已成为治疗消化道早癌的有效手段[7]。EFR是在ESD的基础上对起源于固有肌层突向浆膜下生长,与浆膜层紧密粘连的胃黏膜下间质瘤在内镜下通过切除消化道壁全层的方式切除肿瘤,再对缺损行内镜下缝合的手术方式[8]。EFR扩大了ESD的治疗深度,其治疗方式的特点为变被动穿孔为主动穿孔[9],所以创面修补缝合是EFR技术成功的关键[1]。其主要并发症有出血、穿孔、感染等[10]。尼龙绳联合钛夹荷包缝合术越来越多地被应用到穿孔的修复中[11]。故提高荷包缝合技术也可适当避免术后并发症的发生。其他缝合技术还有:单钳道镜联合应用钛夹缝合、尼龙套圈行双荷包缝合等。本例间质瘤采用EFR治疗,术后3个月发生迟发性穿孔并发膈下脓肿,考虑本次迟发性穿孔可能与术中过度抗凝、金属夹过早脱落、患者过早活动、抗生素剂量不足、瘤体的部位等有关。
该患者术前超声内镜诊断提示胃肠道间质瘤,术后病理回报为(胃底)胃肠道间质瘤,术前、术后诊断一致。EUS具有内镜与超声的双重功能,内镜顶端装有高频超声探头,在进行疾病诊断时,体腔插入内镜后利用内镜来观察扫查部位的病变[12]。与此同时,探头能够全方位实时扫描胃腔及毗邻的脏器,以此获得胃肠道内病灶浸润深度、病变源头部位和毗邻脏器的超声图像信息,为制定手术方案提供参考[13]。国外报道胃黏膜下肿瘤术后病理结果与术前EUS诊断率符合90.38%[14]。EUS的应用在本病例的诊断中起到了重要作用。
虽然此例患者于EFR术后3个月发生迟发性穿孔,但不可否认的是,EFR有创伤小、恢复快、住院时间短、术后不遗留体表瘢痕、并发症较少等优点,只需在穿孔修补方面更加完善,内镜科医师与外科医师更加密切地配合,EFR可被更好地应用推广。

