MoFlo XDP超速流式细胞分选仪的使用和管理
向承林

摘 要:简述MoFlo XDP超流式细胞分选仪的工作原理、使用调试和日常维护,介绍MoFlo XDP超速流式细胞分选仪的使用和管理。
关键词:MoFlo XDP;超速流式细胞分选仪;使用和管理
中图分类号:R197.39 文献标志码:A 文章编号:2095-2945(2019)26-0190-03
Abstract: This paper briefly describes the working principle, debugging and daily maintenance of the MoFlo XDP ultra speed flow cytometry sorter, and introduces the use and management of the MoFlo XDP ultra speed flow cytometry sorter.
Keywords: MoFlo XDP; ultra speed flow cytometry sorter; use and management
流式细胞分选仪是电子技术、激光技术、计算机技术、荧光化学技术及流体理论为一体的细胞分选技术,可以从细胞群体中分选出高纯度的目标细胞进行细胞培养、细胞蛋白检测、细胞基因测序等应用。MoFlo XDP超速流式分选仪是美国Beckman Coulter的第三代流式细胞分选仪,可根据细胞胞内蛋白、DNA、RNA及细胞表面标志物的不同,以每秒10万个细胞的速度检测包含FSC、SSC在内的17参数对细胞进行快速准确的分析和分选,同时可最多对四种细胞进行分选,广泛应用于细胞生物学、免疫学、细胞生物学、发育生物学、细胞动力学、生理学、分子生物学等学科的研究。
1 工作原理
MoFlo XDP是一款在空气中激发和分选的流式细胞分选仪,当单个悬浮颗粒通过喷嘴后在空气中被激光束照射并对激光进行散射,同时所带的荧光化合物发被激发并发射出荧光,检测器同时对散射光和荧光进行分析并对包裹细胞的液流进行充电,通过震荡液流使目标细胞包含在带电的液滴中,在通过高压静电偏转板时收集到指定容器中,实现对细胞的分析和分选。
2 仪器调试
2.1 激光
MoFlo XDP采用了固态激光,激光开启后应预热5分钟使激光稳定工作,当使用355nm的高功率激光时,应当预热30分钟,否则可能因高功率的紫外激光对仪器光学部件造成损坏。
2.2 液流调整
打开液流系统,点击触屏面板上的“Debubble”进行排气泡,当能观察到稳定的液流即可停止。调整喷嘴的上下、左右、前后千分尺和平衡台上的2个旋钮,使液流垂直对齐。
2.3 光路校正
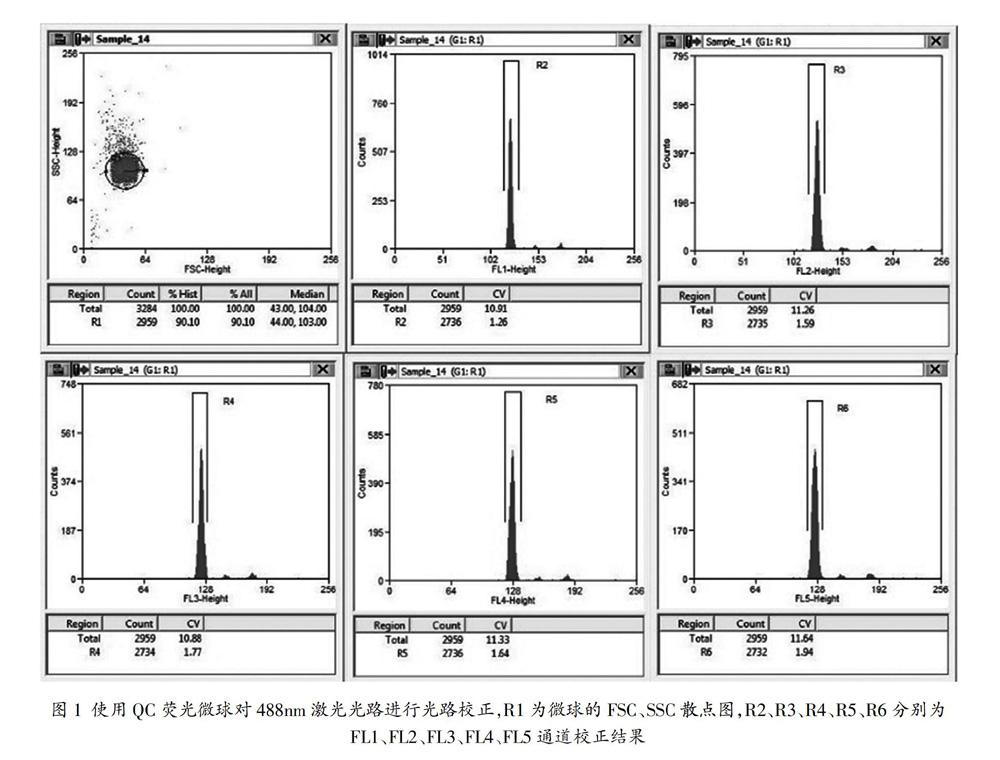
将MoFlo XDP的质控(QC)荧光微球用无菌的超纯水按1:20进行稀释,上样微球,调整样品压力差使EPS为100,打开QC面板,调整激光的上下、左右、前后的千分尺和电压,使面板上各通道的信号形成最亮、最集中的一群,且CV值在2.5以下即可(如图1)。
2.4 液滴调整
打开液流震荡开关,选择喷嘴直径,寻找激光位置,调整振荡频率(Frequency)、整幅(Amplitude)。选择到分选调整面板,打开静电偏转板电源并加电压到3000Volts,调整Charge Phase到分选液流偏转最差的角度,然后调整到以该数值加减180°的角度,得到稳定的四路预分选液流。MoFlo XDP使用了IntellisortⅡ智能化分选模块,使用70μm和100μm喷嘴时可通过计算机计算液滴延迟时间(Drop Delay)并自动微调振幅以维持液滴断点(如图2)。
2.5 分选设置
上样并通过在软件Summit V5.4.0上对细胞散射和荧光进行分析、设门,设定分选设置,选择分选位置,可最多同时对L1、L2、R1、R2四个位置分选四种特定的细胞,并适配0.5mL、1.5mL、2mL、5mL、15mL、50mL离心管及标准流式管作为上样和分选容器。同时MoFlo XDP还可通过“CyClone”分选设置,使用玻片和不同规格的孔板进行单种细胞分选。
2.6 关机
分选完成后,调整压力差至5.0PSI,分别先后上样2mL5%次氯酸钠、75%乙醇、无菌超纯水进行管路清洗,关闭系统和激光,排除鞘液桶气压。
3 日常维护与管理
(1)设备预约:流式细胞分选仪应至少提前24小时预约使用,预约前应提前告知样品来源、抗体荧光染料信息和样品信息。
(2)环境质控:MoFlo XDP应置放于密闭的洁净房间内,室温控制在18-22℃,湿度控制在20%-65%,同时配备紫外灭菌设备,实验前后使用紫外照射灭菌15min。
(3)鞘液管路清洗:MoFlo XDP的鞘液管路系统采用
了全封闭系统,需要定期对鞘液管路进行灭菌维护。鞘液应使用无菌处理的PBS或生理盐水,鞘液需要定期更换;每月使用75%乙醇做为鞘液,进行管路灭菌,每次进行2小时,再使用无菌PBS或生理盐水冲洗管路2小时,清洗残留乙醇;半年更换一次滤芯,拆下滤芯后可使用5%次氯酸钠进行一次管路清洗,再使用75%乙醇沖洗,安装新的滤芯,用无菌PBS或生理盐水进行冲洗,滤芯不可接触次氯酸钠溶液。
(4)喷嘴清洗:喷嘴应每周或出现液滴状态不稳定时进行拆卸和清洗,清洗时取下喷嘴,嘴尖朝上放入盛有2mL无菌超纯水的流式管里,进行超声清洗15min,清洗2次;将5mL注射器拔出针头,吸入无菌超纯水,对准喷嘴尾部并压紧,推动注射器可看到喷嘴有稳定的液流喷出,再将注射器对准喷嘴尖部,缓慢推动,液体沿喷嘴内壁缓慢流出即说明喷嘴无堵塞,重复2次。
(5)进样针清洗:MoFlo XDP提供了进样针外壁灭菌
系统,点击触屏上的“Clean”按钮,使用消毒液桶内预装的消毒鞘夜对进样针外壁灭菌;再点击“Rinse”按钮,使用鞘液对进样针润洗。
(6)上样管路清洗:开机调试前,应先上样75%乙醇对上样管路灭菌5min,再使用无菌超纯水上样5min。
(7)进行分选时,应使用无水乙醇对分选仓使用无水乙醇进行擦拭灭菌,保证分选仓的无菌状态,避免分选时样品污染。
(8)分选过程中发现有样品堵塞情况,应立即停止分选,点击触屏上的“Backflush”按钮对上样管路进行回冲2次,并上样无菌超纯水冲洗5min。
(9)每次完成实验后,需要更换鞘液并加至鞘液桶上限刻度线,如使用自配的PBS或其他鞘液需要进行高压灭菌;更换鞘液同时需要清倒废液桶的废液,并冲洗,防止下次实验因废液桶溢出而损坏空气泵。
(10)MoFl XDP的光路系统在厂家工程师的指导下可以根据实验需求进行光路调整和更改,严禁非管理人员擅自对电子系统、光路系统进行更改。
(11)样品要求:对于需要进行分选的样品,应当进行无菌处理,防止污染的样品对系统管理造成污染;上样前应使用300目(50μm)的无菌滤网过滤,防止对上样管路造成堵塞;拒绝接受有感染性病毒、微生物样品进行上样分选。
4 结束语
MoFlo XDP超速流式细胞分选仪拥有高速度、高纯度、高回收率和高准确性的特点,但是对运行环境要求较高,且设备零配件价格昂贵,到货周期长,所以正确、规范的调试方法和日常管理方法,可以保证MoFlo XDP的稳定运行,准确有效地分选,节约设备的维护成本。
参考文献:
[1]杜立颖.MoFlo XDP高速流式细胞仪[J].现代仪器,2004(2):45-47.
[2]张小翠,符蓉,赵犇鹏.流式细胞仪MoFlo Astrios EQ 96孔板单细胞分选方法的条件优化[J].上海交通大学学报,2018,38(7):845-890.
[3]石亚萍,种银保,王晴.高端流式细胞分选有的选型和评价[J].医疗卫生装备,2010,31(10):122-124.
[4]李超,韩金路,王玉刚,等.流式细胞仪的工作原理及应用[J].中国国实用医药,2009,4(20):235-236.
[5]黄莹莹.流式细胞分选术的应用进展[J].科技视界,2013(03):173-174.
[6]杨蕊,陈捷光.流式细胞计无菌分选功能的开发[J].生物化学与生物物理进展,1990,17(6):483-484.
[7]王淑静,郝建民,毕建杰,等.流式细胞仪的使用与维护[J].中国现代教育装备,2011(11):55-56.
[8]方青,曾晓军,徐鹰.流式细胞仪的原理和临床应用[J].中国医疗前沿:学术版,2008,3(10):84-85,91.
[9]张琰,温洁,张朝霞.流式细胞仪在医学中的应用[J].新疆医科大学学报2005,28(1):92-93.
[10]梁昊岳,杨晚竹,程雪莲,等.BD Influx流式细胞分选仪参数调试和最佳条件的设定[J].中国医学装备,2014,11(2):5-8.
[11]鲁敏,李家璜,华子春.流式细胞仪(BD FACSCalibur)的管理和維护[J].北方药学,2013,10(10):147.
[12]王金福,邱丽燕,Jenny Harrintong,等.体外扩增小鼠造血干细胞/祖细胞及重建造血功能的研究[J].中华血液学杂志,2003,24(11):584-587.

