艾塞那肽对早期糖尿病肾病患者肾脏的保护作用
周丽君,卢国元,沈艳萍
(苏州大学附属第一医院肾内科,江苏苏州 215006)
糖尿病肾病(diabetic kidney disease, DKD)系由慢性高血糖所致代谢紊乱、血流动力学改变引起的肾小球硬化症,是糖尿病患者最常见的慢性微血管并发症之一。DKD发病率随糖尿病发病率升高呈逐年上升趋势,糖尿病发病10年后有40%~50%的患者并发DKD,是导致终末期肾功能衰竭及患者死亡的重要因素之一[1-2]。DKD表现为肾小球系膜和肾小管间质细胞外基质集聚,导致肾小球基底膜增厚、系膜增生、肾小管-间质纤维化,并最终发展为不可逆转的肾脏纤维化。其主要发病机制包括糖脂代谢紊乱、氧化应激反应、炎症信号通路激活、血流动力学改变、蛋白质非酶糖化、多元醇通路激活以及肾素-血管紧张素Ⅱ-醛固酮系统(RAS系统)激活等共同作用有关,有多种不同的细胞及细胞因子参与,然而其具体分子作用机制仍未阐明。目前缺乏有效的手段治疗DKD,临床上主要以控制血压、血糖,减少蛋白摄入等常规对症方案控制病情进展,但对已经发生的蛋白尿等的改善作用有限。胰高血糖素肽-1(GLP-1)是近年来糖尿病治疗研究的热点之一,艾塞那肽是首个被批准用于临床的 GLP-1受体激动剂,呈葡萄糖依赖的方式降低血糖,单药使用极少发生低血糖,可以降低2型糖尿病(T2DM)患者的体质量,改善脂代谢和胰岛功能[3]。GLP-1除了降糖作用外,还具有抗氧化应激、抑制细胞凋亡等一药多效的特点[4],并且国外研究显示其对糖尿病肾脏具有一定的保护作用[5]。本研究观察艾塞那肽对DKD患者肾脏的保护作用及其作用机制。
1 资料与方法
1.1 研究对象选取2015年1月至2018年8月苏州大学附属第一医院收治的80例DKD患者。纳入标准:年龄≥18周岁;符合2型糖尿病诊断标准[6];符合DKD诊断标准[7];签署知情同意书。排除标准:年龄<18周岁;对研究药物过敏者;已进行透析治疗者;存在严重心血管、消化系统、呼吸系统、神经系统、内分泌系统等疾病者;有重大手术、严重创伤等的患者;妊娠或哺乳期女性患者;合并糖尿病酮症酸中毒、急慢性感染、恶性肿瘤等的患者;依存性差、无法规律用药的患者;研究者认为其他不适宜参加本研究的患者。本研究得到医院伦理委员会批准,并且所有患者均知情同意。将所纳入的80例患者按随机数字表随机分为观察组和对照组,每组各40例。对两组患者年龄、性别、体质量指数和糖尿病病程等临床资料比较分析。
1.2 治疗方法与观察指标所有受试者均进行饮食控制和适量运动锻炼,并进行控制血压、血脂等一般治疗。对照组患者口服奥美沙坦(20 mg/次,1次/d)和二甲双胍(0.5 g/次,2次/d)。观察组在对照组相同治疗的基础上,皮下注射艾塞那肽:起始剂量为5 μg/次,2次/d,持续4周,随后10 μg/次,2次/d,如出现低血糖,则将艾塞那肽减量至5 μg,2次/d。两组患者的疗程均为24周。治疗前及治疗24周分别采集空腹外周静脉血和24 h尿液,比较两组患者治疗前后血糖指标、血脂指标、血压、肾功能指标、血清晚期糖基化终末产物(advanced glycation end products, AGEs)和环磷酸腺苷(cyclic adenosine monophosphate, cAMP)、血清氧化应激指标和外周血单个核细胞中cAMP/PKA信号通路相关蛋白水平。
1.3 血糖指标的测定清晨抽取患者空腹外周静脉血于普通采血管,室温下静置至血液完全凝固,离心,分离得血清。采用葡萄糖氧化酶法测定空腹血糖(fasting blood glucose, FBG)水平,采用高效液相色谱法测定糖化血红蛋白(hemoglobin A1c, HbA1c)水平。采用动态血糖监测系统(continuous glucose monitoring system, CGMS)对所有患者进行动态血糖监测,检测24 h平均血糖(mean blood glucose, MBG)、24 h血糖标准差(standard deviation of blood glucose, SDBG)、24 h血糖波动范围(blood glucose fluctuation range, BGFR)及平均血糖波动幅度(mean amplitude of glycemic excursions, MAGE)。
1.4 血脂指标的测定将分离的血清采用日本岛津公司CL-7200全自动生化分析仪直接测定血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白-胆固醇(low-density lipoprotein-cholesterol, LDL-C)和高密度脂蛋白-胆固醇(high-density lipoprotein-cholesterol, HDL-C)。
1.5 肾功能指标的测定血清肌酐(serum creatinine, Scr)和尿肌酐(urine creatine, UCr)水平采用肌酐亚胺水解酶法测定,尿微量白蛋白(urine microalbumin, Umalb)采用放射免疫法测定,并计算肾小球滤过率(estimated glomerular filtration rate, eGFR)和尿白蛋白/肌酐比值(albumin/creatinine ratio, ACR)。eGFR=175×(Scr)-1.234×年龄-0.179(女性×0.79)。
1.6 血清AGEs、cAMP及MDA、SOD和CAT的测定血清丙二醛(malonaldehyde, MDA)采用硫代巴比妥酸比色法测定,超氧化物歧化酶(superoxide dismutase, SOD)采用WST-1法测定,血清过氧化氢酶(catalase, CAT)、cAMP和AGEs采用酶联免疫吸附法测定。各步骤操作严格按照说明书进行。
1.7 Western blot检测外周单个核细胞中PKA、CREB、p-CREB蛋白的表达将抗凝血样与等量磷酸缓冲液(phosphatic buffer solution, PBS)混合后,小心缓慢叠加于淋巴分离液上层,水平离心(2 000 r/min×30 min)。小心取出离心管,用吸管轻轻吸出中间的白膜层,置于另一离心管中,加入5倍体积的PBS清洗2次,离心即得到单个核细胞。取各组单个核细胞加入预冷的RIPA裂解液(含10 g/L PMSF),充分裂解,离心提取蛋白并以BCA法测定浓度。Western blot测定蛋白激酶 A(protein kinase A, PKA)、环磷腺苷效应元件结合蛋白(CREB)和磷酸化环磷腺苷效应元件结合蛋白(p-CREB)水平。制备100 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE),蛋白样品煮沸变性后进行电泳,电转至PVDF膜,脱脂奶粉室温封闭2 h,加入一抗,4 ℃过夜,洗膜,加入二抗,室温孵育1 h,洗膜,应用ECL Prime蛋白印迹试剂进行化学发光显色,X片曝光显影。采用Fluor Chem Q多功能系统对图像进行分析。以PKA、CREB和p-CREB吸光值与GAPDH比值代表相对表达含量。
1.8 统计学分析数据分析采用SPSS 22.0软件。计量资料符合正态分布,组内前后比较采用配对t检验,组间比较采用独立样本t检验,不符合正态分布采用非参数检验;计数资料采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者一般临床资料的比较两组患者年龄、性别、体质量指数和糖尿病病程等临床资料差异均无统计学意义(P>0.05,表1)。
表1 两组患者临床资料的比较
Tab.1 Clinical data in both groups (n=40)
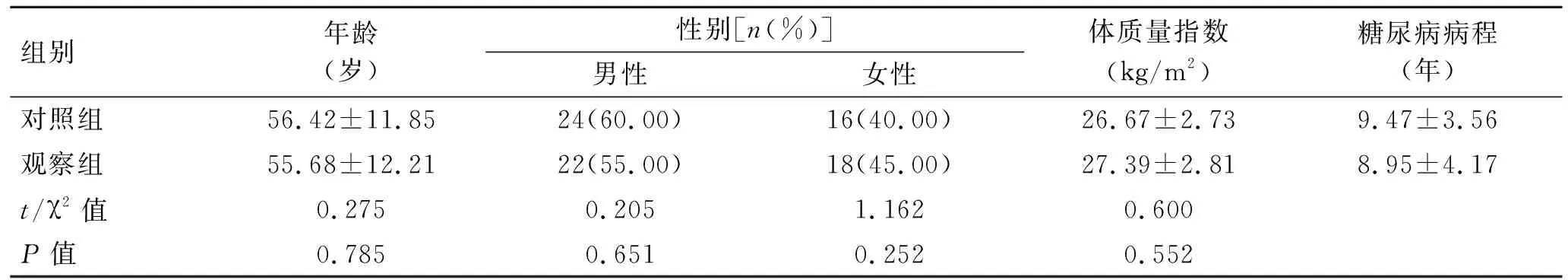
组别年龄(岁)性别[n(%)]男性女性体质量指数(kg/m2)糖尿病病程(年)对照组56.42±11.8524(60.00)16(40.00)26.67±2.739.47±3.56观察组55.68±12.2122(55.00)18(45.00)27.39±2.818.95±4.17t/χ2值0.2750.2051.1620.600P值0.7850.6510.2520.552
2.2 两组患者治疗前后血糖指标的比较治疗24周后两组患者FBG、HbAlc、MBG、SDBG、BGFR和MAGE均较治疗前显著降低(P<0.05)。治疗前两组患者FBG、HbAlc、MBG、SDBG、BGFR和MAG差异均无统计学意义(P>0.05),治疗24周的观察组患者FBG、HbAlc、MBG、SDBG、BGFR和MAG均较对照组显著降低(P<0.05,表2)。
2.3 两组患者治疗前后血脂和血压指标的比较治疗前两组患者上述血脂指标水平差异均无统计学意义(P>0.05);治疗24周时,两组患者TC、LDL-C和TG水平均较治疗前显著降低(P<0.05),并且观察组患者TC、LDL-C和TG水平均较对照组显著降低(P<0.05);两组患者HDL-C水平较治疗前显著升高(P<0.05),并且治疗后观察组HDL-C水平较对照组显著升高(P<0.05)。但是观察组患者治疗前后收缩压和舒张压差异均无统计学意义(P>0.05),对照组患者治疗后血压显著降低(P<0.05,表3)。
2.4 两组患者治疗前后肾功能指标的比较治疗前两组患者Scr、Umalb和ACR差异均无统计学意义(P>0.05);治疗24周时两组患者Scr、Umalb和ACR均较治疗前显著降低(P<0.05),并且观察组患者Scr、Umalb和ACR均较对照组显著降低(P<0.05);治疗24周时,观察组患者eGFR较治疗前显著升高(P<0.05),并且观察组eGFR较对照组显著升高(P<0.05,表4)。
表2 两组患者治疗前后血糖指标测量结果
Tab.2 Results of blood glucose indexes in both group before and after treatment (n=40)
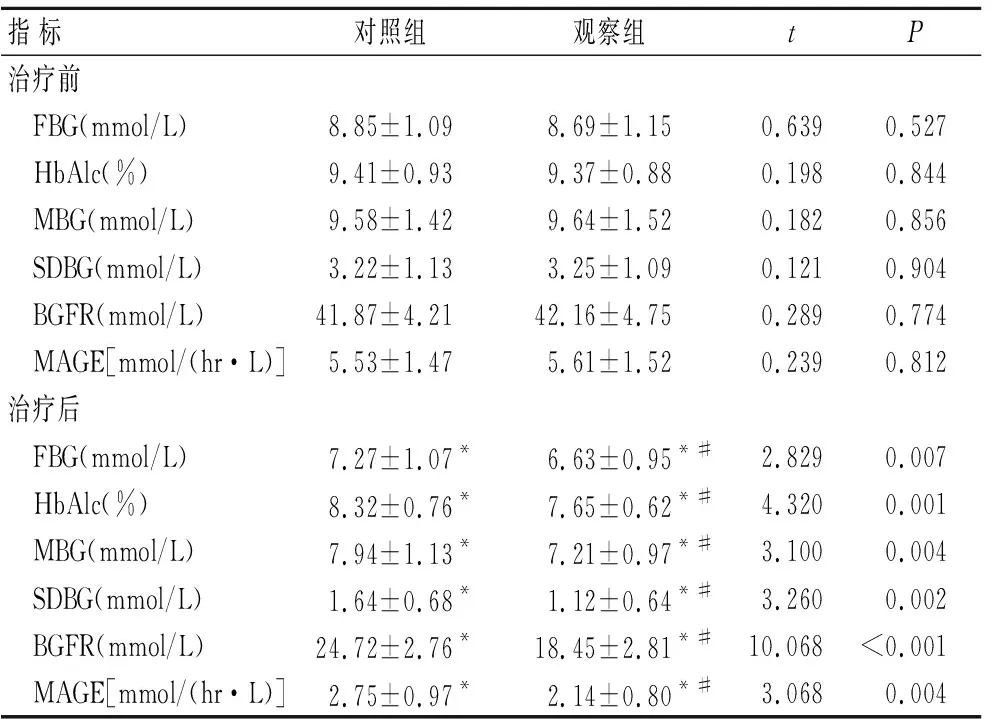
指标对照组观察组tP治疗前 FBG(mmol/L)8.85±1.098.69±1.150.6390.527 HbAlc(%)9.41±0.939.37±0.880.1980.844 MBG(mmol/L)9.58±1.429.64±1.520.1820.856 SDBG(mmol/L)3.22±1.133.25±1.090.1210.904 BGFR(mmol/L)41.87±4.2142.16±4.750.2890.774 MAGE[mmol/(hr·L)]5.53±1.475.61±1.520.2390.812治疗后 FBG(mmol/L)7.27±1.07*6.63±0.95*#2.8290.007 HbAlc(%)8.32±0.76*7.65±0.62*#4.3200.001 MBG(mmol/L)7.94±1.13*7.21±0.97*#3.1000.004 SDBG(mmol/L)1.64±0.68*1.12±0.64*#3.2600.002 BGFR(mmol/L)24.72±2.76*18.45±2.81*#10.068<0.001 MAGE[mmol/(hr·L)]2.75±0.97*2.14±0.80*#3.0680.004
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
表3 两组患者治疗前后血脂指标和血压测量结果
Tab.3 Results of blood lipid indexes and blood pressure in both group before and after treatment (n=40)
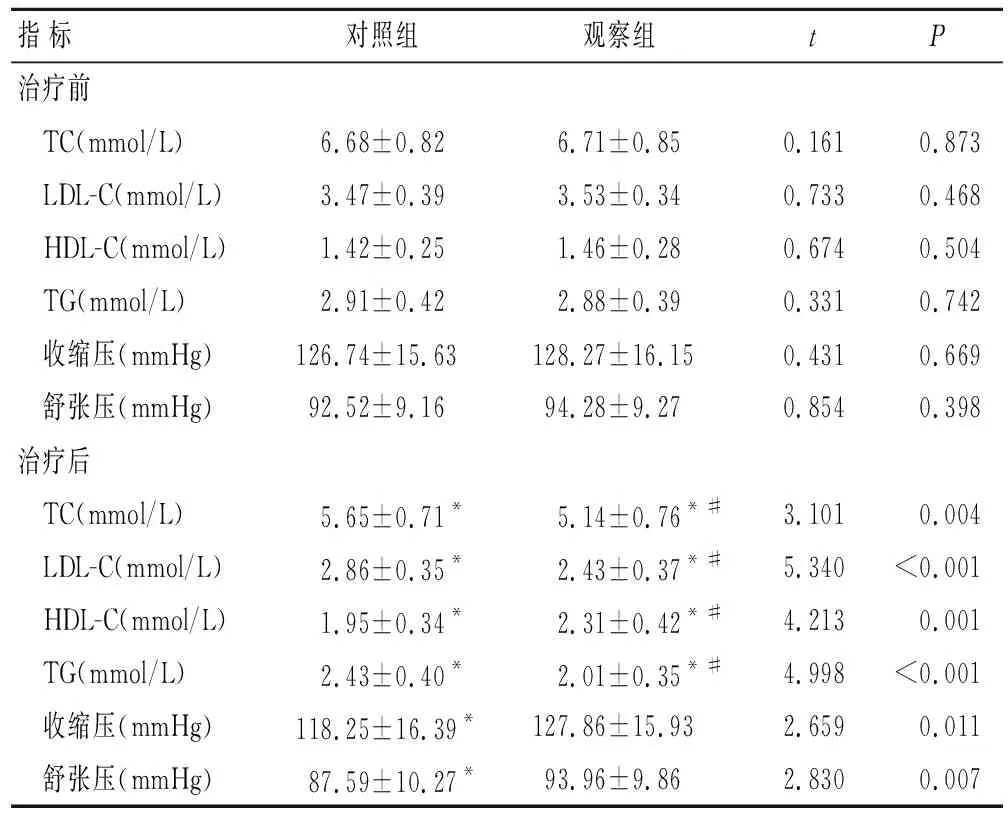
指标对照组观察组tP治疗前 TC(mmol/L)6.68±0.826.71±0.850.161 0.873 LDL-C(mmol/L)3.47±0.393.53±0.340.7330.468 HDL-C(mmol/L)1.42±0.251.46±0.280.6740.504 TG(mmol/L)2.91±0.422.88±0.390.3310.742 收缩压(mmHg)126.74±15.63128.27±16.150.4310.669 舒张压(mmHg)92.52±9.1694.28±9.270.8540.398治疗后 TC(mmol/L)5.65±0.71*5.14±0.76*#3.1010.004 LDL-C(mmol/L)2.86±0.35*2.43±0.37*#5.340<0.001 HDL-C(mmol/L)1.95±0.34*2.31±0.42*#4.2130.001 TG(mmol/L)2.43±0.40*2.01±0.35*#4.998<0.001 收缩压(mmHg)118.25±16.39*127.86±15.932.6590.011 舒张压(mmHg)87.59±10.27*93.96±9.862.8300.007
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。1 mmHg=0.133 Kpa。
表4 两组患者治疗前后肾功能各指标的比较
Tab.4 Results of renal function indexes in both groups before and after treatment (n=40)
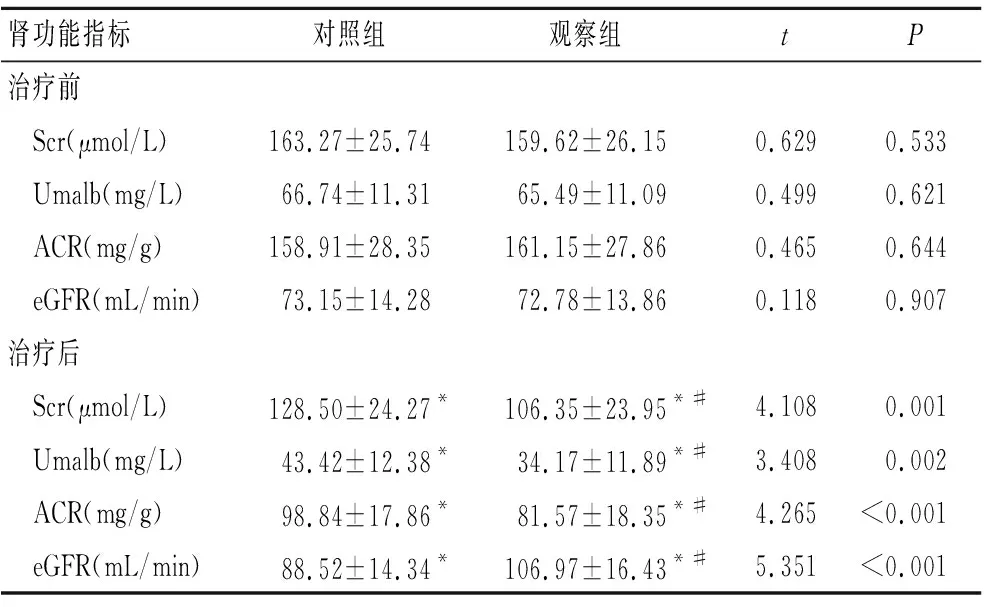
肾功能指标对照组观察组tP治疗前 Scr(μmol/L)163.27±25.74159.62±26.150.6290.533 Umalb(mg/L)66.74±11.3165.49±11.090.4990.621 ACR(mg/g)158.91±28.35161.15±27.860.4650.644 eGFR(mL/min)73.15±14.2872.78±13.860.1180.907治疗后 Scr(μmol/L)128.50±24.27*106.35±23.95*#4.1080.001 Umalb(mg/L)43.42±12.38*34.17±11.89*#3.4080.002 ACR(mg/g)98.84±17.86*81.57±18.35*#4.265<0.001 eGFR(mL/min)88.52±14.34*106.97±16.43*#5.351<0.001
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
2.5 两组患者治疗前后血清AGEs、cAMP和氧化应激指标的比较治疗24周时,对照组患者血清AGEs和cAMP水平均较治疗前显著降低(P<0.05),而治疗前后血清MDA、SOD和CAT水平差异无统计学意义(P>0.05);治疗24周的观察组患者血清AGEs、cAMP和MDA较治疗前显著降低(P<0.05),而血清SOD和CAT水平较治疗前显著升高(P<0.05,表5)。治疗前两组患者血清AGEs、cAMP、MDA、SOD和CAT水平差异无统计学意义(P>0.05),但是治疗24周的观察组患者血清AGEs、cAMP和MDA较对照组显著降低(P<0.05),而血清SOD和CAT水平较对照组显著升高(P<0.05,表5)。
表5 两组患者治疗前后血清AGEs和氧化应激指标的比较
Tab.5 Results of serum AGEs and oxidative stress indexes in both group before and after treatment (n=40)

观察指标对照组观察组tP治疗前 cAMP(pmol/L)43.21±3.9642.87±4.120.3760.709 AGEs(mg/L)35.89±5.3136.14±5.290.2110.834 MDA(nmol/mL)8.75±1.168.82±1.210.2640.793 SOD(nU/mL)24.67±3.1225.22±3.430.7500.458 CAT(nU/mL)19.75±3.7420.26±3.420.6360.528治疗后 cAMP(pmol/L)36.38±4.15*28.96±3.85*#8.290<0.001 AGEs(mg/L)29.75±5.12*24.58±5.86*#4.202<0.001 MDA(nmol/mL)8.69±1.214.73±1.05*#15.633<0.001 SOD(nU/mL)25.43±4.7556.81±5.52*#27.253<0.001 CAT(nU/mL)21.51±3.6428.56±3.20*#9.200<0.001
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
2.6 两组患者治疗前后外周血单个核细胞中PKA/CREB信号通路相关蛋白水平的比较治疗24周的观察组患者外周血单核细胞中PKA和p-CREB蛋白水平较治疗前显著降低(P<0.05),但是CREB蛋白水平与治疗前差异无统计学意义(P>0.05,图1)。治疗前两组患者外周血单核细胞中PKA、CREB和p-CREB蛋白水平差异均无统计学意义(P>0.05),治疗24周的观察组患者外周血单核细胞中PKA和p-CREB蛋白水平较对照组显著降低(P<0.05),但是CREB蛋白水平与对照组差异无统计学意义(P>0.05,图1)。
3 讨 论
艾塞那肽最初是从希拉巨蜥唾液分离而得,可激活人类GLP-1受体发挥类似GLP-1的抗高血糖作用。艾塞那肽除控制血糖外,还可改善胰岛β细胞功能,刺激胰岛β细胞增殖与分化[8]。本研究观察组患者经过24周治疗,FBG和HbAlc均较对照组显著降低(P<0.05),说明艾塞那肽对DKD患者的高血糖具有较好的控制作用;观察组患者MBG、SDBG、BGFR和MAG均较对照组显著降低(P<0.05),说明艾塞那肽降血糖作用比较平稳,可显著减少患者的血糖波动。观察组患者在治疗24周时的血脂指标较对照组明显改善,表现为TC、LDL-C和TG显著降低(P<0.05),HDL-C水平显著升高(P<0.05),说明艾塞那肽对DKD患者血脂具有一定的调控作用。治疗24周时,观察组患者较对照组肾功能明显改善,表现为Scr、Umalb和ACR均显著降低(P<0.05),eGFR显著升高(P<0.05)。提示艾塞那肽对DKD患者肾功能具有显著的改善作用。
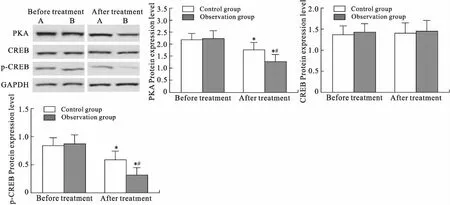

图1 两组患者治疗前后外周血单个核细胞中PKA/CREB信号通路相关蛋白的测定结果Fig.1 Results of PKA/CREB signal pathway related protein in mononuclear cells of peripheral blood in both group before and after treatment (n=40)与治疗前(Before treatment)比较,*P<0.05;与对照组(Control group)比较,#P<0.05。A:对照组(Control group);B:观察组(observation group)。
AGEs-RAGE-氧化应激系统参与糖尿病及其并发症的发生发展。高糖可促进AGEs生成并在肾组织蓄积,可直接导致系膜细胞增生,最终导致肾小球硬化或小管间质纤维化等病理改变,并且AGEs与RAGE受体结合,激活AGEs-RAGE通路,诱导并增强下游转化生长因子-β(transforming growth factor-β, TGF-β)及其他致纤维化细胞因子的表达[9],加速纤维化进展[10-11]。动物实验研究显示,艾塞那肽可降低DKD大鼠肾组织AGEs水平[12]。本研究观察组患者治疗24周时的血清AGEs较对照组显著降低(P<0.05)。提示艾塞那肽可降低DKD患者血清AGEs水平,从而发挥肾脏保护作用。
糖尿病的发生发展与机体的氧化应激作用增强关系密切[13]。氧化应激反应造成的损伤在DN的发生发展中有重要作用,与持续高血糖状态和AGEs增加引起的氧化还原状态的改变相关[14]。机体过量的ROS可激活机体转录因子及信号转导级联通路,从而使肾脏基底膜增厚、肾小球滤过率增高,启动DN的发病机制并参与疾病发生发展[15]。而血清SOD、CAT和MDA水平可反映机体的氧化应激状态。本研究中观察组患者治疗24周时,氧化应激状态较对照组显著改善,表现为血清MDA显著降低(P<0.05),血清SOD和CAT水平显著升高(P<0.05)。提示艾塞那肽可改善DKD患者体内的氧化应激反应程度,从而发挥肾脏的保护作用。
TGF-β过度表达与肾纤维化密切相关,而激活环磷酸腺cAMP/PKA信号通路,可明显诱导细胞中TGF-β1的表达[16],进而促进肾纤维化进展[17]。PKA由2个催化亚基和2个调节亚基组成。CREB是PKA通路下游的转录因子家族成员,cAMP可活化PKA调节亚基而直接转位入核,PKA通过催化CREB磷酸化而启动下游基因表达,广泛参与DKD发病的各个环节。cAMP/PKA信号通路与TGF-β诱导的肾小球硬化关系密切,阻断cAMP/PKA信号通路可抑制TGF-β1诱导的肾小球硬化[18]。另有研究显示,cAMP抑制剂可引起间质纤维化相关蛋白高表达而直接促进间质纤维化进程[19]。本研究结果显示,观察组治疗24周患者的外周血单核细胞中PKA和p-CREB蛋白水平较对照组显著降低(P<0.05),而CREB蛋白水平与对照组差异无统计学意义(P>0.05)。提示艾塞那肽可通过抑制PKA生成和CEEB磷酸化而调节cAMP/PKA信号通路,从而发挥肾脏的保护作用。
总之,艾塞那肽对DKD具有一定的保护作用,降低患者AGEs生成、改善机体氧化应激以及调节cAMP/PKA信号通路可能与其保护DKD有关。

