基于CT后处理重组技术的孤立性肺结节良恶性危险因素
张崴琪,王一卓,王晓慧,崔龙彪,郭宁,赵娓娓,文娣娣,张劲松,印弘
孤立性肺结节(solitary pulmonary nodule,SPN)是指直径≤3 cm的结节,显示为肺内单一的、边界清晰的、不透明的、为正常肺组织围绕的病变,且无肺门增大、肺不张或胸腔积液的表现[1-2],其性质多种多样。随着社会的进步、国民健康意识的提高和CT检查技术的快速发展,SPN的检出率越来越高。良性SPN可不做任何处理,恶性SPN及时处理具有良好的愈后。如果早期恶性SPN没有及时诊治,进展到晚期或发生转移再处理往往给医患带来极大的困难。可见,SPN的早期定性诊断至关重要。因此,本文旨在分析基于CT后处理重组技术的SPN良恶性危险因素,为SPN的临床准确诊治提供强有力的依据。
材料与方法
1.一般资料
搜集2015年11月-2019年1月在空军军医大学第一附属医院呼吸科或胸外科就诊并最后在胸外科行胸腔镜手术切除且有病理结果的97例SPN患者。患者术前均在放射科进行过肺结节CT扫描并后处理重组,具有完整的影像学资料。选择纳入标准:①患者均行肺结节CT后处理重组;②直径≤3 cm的肺内单发圆形、类圆形高密度影;③病灶周围无明确的卫星灶,不伴有肺炎、肺不张及胸腔积液;④有病理结果。排除标准:①肺内超过1个以上肺结节灶或包块影;②肺内合并有支气管扩张、炎症、重度肺气肿等其它病变;③胸部CT扫描范围内可见颈部、锁骨区、纵隔、腋窝及腹腔、腹膜后肿大淋巴结;④通过其它检查发现有远处转移者;⑤病理结果不明确或CT图像质量不佳。所有受试者中,男患者35例,女患者62例;年龄29~84岁,平均年龄(55.66±12.02)岁。
2.方法
CT检查扫描方法:肺结节后处理重组检查的患者均使用GE公司的64层螺旋CT机(Light speed)进行扫描,检查前对患者进行屏气呼气训练,扫描时嘱患者双手抱头,采取仰卧位于检查床上,然后行全胸部连续容积扫描,范围从胸廓入口至双肺底。扫描参数设置管电压120 kV,管电流120 mA,层厚0.625 mm,层间距0.625 mm,螺距0.516:1,矩阵512×512。
CT后处理重组方法:选择CT机内提供的标准重建算法,将螺旋扫描取得的肺部原始数据进行薄层(0.625 mm)重建,重建后的数据传输至CT副台后处理工作站(GE AW4.3)。从科室胸部组选择一名经验丰富的主治医生对图像数据进行后处理重组:①多平面重建(multi planar reconstruction,MPR);②曲面重建(curved planar reconstruction,CPR);③最大密度投影(maximum intensity projection,MIP);④容积再现(volume rendering,VR)。通过后处理重组后重点观察:①结节的位置分布及直径大小;②瘤-肺界面光滑或是粗糙,病灶内是否含有磨玻璃影(ground-glass opacity,GGO)、钙化;③主要CT影像特征:分叶征、毛刺征、胸膜牵拉征、支气管血管集束征、空泡征以及空气支气管征。
3.观察指标
SPN患者的一般情况(年龄、性别)和临床病史[吸烟史、既往肿瘤史、家族肿瘤史、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)病史、结核病史]。
单因素分析患者年龄、性别、吸烟史、既往肿瘤史、家族肿瘤史、COPD病史、结核病史及结节位置、大小、瘤-肺界面、钙化、GGO、分叶征、毛刺征、胸膜牵拉征、支气管血管集束征、空泡征及空气支气管征)与SPN良恶性的关系。
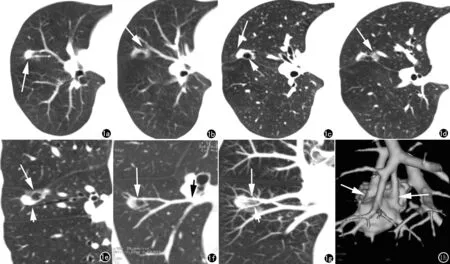
图1女,51岁,浸润性腺癌(乳头状为主)。a) 常规轴面(层厚5mm)示右肺中叶实性结节(箭);b) 常规轴面示右肺中叶实性结节边界欠清(箭),其内似见透亮影;c) 轴面重组(层厚0.625mm)示病灶实性部分(箭)、透亮区(短箭);d) 轴面重组示病灶毛玻璃成分(箭);e) 矢状面重组示病灶轻度牵拉斜裂胸膜致胸膜凹陷(箭),并清晰显示邻近支气管(短箭)贴行结节边缘;f) 冠状面重组直观显示病灶内有邻近血管(短箭)的分支穿行其中,并可追踪血管来源于肺动脉(箭);g) MIP显示部分血管插入结节(箭),部分血管绕行于病灶旁(短箭);h) VR逼真显示结节的形态不规则,表面不光整,局部有浅分叶,内见血管插入(箭)。
多因素Logistic回归分析获取SPN的独立危险因素。
4.统计学分析
应用SPSS 22.0软件进行统计分析,计数资料采用(%)表示,且组间率的比较使用卡方检验。把SPN恶性设定为因变量,将可能影响SPN良恶性的18个因素设定为自变量。首先进行单因素分析得出这18个因素与SPN恶性的关联,然后再对单因素分析有意义的变量进行多因素Logistic回归分析。P<0.05表示差异有统计学意义。
结 果
1.病理结果
所搜集97例SPN患者中,术后病理汇报显示:恶性SPN共计77例(79.4%),其中腺癌75例(77.3%),鳞癌2例(2.1%)。良性SPN共计20例(20.6%),其中错构瘤4例(4.1%),硬化性肺泡细胞瘤4例(4.1%),结核5例(5.2%),炎性灶6例(6.2%),肺透明细胞瘤1例(1.0%)。
2.单因素分析
在所有良恶性SPN患者中,将年龄、性别、吸烟史、既往肿瘤史、家族肿瘤史、COPD病史、结核病史、结节位置、大小、瘤-肺界面、钙化、GGO、分叶征、毛刺征、胸膜牵拉征、支气管血管集束征、空泡征以及空气支气管征进行单因素分析发现结节位置、大小、瘤-肺界面、钙化、GGO、分叶征、胸膜牵拉征差异在结节的良恶性鉴别中均有统计学意义(P<0.05),而患者年龄、性别、吸烟史、既往肿瘤史、家族肿瘤史、COPD病史、结核病史、毛刺征、支气管血管集束征、空泡征以及空气支气管征等因素的差异均无统计学意义(P>0.05,表1、2,图1)。
3.Logistic多因素回归分析
把上述单因素分析中具有统计学意义的结节位置、大小、瘤-肺界面、钙化、GGO、分叶征、胸膜牵拉征等7项因素进行多因素Logistic回归分析,最后结果发现结节大小、GGO是判断良、恶性SPN的独立危险因素(表3)。
讨 论
1.SPN的诊断现状
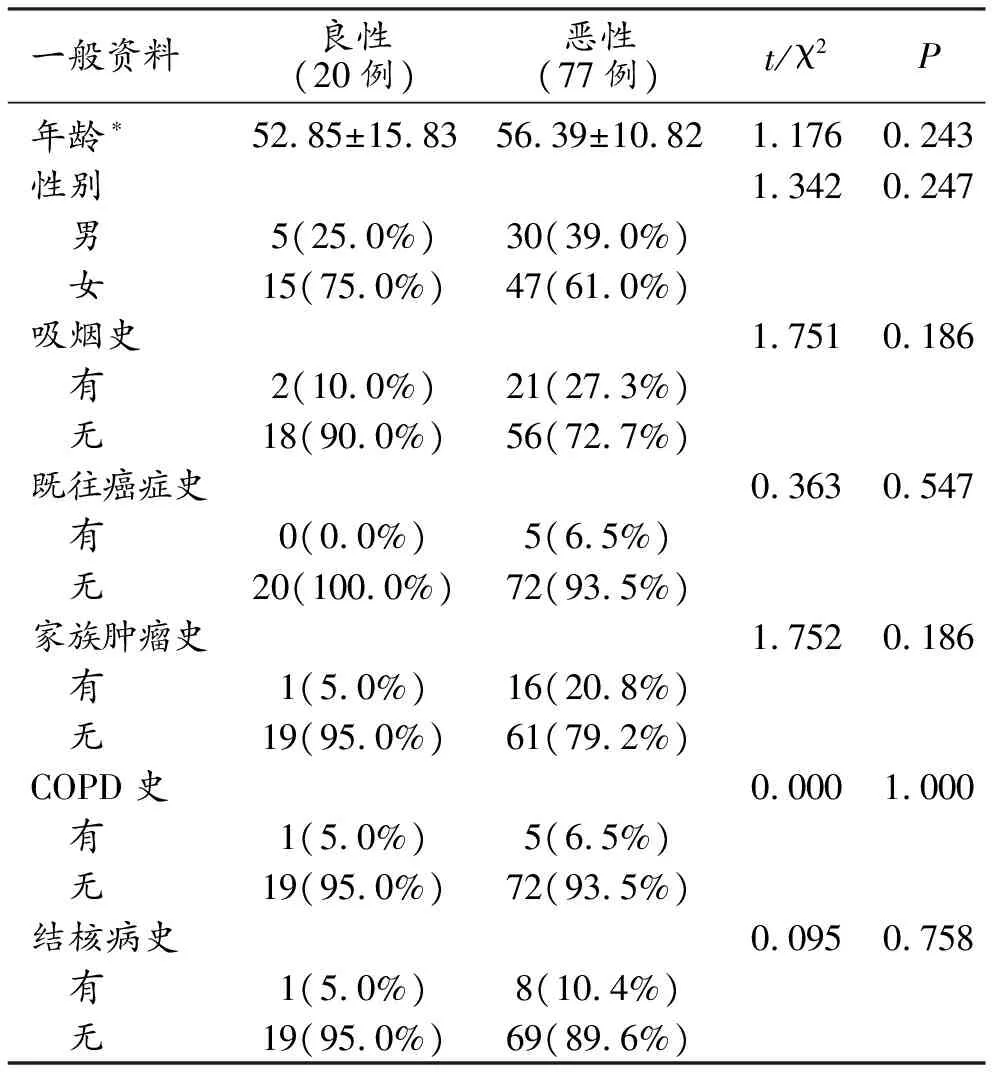
表1 良、恶性SPN患者的一般临床情况和病史比较

表2 良、恶性SPN患者的影像学资料比较

表3 SPN恶性病变危险因素的Logistic多因素回归分析结果
SPN主要包括周围型肺癌、结核瘤、转移瘤、错构瘤、硬化性肺泡细胞瘤、隐球菌以及肌纤维母细胞瘤等[3]。肺结节早期定性诊断一直是临床及放射学者研究的难点和热点,处置病灶前明确其性质至关重要。目前,鉴别SPN良恶性的影像学检查方法有很多[4]。常见的无创检查中胸部X线片是筛查SPN最为简便、经济的方法,但是对磨玻璃结节(ground-glass nodule,GGN)、微小结节、脊柱旁及心脏后结节漏诊率很高;正电子发射计算机断层显像(positron emission tomography,PET)对于SPN诊断的灵敏性和阴性预测值较高,但其特异性较低且检查费用昂贵,另外对纯磨玻璃结节(pure ground-glass nodule,pGGN)或直径<5mm的小结节敏感性也不高;MRI由于其具有较高的软组织分辨率,故对于较大的实性结节具有一定的优势,但对小结节的检出及定性诊断价值均不高,另外检查程序繁琐、成像速度较慢、价格相对较高也限制了它在SPN中的应用。在无创的影像检查对SPN定性困难的时候,必要时会行有创检查如纤维支气管镜刷检和灌洗、CT引导下经皮肺穿刺活检等,这也主要是针对实性成分较多的结节。而MSCT扫描检查由于扫描速度快、空间分辨率高、无创等特点非常适用于肺部病变的筛查,对SPN的意义在于可以更清晰、更直观、更全面、更立体地显示结节密度、形态以及与相邻支气管、血管等结构的关系,从而尽可能达到准确诊断的目的。
2.CT后处理重组技术在SPN良恶性危险因素分析中的优势
CT常规扫描作为一种无创的检查方法,较传统的胸部X线片能检出更多的肺结节病变,现已逐渐成为常规筛查肺结节的有效手段。然而,常规CT轴面图像观察面单一,并且扫描层厚多在5mm以上,对肺结节的微细特征影像显示欠佳,不能较充分反映肺结节的真实成分,故不能对病灶做到准确的定性、定量。而CT后处理重组技术有着全面、强大的后处理功能。①多平面重组(MPR):在轴面图像的基础上,增加冠状面和矢状面二维成像,必要时行斜冠状面和斜矢状面成像,能够全方位、多角度的显示病灶的形状、成分及边缘情况;②曲面重组(CPR):可将不同平面或空间的病灶显示到一个面上,清楚、直观的观察病灶与邻近血管、支气管的毗邻关系;③最大密度投影(MIP):立体显示不同平面高密度的图像,重点显示病灶与邻近血管的关系;④容积再现(VR):使用各种模式和色彩形象、立体地呈现出结节灶,对邻近胸膜的细微变化敏感。可见,CT后处理重组技术较常规CT扫描技术对图像的显示、处理、分析有着绝对的优势。先前对SPN良恶性危险因素的研究,影像的信息都是在常规CT轴面厚层图像上去判别。但在本研究中,影像资料全都使用CT后处理重组技术取得。所以更能全面、真实的观察SPN的细节特征,具有更高的图像品质和更广的图像范围,可以精准、直观的呈现出结节的解剖位置和细节,清楚、细微地显示出结节密度、边缘及其与邻近血管、支气管和胸膜的关系,从而所得到的诊断信息要比常规CT更为丰富多样,故能更有效地提高良恶性肺结节危险因素分析的准确性和可信度。
3.SPN良恶性危险因素的分析
本研究分析的我院97例SPN患者的资料,先通过单因素分析显示,结节位置、大小、瘤-肺界面、钙化、GGO、分叶征、胸膜牵拉征与SPN的良恶性有关。多因素Logistic回归分析提示,SPN的恶性独立危险因素是结节大小、GGO。
当前,结节位置与SPN性质的相关性仍然不明确。YANG等[5]的研究表明位于上叶不是恶性结节的独立危险因素。而有研究[6]显示结节的位置可以作为判断其良恶性的独立危险因素,且恶性SPN多出现在上叶[7]。本研究也发现恶性结节出现在上叶的几率较大,77例恶性SPN中有53例(68.8%)位于上叶,而20例良性SPN只有3例(15.0%)位于上叶,单因素分析有统计学意义。但多因素Logistic分析后表明结节位于上叶不能作为结节恶性的独立危险因素,分析原因可能是本组肺结核占比较高所致,因为结核亦好发于上叶。
本研究显示结节大小是SPN的独立危险因素。本组恶性SPN共77例,最大径在2~3cm的共37例(48.0%),最大径在1~2cm的22例(28.6%),≤1cm有18例(23.4%)。由此可见,结节越大,恶性概率越高。这与YANG等[5,8]研究结果一致。
瘤-肺界面光滑表明结节边界清楚,一般提示良性病变,例如结核球、错构瘤、硬化性肺泡细胞瘤等,但也可见于恶性病变。比如本研究发现共77例恶性SPN中,瘤-肺界面清楚44例(57.1%),粗糙33例(42.9%),其中绝大部分的早期肺腺癌的瘤-肺界面都较清楚、光滑。尽管边缘毛糙通常提示恶性结节的可能,但也有例外,比如肉芽肿性炎、肺炎和肺组织纤维化等病变[9]。所以,瘤-肺界面光滑与否并不是恶性结节的独立危险因素。
肺内钙化多由炎症、结核等疾病引起,也可能是病变肺组织坏死后的转归,它是细胞组织自身修复的一种方式。伴有钙化的肺结节往往提示良性病变。Shi等[10]认为结节钙化是肺结节的保护性因素。本研究单因素分析表明结节钙化与否在其良恶性鉴别中有意义,但多因素回归分析结果没有显示结节钙化是其保护性因素,分析可能是由于含有钙化的结节样本量少造成。
GGN是指肺内密度增高但未遮盖原有区域内肺血管影和支气管壁影的≤3cm类圆形病灶。结节表现为GGO,可能原因是炎性渗出性病变、出血性病变或肿瘤性病变。本研究多因素Logistic回归分析说明结节含有GGO是恶性SPN的独立危险因素。本实验共纳入77例恶性SPN病例,含有GGO的SPN共计65例(84.4%),远多于不含有GGO结节的数量12(15.6%)。而且77例恶性SPN中,腺癌占了绝大多数(97.4%)。由此可见,含有GGO的SPN,肺腺癌的概率很大。研究显示当pGGN直径>15mm或者CT值>-472HU时,浸润性腺癌可能性很大[11]。本研究还发现血性、炎性的GGN边界常模糊不清,密度不均匀,形态不规则。而为早期肺腺癌的GGN常边界较清,密度均匀,形态规则。倘若是恶性GGO结节密度不均匀或出现实性成分,常提示肿瘤发生浸润性改变。因此,对GGN的定性,需要根据结节的边界、形态、密度仔细辨别。
分叶征是肿瘤向周围不同方向生长的快慢不同形成,通常在恶性病变中多见。肺癌的各个阶段和各种成分都可能出现此征象。常见的早期肺腺癌或癌前病变,肿瘤可表现为椭圆形、多角形等具有分叶形态的GGN。呈实性结节或肿块的肺癌出现分叶征象的概率更大。Swensen等[12]研究表明分叶征为恶性结节的独立危险因素,阳性预测值达到了88%~94%。然而,也有其它研究表明25%的良性结节可出现分叶征[13],最常见于错构瘤,部分可见于硬化性肺泡细胞瘤。本研究结果表明分叶征不是恶性结节的独立危险因素,可能与样本中良性结节如错构瘤、硬化性肺泡细胞瘤数量相对较多有关系。
胸膜牵拉征又称胸膜凹陷征(pleural indentation,PI)是由于病变组织与邻近的胸膜局部出现粘连,引起胸膜内陷的征象[14]。Chu等[15]报道约67.4%的肺癌患者出现了PI。但是结核灶及普通炎性结节在靠近胸膜时,也会出现胸膜牵拉的改变,尤其结核灶对胸膜牵拉的力度、形态与肺癌非常相似。Shi等[10]研究发现良性和恶性肺结节的PI发生率不同,但并没有成为恶性肺结节的独立危险因素,这与本研究结果相一致。本研究还发现对胸膜牵拉的力度,通常恶性SPN较良性SPN要大。
4.本研究的不足之处
首先样本量相对较少,这是因为虽然临床工作中肺结节的患者很多,但是肺结节CT后处理需要花费放射科医生相对较大的精力和较多的时间,所以还未广泛、大量的开展此项检查。不过随着CT后处理技术的不断进步和人工智能技术的辅助,再加上我们团队不断致力于肺结节的诊疗研究,随着样本量的增加,我们仍会对CT后处理重组技术对肺结节良恶性危险因素分析进一步研究。其次本研究组纳入的患者均是术前高度怀疑为恶性病变者,而不是所有人群,所以最后在样本的选择上存在一定偏倚,相信以后随着工作的累积,收集的样本量会越来越多,从而使研究结果更加可信和准确。
总而言之,对于临床工作中发现的良恶性难以判别的SPN患者,推荐首选CT后处理重组技术进行检查,要重点观察结节位置、大小、瘤-肺界面、钙化、GGO、分叶征、胸膜牵拉征等影像征象,尤其注意结节大小、GGO等恶性的独立危险因素。相信通过此方法,必然可以大大的提高SPN早期诊断的水平。