上调miR-125b抑制人骨肉瘤细胞对阿霉素的耐药作用
吴贻平, 梁敏珊, 张潇涵, 刘情英, 罗曦,米贤军
1广东省中医院珠海医院病理科(广东珠海 519000); 2中山市博爱医院病理科(广东中山 528400)
骨肉瘤(osteosarcoma)是最常见的恶性骨病,原发于长骨中,以高转移倾向为特征,常见于儿童与青少年[1-2]。由于化疗药物的迅速发展,近几年来骨肉瘤患者的5年生存率明显提高以及其局部骨肉瘤复发率明显下降[3],然而骨肉瘤患者的预后仍然很差。骨肉瘤细胞对化疗药物耐药导致肿瘤转移和复发是骨肉瘤治疗失败的主要原因[4-5]。因此,我们应该更好地了解骨肉瘤对化疗药物产生抗药性的机制。MicroRNA(miRNA)是长度为18~25 nt,广泛表达、具有重要生物学作用的非编码RNA。近年来,许多研究表明各种癌细胞中的miRNAs水平异常[6-8]。此外,大量的研究表明miRNAs参与了肿瘤细胞的增殖、转移、凋亡和自噬[9-10]。最新文献将miRNAs与癌症化疗药物的耐药性联系起来[11]。因此,靶向miRNAs逆转耐药性可能是一种很有前途的治疗骨肉瘤的策略。MiR-125b在多种肿瘤中发挥类似于“癌基因”的作用,近几年来的一些研究发现在肿瘤耐药中miR-25b也起一定作用,包括黑色素瘤[12]、卵巢癌[13]、乳腺癌[14]等。目前尚没有关于miR-125b在骨肉瘤耐药作用的研究。本研究自2018年5—9月以人骨肉瘤细胞U-2OS和MG-63为研究对象,探讨miR-125b是否参与骨肉瘤对化疗药物的耐药作用。
1 材料与方法
1.1 实验材料 人骨肉瘤细胞株和人成骨细胞株购于中国科学院细胞库;高糖DMEM、胎牛血清、trizol、LipofectamineTM3000购自美国Thermo公司;阿霉素购自中国迈瑞尔化学技术有限公司;miR-125b模拟物/阴性对照、miR-125b抑制剂/阴性对照、逆转录引物和定量引物购自中国吉玛基因公司;CCK-8试剂购自日本同仁化学研究所;逆转录试剂盒和SYBR定量PCR试剂盒购自日本TaKaRa公司。
1.2 细胞培养 人骨肉瘤细胞株U-2OS、MG-63和人成骨细胞株HOSB接种于含有10%胎牛血清的高糖DMEM培养基中,置于37℃、5% CO2培养箱中培养。待融合度达80%~90%,采用0.25%胰酶进行消化传代。
1.3 阿霉素处理细胞 取对数生长期细胞,调整细胞密度为3×105/孔接种于6孔板中,接种24 h后,加入含有0.5 nmol/L阿霉素的完全培养基中。收集暴露于阿霉素0、24、48 h的细胞,抽提RNA,检测细胞中miR-125b的表达水平。
1.4 细胞转染 转染前24 h,取对数生长期的细胞,调整细胞密度为3×105/孔接种于6孔板中,按照LipofectamineTM3000说明书,将100 pmol miR-125b模拟物、miRNA阴性对照和5 μL LipofectamineTM3000转入细胞中。转染48 h后检测转染效率以及细胞耐药性的改变。
1.5 RNA提取和cDNA合成 根据Trizol说明书提取细胞总RNA。应用含有茎环结构的逆转录引物,根据M-MLV逆转录试剂盒说明书取1 μg总RNA在20 μL体系中合成cDNA。
1.6 实时荧光定量PCR 利用 SYBR定量PCR试剂盒检测细胞中miR-125b的表达水平。每个样本3个复孔,独立实验重复3次,目的基因相对表达水平以2-ΔΔCt表示。
1.7 CCK-8法检测细胞增殖 细胞转染24 h后,调整细胞密度为1×104/孔接种于96孔板中,实验组分两组:对照组(转染miRNA阴性对照)和实验组(转染miR-125b模拟物组),每组设6个复孔,加入100 μL含有0.5 nmol/L阿霉素的完全培养基,48 h后加入10 μL CCK-8试剂,培养箱孵育2 h,酶标仪中检测450 nm和630 nm处的吸光值(A值),以630 nm处A值为参照波长,根据公式计算细胞增殖抑制率,独立实验重复3次。细胞增殖率(%)=(A450 nm实验组-A630 nm实验组)/(A450 nm对照组-A630 nm对照组)×100%
2 结果
2.1 miR-125b在人骨肉瘤细胞和人成骨细胞中的表达水平检测 骨肉瘤细胞中miR-125b表达水平比成骨细胞表达水平低,差异有统计学意义(P<0.001),见表1。


细胞株nmiR-125bHOSB31.000±0.028U-2OS30.546±0.025MG-6330.365±0.026
2.2 阿霉素对人骨肉瘤细胞株U-2OS和MG-63中miR-125b的表达水平影响 阿霉素处理后细胞中miR-125b的表达水平出现不同程度下调,差异有统计学意义(P<0.01),见表2。
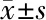

细胞株n0 h24 h48 hU-2OS31.000±0.0860.663±0.0380.531±0.016MG-6331.000±0.0410.571±0.0220.432±0.024
2.3 下调miR-125b表达后人骨肉瘤细胞株对阿霉素敏感性的检测 阿霉素处理后,抑制miR-125b表达后U-2OS细胞的增殖率升高约25%,见表3。MG-63的细胞增殖升高约30%,差异都有统计学意义(P<0.001),见表4。

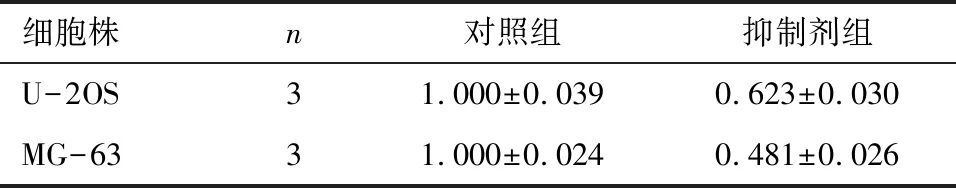
细胞株n对照组抑制剂组U-2OS31.000±0.0390.623±0.030MG-6331.000±0.0240.481±0.026
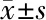

细胞株n细胞存活率(%)对照组抑制剂组U-2OS3100.000±2.538123.701±1.935MG-633100.000±4.151134.516±2.174
2.4 上调miR-125b表达后人骨肉瘤细胞株对阿霉素敏感性的检测 阿霉素处理后,上调miR-125b表达后U-2OS细胞的增殖率下降约38%,见表5。MG-63的细胞增殖下降约50%,结果都差异有统计学意义(P<0.001),见表6。


细胞株n对照组模拟物组U-2OS31.000±0.0771 530.000±111.355MG-6331.000±0.057949.667±32.868

表6 下调miR-125b表达后人骨肉瘤细胞株对阿霉素敏感性检测
3 讨论
骨肉瘤是指癌细胞能直接产生肿瘤骨及骨样组织的一种恶性结缔组织肿瘤,目前主要治疗方法是手术切除联合术前和术后化疗,部分患者化疗药物耐药性导致肿瘤复发和转移,严重阻碍疗效和生存率[4, 15]。目前有关骨肉瘤化疗药物耐药的机制仍不清楚。近年来,越来越多的研究发现miRNAs在人类癌症的发病机制中起着重要的作用,已经在许多实体肿瘤中,发现诊断和预后的miRNA表达谱,许多miRNA可以作为癌基因发挥作用,这表明miRNAs可以作为肿瘤治疗的新靶点。随着骨肉瘤患者对化疗药物耐药性的产生,导致生存率停滞,需要新的治疗方案,miRNAs可能有助于骨肉瘤治疗作为靶标[16]。
越来越多的研究发现miR-125b在肿瘤耐药性中发挥一定的作用。Vergani等[12]的研究发现黑色素瘤威罗菲尼耐药细胞株中miR-125b表达增加, miR-125b的表达抑制能增加黑色素瘤对威罗菲尼药物敏感性;Kong等[13]报道卵巢癌耐药细胞株C13*中miR-125b的表达明显比药物敏感细胞株OV2008增高,过表达miR-125b增加OV2008细胞对顺氯氨铂的耐药性;Shi等[17]抑制miR-125b在鼻咽癌细胞的表达后,替莫唑胺处理后肿瘤细胞凋亡率上升。本研究中,增加miR-125b的表达,阿霉素处理后骨肉瘤细胞增殖率下降,该结果与上述报道结果相反,分析原因可能与肿瘤类型、肿瘤细胞微环境、靶基因的差异及miRNA本身作用的复杂性有关,导致同一miRNA在不同肿瘤甚至同种肿瘤中发挥的不同甚至完全相反的作用。鉴于此,可通过扩大肿瘤细胞类型对miR-125b在不同类型肿瘤中的功能进行更全面更深入的探讨。
此外,也有研究发现miR-125b对肿瘤药物敏感性起作用,如Zhang等[18]发现过表达miR-125b能抑制肺癌耐药细胞株的耐药性;Yuan等[19]报道下调miR-125b表达能抑制鼻咽癌细胞的多药耐药作用。本研究与以上研究报道一致。人骨肉瘤细胞经阿霉素处理后,miR-125b的表达显著下降,下调miR-125b表达能明显提高其药物耐药性;过表达miR-125b表达能明显降低U-2OS细胞和MG-63细胞的药物耐药性。
本研究中,对miR-125b在人骨肉瘤细胞株U-2OS、MG-63细胞对阿霉素敏感性初步的探讨,发现miR-125b可能与人骨肉瘤细胞耐药性有关,并证实上调miR-125b能抑制人骨肉瘤细胞对阿霉素的耐药作用,为骨肉瘤的治疗提供了新的思路。然而,miR-125b对骨肉瘤细胞对阿霉素的耐药作用的具体机制尚未清楚,有待进一步研究。

