MRI对乳腺非肿块样强化良恶性病变的鉴别诊断
张 贝,杨 迪,聂 品,上官芳芳,王 英,户莉娜,于 军,陈宝莹
(空军军医大学唐都医院放射科,陕西 西安 710038)
MRI是诊断乳腺病变的重要手段,动态增强MRI可反映病变分布方式、内部强化特点及血流动力学特征。乳腺非肿块样强化(none-mass enhancement, NME)病变病理类型广泛,且缺乏典型影像学表现,是诊断重点及难点之一[1]。2013年乳腺影像报告与数据系统(breast imaging reporting and data system, BI-RADS)已得到临床广泛应用[2]。本研究基于BI-RADS对乳腺NME病变的影像学描述方法,回顾性分析NME病变的影像学特征及各分类征象在诊断与鉴别诊断中的价值,旨在为术前诊断提供依据。
1 资料与方法
1.1 一般资料 收集2015年10月—2017年7月我院因临床触诊、超声或X线检查可疑病变而接受乳腺MR检查的96例患者,均为女性,年龄27~61岁,平均(45.5±4.2)岁。纳入标准:①MRI表现为NME病变,即不具有占位效应的病灶,其中夹杂正常腺体和脂肪;②恶性病变及部分良性病变经手术或活检病理证实;③未接受手术或穿刺活检,经MRI随访18个月以上无变化而视为良性病变。
1.2 仪器与方法 采用GE Discovery MR750 3.0T MR扫描仪,乳腺专用线圈。嘱患者俯卧,双乳自然下垂置于线圈中央,扫描范围包括双侧乳腺及腋窝。平扫包括SE序列T1W(TR 500 ms,TE 8.3 ms)和FSE脂肪抑制T2W(TR 4 660 ms,TE 89 ms)。动态增强序列采用VIBRANT、ASSET并行采集技术,TR 3.9 ms,TE最小值,FOV 36 cm×36 cm,矩阵320×320,层厚1.4 mm,无层间距。对比剂采用钆双胺,剂量0.2 mmol/kg体质量,以高压注射器经手背静脉注入,流率2 ml/s,然后以相同流率注入15 ml生理盐水。注射对比剂的同时开始扫描,连续扫描5期,然后间隔60 s,继续扫描2期。
1.3 图像分析 采用ADW4.2工作站,对增强后第1期图像行冠状位、矢状位薄层重建,层厚1 mm,无层间距。采用Functool软件,选择增强后第1期图像中病灶实质强化最显著区域放置ROI,面积20~50 mm2,尽量避开出血、坏死及囊变区,绘制时间强度曲线(time-intensity curve, TIC)。
由2名具有5年乳腺MRI阅片经验的医师在不知晓病理结果的情况下分析和评估图像,意见不同时经协商达成一致。参照2013年ACR发布的BI-RADS术语系统,从分布方式、内部强化方式两方面来描述NME形态学表现。分布方式包括局灶样、线样、段样、区域样、多区域样及弥漫样分布;内部强化方式分为均匀、不均匀、集簇样及成簇环样强化;TIC模式分为Ⅰ型(流入型)、Ⅱ型(平台型)和Ⅲ型(廓清型)。参照对侧正常腺体信号,病变脂肪抑制T2WI信号分为等、稍高和高。
1.4 统计学分析 采用SPSS 20.0统计分析软件。以χ2检验比较良恶性病变间各MRI影像特征的差异。采用二元Logistic回归分析,计算优势比(odds ratio,OR),获得诊断乳腺良恶性NME病变的有效指标。P<0.05为差异有统计学意义。
2 结果
96例均为单发,共96个乳腺NME病变,良性28例(28/96,29.17%),包括乳腺腺病10例(图1)、浆细胞性乳腺炎10例、肉芽肿性炎3例、导管内乳头状瘤1例、随访无变化4例;恶性68例(68/96,70.83%),包括浸润性乳腺癌53例(图2)、导管原位癌10例、导管内乳头状癌1例、浸润性小叶癌1例及导管内癌3例。
经单因素分析结果显示,在内部强化方式上,均匀强化在良恶性病变间差异有统计学意义(P=0.026,表1)。在脂肪抑制T2WI信号上,良恶性病变间表现为高信号和等信号的差异有统计学意义(P=0.025、0.045,表1)。在TIC类型上,良恶性病变间表现为Ⅰ型和Ⅲ型的差异有统计学意义(P=0.013、0.001,表1)。乳腺良恶性病变间其他MRI征象差异均无统计学意义(P均>0.05,表1)。
将单因素分析显示有统计学差异的变量纳入多因素Logistic回归分析,得到T2WI等信号和TIC Ⅲ型是恶性病变的危险因素,OR值分别为5.228和10.841(表2)。
3 讨论
NME指不具有占位效应的病灶,其中夹杂正常腺体和脂肪[3]。2013版BI-RADS对NME病变形态学表现从分布方式、内部强化方式两方面来描述,按分布方式将其分为局灶、线样、段样、区域、多区域及弥漫分布。其中局灶为病变小于1个象限,异常强化区域内夹杂正常腺体和脂肪;线样指强化沿分支或不分支的线样(不一定是直线)排列;段样是强化尖端指向乳头的三角形或锥形分布;区域指强化占据超过1个导管系统(强化占据乳房较大一部分,至少1个象限);多区域指强化至少含有2块强化组织,不符合1个导管分布范围,中间夹杂有正常组织,此类强化涉及多个区域,呈地图样;弥漫指强化在整个乳房内随机分布。按内部强化方式,NME分为均匀、不均匀、集簇状及成簇环状。集簇状:如果强化局限于1个区域,则呈葡萄样,若为线样分布,呈串珠样;成簇环状指聚集在导管周围的细环形强化。目前对于乳腺肿块样病变已形成较为统一的诊断标准,而NME缺乏特征性表现,尚存在争议,也是造成漏诊、误诊的主要原因。
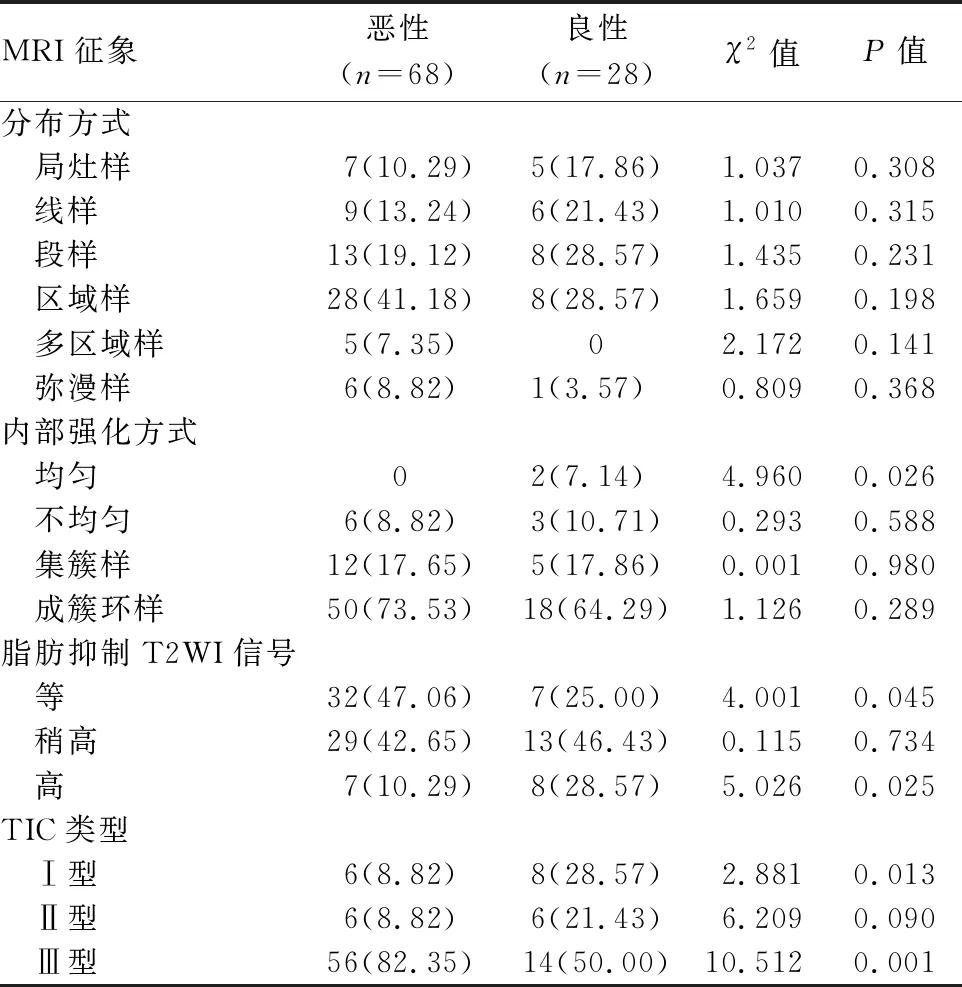
表1 MRI特征在良恶性乳腺NME病变中差异的单因素分析[例(%)]

表2 NME的MRI特征多因素Logistic回归分析
本组96个NME病变中,良性占29.17%(28/96),恶性占70.83%(68/96),恶性比例高于文献[4-5]报道,这是因为本组患者均为因临床触诊、超声或X线检查发现可疑恶性病变而行MR检查,故恶性比例高于筛查人群。本研究结果显示,乳腺NME病灶中,表现为均匀强化的良性病变较多,与Hsu等[6]报道结果一致,但本组良性病变中仅有2例为均匀强化,恶性病变中无均匀强化病例,还需进一步扩大样本量进一步观察。既往研究[7]认为乳腺良恶性NME病变在集簇状、成簇环样强化中存在差异,本研究结果与之不同,集簇状、成簇环样强化在良恶性病变中均占较高比例,但良恶性病变间无明显差异。需要注意的是,本研究对病变的观察均基于增强后第1期,可以有效防止随时间延长乳腺背景实质强化对病变造成干扰而影响判断。崔晓琳等[8]分析209例乳腺NME病变,认为段样分布可能是乳腺癌的特征表现;也有研究[9]提出段样分布对于不同病理类型的NME病变无鉴别诊断价值。为观察分布方式,本研究对所有病变均行冠状位、矢状位薄层重建,结合轴位图像,可以更加准确地判断病变走行和累及范围,从而提高准确性。本研究单因素分析结果显示,良恶性NME病变间分布方式差异均无统计学意义。
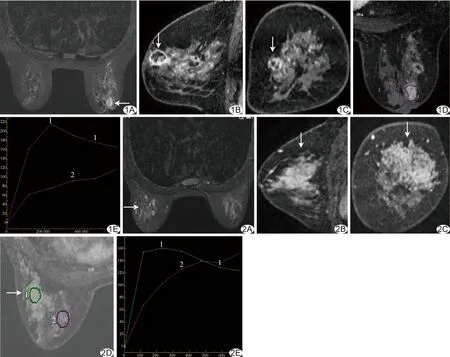
图1患者女,38岁,发现左乳肿块1月余,术后病理为腺病 A.脂肪抑制T2WI,病变呈高信号; B~D.矢状位(B)、冠状位(C)和轴位(D)增强图像,病变呈簇环样强化,区域样分布(箭); E.TIC为Ⅲ型(曲线1:病变;曲线2:正常腺体)图2患者女,42岁,发现右乳肿块3月余,术后病理为浸润性乳腺癌 A.脂肪抑制T2WI,病变呈等信号; B~D.矢状位(B)、冠状位(C)和轴位(D)增强图像示病变呈簇环样强化,区域样分布(箭); E.TIC为Ⅲ型(曲线1:病变;曲线2:正常腺体)
NME乳腺癌病变内夹杂正常脂肪及腺体,肿瘤可从中获取营养,故新生肿瘤血管少,可致其强化程度较低及廓清较慢。Choudhery等[10-11]认为TIC类型不能用于鉴别良恶性NME病变。本研究发现,良恶性病变在Ⅰ型和Ⅲ型TIC之间的差异均有统计学意义,Ⅲ型中恶性病变多于良性病变,而Ⅰ型中良性病变较多;多因素Logistic回归分析结果显示TIC Ⅲ型是恶性乳腺NME病变的危险因素,病灶TIC为Ⅲ型时,其为乳腺癌的概率是非Ⅲ型曲线的10.841倍。
乳腺炎性病变由于细胞水肿、毛细血管扩张及周围炎性渗出等使得含水量增高,脂肪抑制T2WI多表现为高信号。乳腺恶性病变中,除黏液腺癌因含有较多黏液成分、脂肪抑制T2WI呈高信号外,其他多表现为等信号[12-13]。本研究中,表现为脂肪抑制T2WI高信号的良性病变多于恶性病变,表现为等信号的恶性病变多于良性病变,与上述研究结果[12-13]一致,可能与入组良性病变中浆细胞性乳腺炎较多,且恶性病变中无黏液腺癌有关。脂肪抑制T2WI等信号是恶性NME病灶的危险因素,病灶为等信号时,其为乳腺癌的概率是非等信号的5.228倍。
总之,MRI有助于早期发现、早期诊断乳腺病变。本研究初步显示,NME恶性病变的危险因素包括脂肪抑制T2WI等信号及TIC类型为Ⅲ型。本组良性病变较少,可能影响统计学结果,有待扩大良性病例样本量进一步分析。

