蒸汽爆破预处理对紫甘薯花色苷抗氧化性及抑菌性的影响
易军鹏,杨亚皇,李 欣,赵鹏成,贺 健
(1.河南科技大学食品与生物工程学院,河南洛阳 471023;2.河南科技大学化工与制药学院,河南洛阳 471023)
紫甘薯(Solanum tuberdsm) 又被称为紫薯,属于旋花科甘薯属蔓生草本植物[1],在我国广东、河北等地均有种植[2]。紫甘薯含有多糖及花青素等多种功能性成分,研究表明,紫甘薯包含的活性成分具有较强的抗氧化性[3-4]、抗突变[5]、保护肝脏[6]、降血糖和抗肿瘤[7]等药理作用。目前,与国外发达国家的研究相比,国内对于紫甘薯花色苷的研究仍处于初级阶段,尤其是对于花色苷的生物合成调控机理及关键基因的表达分析,这2个方面需要更加深入的研究[8],而这对于如何高效应用紫甘薯花色苷有十分重要的意义。
随着生活观念的转变,人们对添加剂的安全性越来越重视,这就造成了从人工到天然的新革命。花色苷不仅能够用作保健品添加剂,还能够用作医药添加剂,并且也可以作为天然染色剂,而且将花色苷应用到这些方面,很符合现代人的要求。有一些国家已经成功将花色苷类的色素制成食品与药品,由此可见,花色苷拥有巨大的开发潜力[9]。国内外研究表明,蒸汽爆破(Steam explosion pretreatment,SEP)可有效提高原料溶出率、增加提取率。此外,蒸汽爆破作用会产生巨大的机械剪切力,能够断裂某些化学键,使物质分子量减小、生物活性提高[10]。
试验以未处理及不同蒸汽爆破条件预处理紫甘薯提取的花色苷为研究对象,通过紫外光谱扫描及高效液相色谱,研究蒸汽爆破对紫甘薯花色苷最大吸收波长和花色苷各组分相对含量的影响,以DPPH自由基、羟自由基和还原力为指标研究蒸汽爆破对紫甘薯花色苷外抗氧化能力的影响。通过牛津杯法与二倍稀释法,研究紫甘薯花色苷对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌的抑菌性并测定最小抑菌浓度。为今后研究开发利用紫甘薯提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜紫甘薯,购自河南洛阳当地超市,经鉴定品种为“宁紫4号”;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),上海伊卡生物公司提供;无水乙醇、硫酸亚铁、铁氰化钾、抗坏血酸、水杨酸、盐酸、乙酸乙酯、柠檬酸、磷酸氢二钠、乙腈、氢氧化钠、AB-8型大孔树脂,国产分析纯,天津德恩化学试剂厂提供。
1.2 仪器与设备
QBS-80型间歇式蒸汽爆破机,正道启宝环保科技有限公司产品;UV-4800型紫外可分光光度计,尤尼柯(上海)仪器有限公司产品;HH-S6型数显恒温电子水浴锅,江苏省金坛市环宇科学仪器厂产品;SW-CJ-1G型超净工作台,江苏苏净集团有限公司产品;LDZX-30KBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂产品。
1.3 试验方法
1.3.1 紫甘薯蒸汽爆破预处理
将紫甘薯清洗干净,切丁,置于45℃烘箱内干燥24 h,将干燥的紫甘薯用不同比例的去离子浸泡12 h,选取不同的爆破条件,在QBS-80型蒸汽爆破机中对原料进行预处理。收集爆破后的原料,置于45℃烘箱内干燥至恒质量,干燥避光保存[11]。不同蒸汽爆破条件处理的紫甘薯提取的花色苷(SEP-1,SEP-2及SEP-3为同一维压时间(45 s) 及含水率(10%),不同蒸汽爆破压强(SEP-1,SEP-2及SEP-3处理条件分别为0.5,1.5,2.5 MPa) 处理条件下提取的紫甘薯花色苷。另取一部分未经蒸汽爆破处理的干燥紫甘薯提取的花色苷(Untreated)作为对照。
1.3.2 紫甘薯花色苷提取工艺
参照李春阳等人[12]报道的方法并稍作修改,称量紫甘薯粉末10.0 g放入三口烧瓶中,按料液比1∶35,pH值1.0,提取温度60℃,提取时间1 h。反应混合物在4℃下,以转速10 000 r/min离心10 min,上清液旋蒸得到紫甘薯花色苷粗提浓缩物。
1.3.3 紫甘薯花色苷纯化工艺
(1)大孔树脂预处理。大孔树脂用无水乙醇浸泡24 h,用保鲜膜封好,去离子水冲洗抽滤一直到没有醇味,再用质量分数2%的氢氧化钠浸泡24 h,用去离子水冲洗至中性,最后用质量分数0.5%的盐酸溶液浸泡24 h,用去离子水冲洗抽滤至中性,将处理好的大孔树脂放在45℃的烘箱中烘干。
(2)花色苷粗提物纯化。在提取的花色苷粗提物中加入预处理好的AB-8型大孔树脂,用柠檬酸和磷酸氢二钠配制的pH值3的缓冲溶液溶解,用锡纸包裹,避光静置48 h后进行吸附。将吸附后的树脂进行湿法装柱,用去离子水冲洗柱子,洗去柱子中含有的多糖、蛋白质等物质,一直到洗至无色。再用体积分数70%的乙醇冲洗玻璃柱并收集洗脱液,直到洗脱液变成无色后结束动态脱附试验。用真空旋转蒸发仪,在40℃,转速100 r/min条件下旋蒸,除去乙醇和大部分的水,将纯化后的紫甘薯花色苷于4℃条件下避光保存。
1.3.4 紫甘薯花色苷相对组分测定
(1)最大吸收波长的确定。把紫甘薯花色苷提取液在紫外-可见分光光度计上进行200~800 nm波段的全波长扫描,并用体积分数95%乙醇(pH值1)作空白对照[13]。
(2)紫甘薯花色苷高效液相色谱分析。用去离子水将纯化后的紫甘薯花色苷的浓缩物溶解,进行高效液相色谱分析。色谱条件:AgilentZOBAXSBAQ型色谱柱(4.6 mm×250 mm×5μm),柱温30℃,UV/VisDetector 2489型,检测波长520 nm,进液量10μL。所用的洗脱液为0.5%甲酸-水(A) 和乙腈(B),流速1 mL/min,梯度洗脱。
洗脱梯度见表1。

表1 洗脱梯度
1.3.5 蒸汽爆破对紫甘薯花色苷抗氧化性影响
(1) DPPH自由基清除率的测定。参考朱璐等人[14]的方法并做适当修改:配制不同浓度的花色苷溶液,试管中加入2 mL不同浓度的花色苷样液和浓度0.1 mmol/L DPPH·乙醇溶液2 mL(现配现用),混匀后于常温下避光静置30 min,快速在波长517 nm处测定吸光度A1,用等体积无水乙醇代替DPPH乙醇溶液测定吸光度为A2,用等体积蒸馏水代替样液测定吸光度为A0。自由基清除能力计算公式如下:
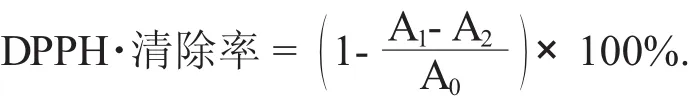
(2)·OH清除率的测定。参考Smironff N等人[15]报道的方法做适当修改:配制不同浓度的花色苷溶液,向试管中依次加入1 mL不同浓度的花色苷样液、10 mmol/LFeSO4溶液1 mL和10 mmol/L水杨酸乙醇溶液1 mL。加入8.8 mmol/L H2O2溶液1 mL启动反应,于37℃水浴条件下反应30 min,迅速在波长510 nm处测定吸光度A1,用无水乙醇代替水杨酸乙醇溶液测定吸光度A2,用体积分数40%乙醇代替样液测定吸光度A0。自由基清除能力计算公式如下:
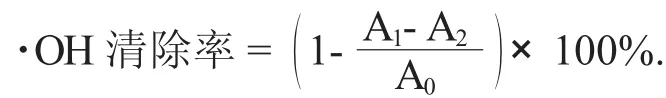
(3)还原力测定。参考Ak T等人[16]报道的方法并做适当修改,配置不同浓度的花色苷溶液,取2 mL样液分别加入质量分数1%铁氰化钾溶液2 mL,于50℃水浴锅中加热20 min,使其充分反应,流水迅速冷却并加入10%三氯乙酸溶液(W/V) 2 mL,混匀后离心,取2 mL混合液,加入蒸馏水1.6 mL及质量分数0.1%FeCl3溶液0.4 mL,混匀后静置30 min,于波长700 nm处测定吸光度Ai。
1.3.6 蒸汽爆破对紫甘薯花色苷抑菌特性影响
(1) 菌种活化和标准菌悬液制备。挑取1~2环供试菌种接入试管斜面培养基上,于37℃下培养16~24 h后,用无菌生理盐水洗下菌苔,制成菌悬液。采用麦氏比浊法,用无菌生理盐水调节细菌含量为1×108CFU/mL。
将复苏好的供试菌菌悬液按体积比1∶50接种于新鲜细菌液体培养基中,于37℃下,以转速220 r/min培养20 h后,于4℃下以转速8 000 r/min离心10 min,沉淀物用无菌生理盐水洗涤2次,每次10 mL,然后用无菌生理盐水调整菌悬液浓度为OD600=0.1(约0.5麦氏单位,5×108CFU/mL),得到标准菌悬液。
(2)牛津杯法抑菌试验。根据陈希文等人[17]报道的方法并稍作修改,将活化的供试菌种接种于已融化并降温至55℃左右的固体培养基中,接种量1%,混合均匀,倒入灭菌培养皿中,凝固后,用无菌镊子将牛津杯放培养皿中。然后将配好的紫甘薯花色苷加入牛津杯中,同时以甲醇作空白对照,加完后,于37℃下静置于恒温培养箱中24 h。
(3)紫甘薯花色苷最小抑菌质量浓度(MIC) 测定。二倍稀释法:参照贾培培[18]报道的方法稍作改动,取8支试管分别加入5 mL液体培养基(其中第1支试管加9.5 mL),加入0.5 mL样液于第1支试管中,混匀后取出5 mL并加入第2管中,然后依次取出5 mL移入下一管,到第8管时弃去5 mL,再在这7管中分别加入0.1 mL培养好的菌液。另取2支试管分别编号为9和10,其中第9号试管作为空白对照,只加5 mL液体培养基,不加药液;第10号试管作为空白对照,加5 mL液体培养基和溶剂甲醇。用二倍递减稀释法将紫甘薯花色苷配制成质量浓度分别为 2,1,0.5, 0.25,0.125,0.062 5,0.031 25,0.015 625 mg/mL的花色苷溶液,于37℃下恒温培养24 h,培养基中完全没有菌生长(透明) 的最低浓度作为提取物的MIC,对爆破后样品选取SEP-2进行试验。
2 结果与分析
2.1 紫甘薯花色苷相对组分测定
2.1.1 最大吸收波长测定
未爆破紫甘薯花色苷全波长扫描图见图1,蒸汽爆破后紫甘薯花色苷全波长扫描图见图2。
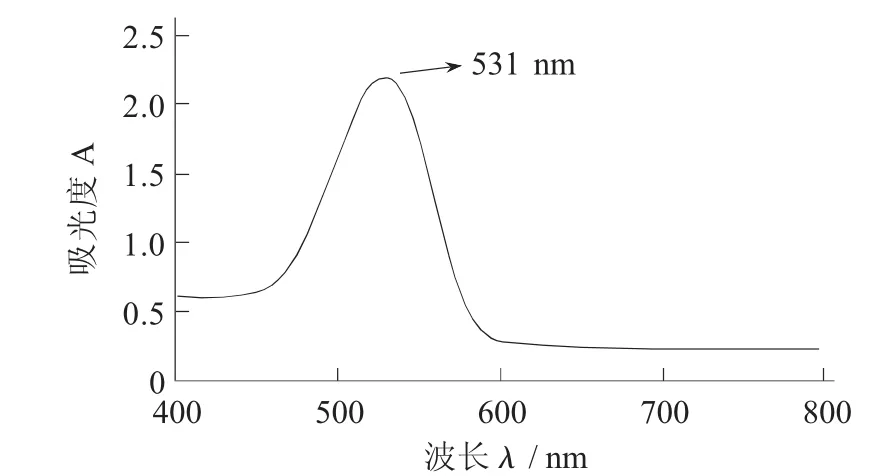
图1 未爆破紫甘薯花色苷全波长扫描图
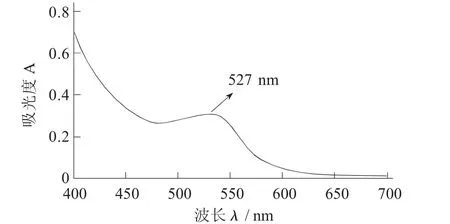
图2 蒸汽爆破后紫甘薯花色苷全波长扫描图
图1 和图2分别为未爆破处理和蒸汽爆破处理后的紫甘薯提取得到的花色苷溶液的全波长扫描图谱。爆破后的紫甘薯花色苷的最大吸收度为527 nm,而未爆破处理的紫甘薯花色苷的最大吸收度为531 nm。这2个值均属于花色苷的可见光区特征吸收峰的位置,因此,可以推断提取物为紫甘薯花色苷。而这2种花色苷溶液最大吸收度的差异,可能是蒸汽爆破导致花色苷结构微弱变化引起的。
2.1.2 紫甘薯花色苷高效液相色谱分析
未爆破、爆破后和样品花色苷的高效液相色谱图见图3,不同爆破条件下花色苷的高效液相色谱图见图4,未爆破和蒸汽爆破处理花色苷不同峰位置的相对面积见表2,不同蒸汽爆破条件下花色苷不同峰位的相对面积见表3。
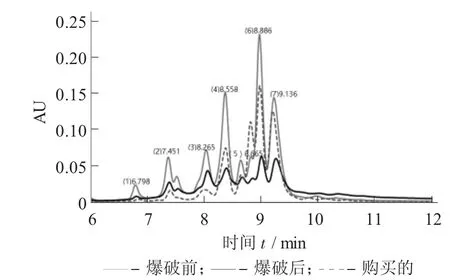
图3 未爆破、爆破后和样品花色苷的高效液相色谱图

图4 不同爆破条件下花色苷的高效液相色谱图
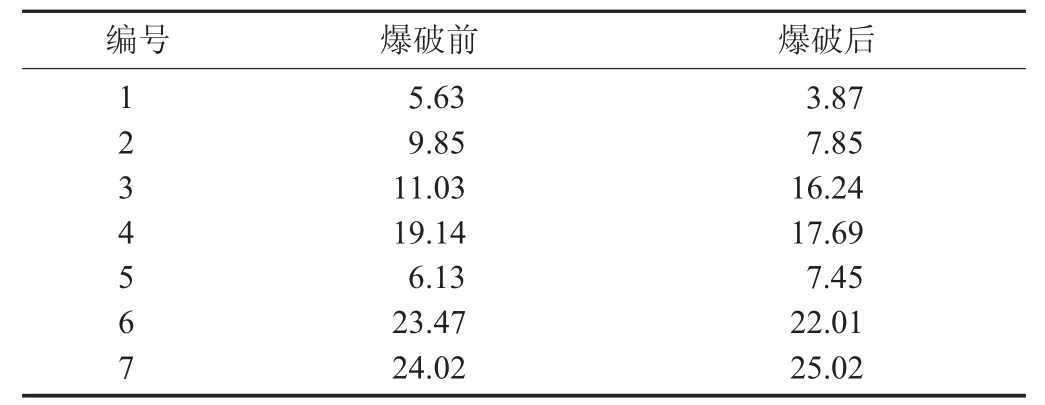
表2 未爆破和蒸汽爆破处理花色苷不同峰位置的相对面积/%
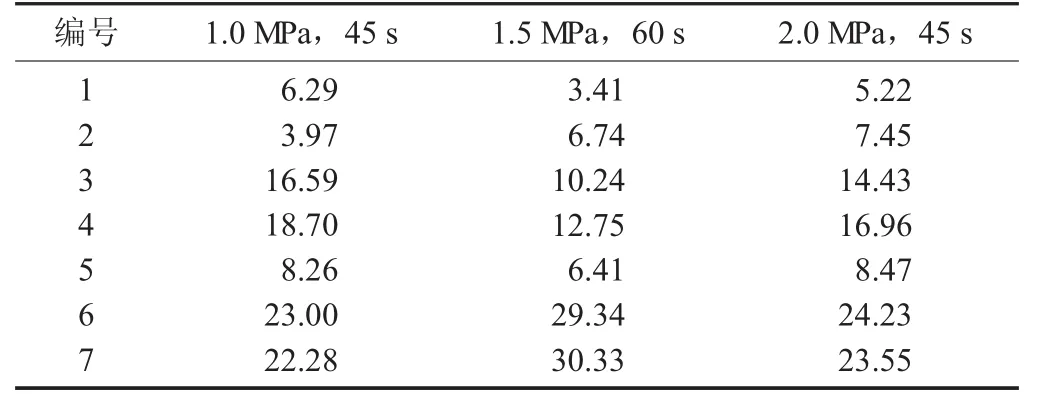
表3 不同蒸汽爆破条件下花色苷不同峰位的相对面积/%
由图3可以看出,提取得到的爆破前和爆破后的紫薯花色苷与购买的花色苷,色谱图上峰的个数、峰的位置和出峰的时间都几乎相同,说明溶剂提取法提取所得均为花色苷。但是各个峰的面积却不一样,由此可以说明各个花色苷的相对含量不一样。由表2可知,紫甘薯花色苷爆破前后在1,2,4,6处峰的相对百分含量有所减少,而3,5,7处峰的相对百分含量有所增加;峰相对含量的减少可能是蒸汽爆破下,1,2,4,6的花色苷结构发生了转变,转变为3,5,7这3种花色苷。由图4和表3可以看出,在爆破时如果维持相同的爆破时间,爆破压力越大,所对应花色苷的相对含量有所减少,说明在高爆破强度下花色苷可能分解;在维持爆破时间45 s时,1,3,4处峰的相对百分含量减少,2,5,6,7处峰的相对百分含量增加了,说明不同位置的花色苷由于蒸汽爆破发生了结构的转变。而且爆破强度越小、维压时间越短,所对应的花色苷的相对含量则越多。
2.2 蒸汽爆破预处理对紫甘薯花色苷抗氧化性的影响
2.2.1 蒸汽爆破处理对紫甘薯花色苷DPPH·清除率的影响
紫甘薯花色苷的抗氧化活性:DPPH·的清除作用见图5。
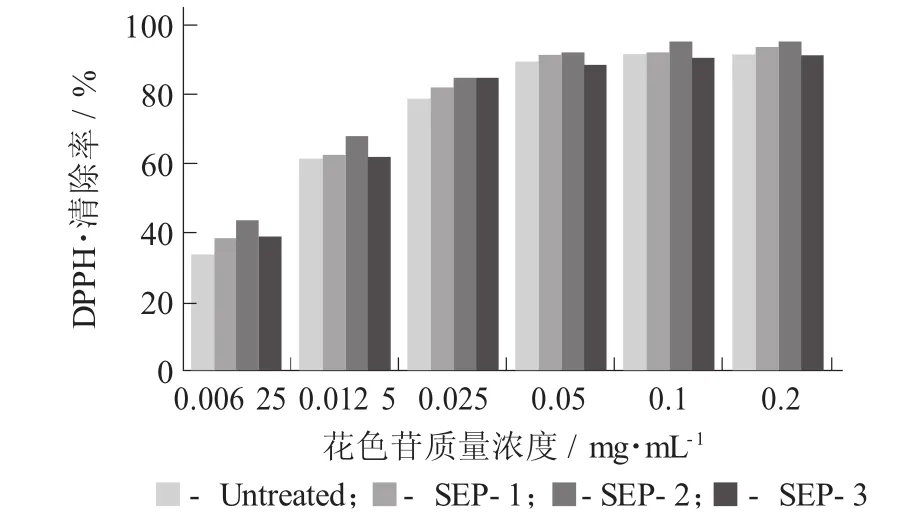
图5 紫甘薯花色苷的抗氧化活性:DPPH·的清除作用
DPPH乙醇溶液在517 nm处有最大吸收峰,抗氧化剂的加入能够使DPPH·消失,颜色变浅,因此常用分光光度计进行定量分析。由图5可知,紫甘薯花色苷拥有较强的DPPH·清除能力,当质量浓度达到0.2 mg/mL时,Untreated,SEP-1,SEP-2,SEP-3清除率分别为91.75%,93.14%,95.74%,91.37%。由图5可知,蒸汽爆破预处理后,对于紫甘薯花色苷DPPH·清除能力有一定的提高,其中SEP-2比未处理样品清除率提高了约4%,蒸汽爆破预处理后紫甘薯花色苷抗氧化性提高推测原因如下:一方面由于花色苷组分相对含量发生变化;另一方面蒸汽爆破会导致一些糖苷键的断裂,使得花色苷分子结构中的活性基团(酚羟基)暴露出来,从而使抗氧化性增强。
2.2.2 蒸汽爆破处理对紫甘薯花色苷·OH清除率的影响
紫甘薯花色苷的抗氧化活性:·OH的清除作用见图6。
有关研究表明,·OH与大多数的肿瘤、癌症及衰老有关,而紫甘薯花色苷能够提供氢离子,可以把机体内有害自由基还原成稳定的化合物。由图6可知,当紫甘薯花色苷质量浓度为0.006 25~0.05 mg/mL时,其羟自由基清除能力与质量浓度成正相关,当质量浓度超过0.1 mg/mL时,质量浓度对羟自由基清除能力影响不大。未蒸汽爆破处理提取的紫甘薯花色苷清除率最高可达82.74%,蒸汽爆破处理后SEP-2质量浓度为0.2 mg/mL时,·OH清除率达到85.37%。
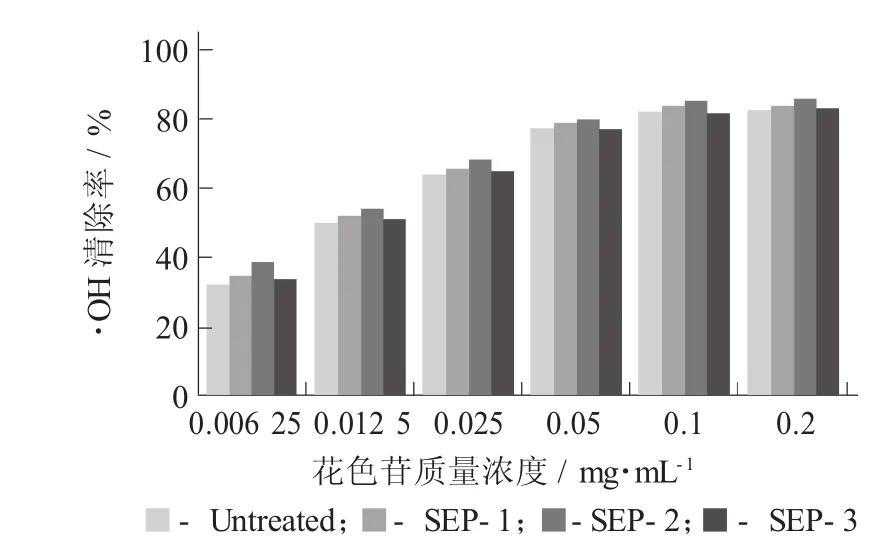
图6 紫甘薯花色苷的抗氧化活性:·OH的清除作用
2.2.3 蒸汽爆破处理对紫甘薯花色苷还原力的影响
紫甘薯花色苷的抗氧化活性:还原力见图7。
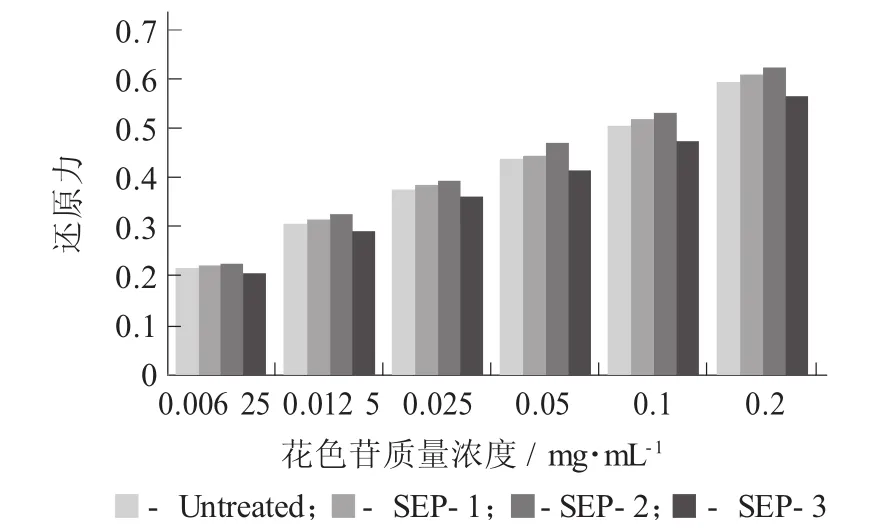
图7 紫甘薯花色苷的抗氧化活性:还原力
研究表明,铁氰化钾测定抗氧化性,吸光度越大,物质的抗氧化能力越强。由图7可知,紫甘薯花色苷具有一定的铁离子还原力,蒸汽爆破处理后,SEP-3样品在相同质量浓度情况下还原力均低于未经蒸汽爆破处理的样品,但SEP-1及SEP-2铁离子还原力要稍强于未经蒸汽爆破处理的样品。
2.3 蒸汽爆破处理对紫甘薯花色苷抑菌特性的影响
2.3.1 紫甘薯花色苷抑菌活性
紫甘薯花色苷对菌种抑菌活性见表4。
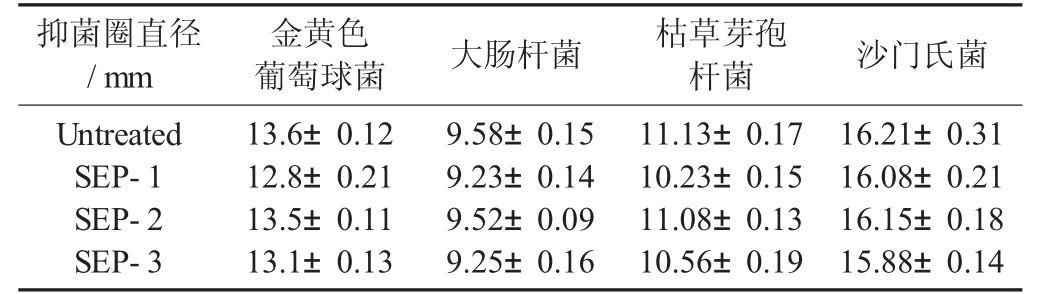
表4 紫甘薯花色苷对菌种抑菌活性
由表4可知,紫甘薯多色苷对于金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌均具有较强的抑制作用,但蒸汽爆破处理后,紫甘薯花色苷对于各菌种的抑菌圈直径均有不同程度的降低,推测其原因为,在蒸汽爆破过程中,高温使花色苷的抑菌性降低,但由于蒸汽爆破过程时间十分短暂,因此影响不大。
2.3.2 紫甘薯花色苷最小抑菌浓度(MIC)测定
未处理紫甘薯花色苷最小抑菌质量浓度(MIC)的测定结果见表5,蒸汽爆破预处理紫甘薯花色苷最小抑菌质量浓度(MIC)的测定结果见表6。
由表5和表6可知,紫甘薯多色苷对于金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌最小抑菌质量浓度(MIC) 分别为0.125,0.25,0.25,0.062 5 mg/mL,蒸汽爆破预处理对紫甘薯花色苷的最小抑菌质量浓度无显著影响。
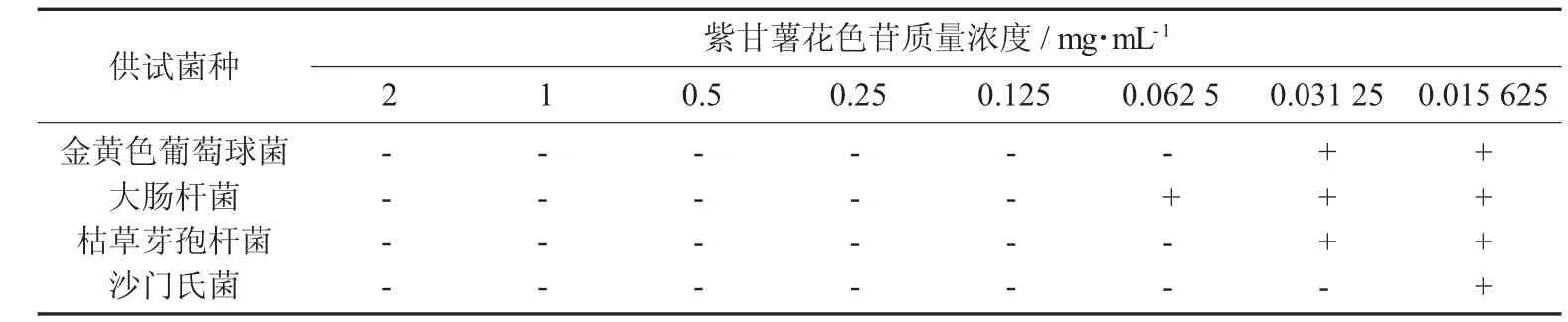
表5 未处理紫甘薯花色苷最小抑菌质量浓度(MIC)的测定结果
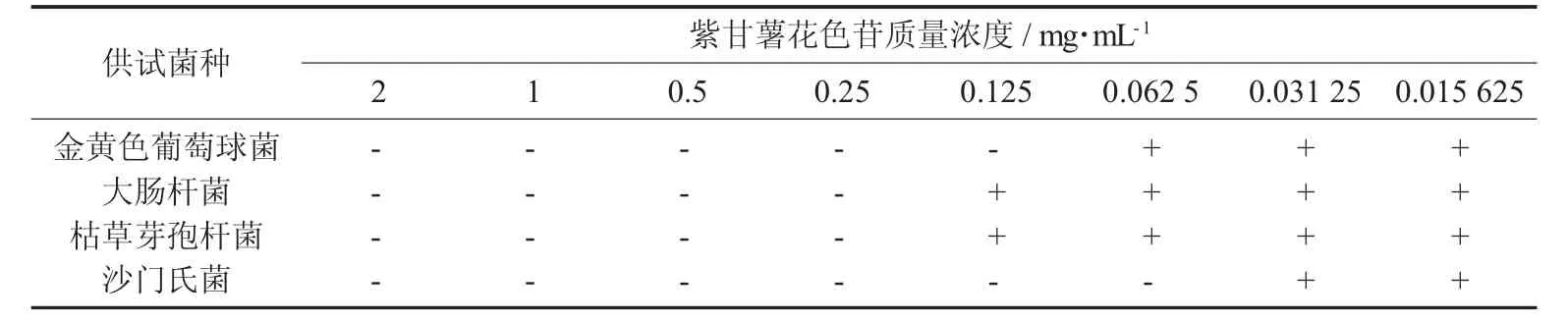
表6 蒸汽爆破预处理紫甘薯花色苷最小抑菌质量浓度(MIC)的测定结果
3 结论
将紫甘薯进行蒸汽爆破预处理,采用溶剂提取法制备紫甘薯花色苷并采用大孔树脂进行纯化,全波长扫描结果表明,蒸汽爆破处理后紫甘薯花色苷的最大吸收波长由531 nm变为527 nm。高效液相色谱检测结果表明,对爆破和未爆破处理的紫甘薯提取所得的均为花色苷,但各组分的相对含量不同。紫甘薯花色苷的体外抗氧化试验结果表明,一定范围内花色苷的抗氧化性与质量浓度呈正比。蒸汽爆破预处理后,紫甘薯花色苷的DPPH自由基清除能力和羟自由基清除能力有一定的提升,而还原力基本不变。采用牛津杯法检测紫甘薯花色苷的抑菌性,结果表明紫甘薯花色苷对于金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌均具有较强的抑制作用,其最小抑菌质量浓度(MIC) 分别为0.125,0.25,0.25,0.062 5 mg/mL。试验对未处理及蒸汽爆破预处理的紫甘薯花色苷进行组分测定,并对其抗氧化性及抑菌特性进行研究,结果表明,蒸汽爆破预处理并未破坏花色苷结构,在维持原有抑菌性的基础上在一定程度上提高了花色苷的抗氧化能力,这对今后紫甘薯综合资源的开发利用提供一定的理论依据。

