血管内皮生长因子受体亚型在卵巢过度刺激大鼠腹膜的表达
袁弘玉,李 权
(1. 遵义医科大学 研究生院,贵州 遵义 563099;2.遵义医科大学附属医院 妇产科, 贵州 遵义 563099)
卵巢过度刺激综合征(Ovarian hyperstimulation syndrome,OHSS)是指在辅助生殖技术过程中由于应用促排卵药物使多个卵泡同时发育引起的严重并发症,其主要的临床表现有双侧卵巢增大、腹腔积液、胸腔积液、血液浓缩肝肾功能障碍、血栓形成甚至危及患者生命等[1-2]。在体外受精胚胎移植(In vitro fertilization,IVF)周期中总发生率12%~25%,重度占0.5%~5%[3],都可能给患者带来严重影响。OHSS的发病机制至今尚未完全清楚,目前研究认为该病是在人绒毛膜促性腺激素刺激下,卵巢释放过多血管活性物质,如肾素-血管紧张素、前列腺素、组胺、细胞因子类、血管内皮生长因子(Vascular endothelial growth factor,VEGF)等引起毛细血管通透性增加所致[4]。进一步研究认为VEGF是导致毛细血管通透性增加的主要因素[5]。目前应用抑制VEGF表达的药物,仍不能完全预防该病的发生,VEGF需与其具体的受体亚型结合方可发挥作用[6],其有3种不同基因编码的VEGF受体亚型:VEGFR-1(Flt-1)、VEGFR-2(Flk-1;KDR)和VEGFR-3(Flt-4)。但目前对VEGF受体亚型在该病中的研究却鲜有报道。
本研究通过建立OHSS大鼠模型,检测模型大鼠腹膜中血管内皮生长因子受体亚型基因和蛋白表达,以期为该病腹腔积液形成的病理生理机制研究提供一定的理论依据。
1 材料与方法
1.1 实验动物及分组 20只清洁级雌性Wistar 大鼠,22日龄,体重55.0~65.0g,购于北京维通利华实验动物有限公司,许可证号SCXK(京)2016-0006。于无特定病原体(Specific pathogen Free,SPF)动物室饲养,自由饮水,通风良好,昼夜正常变化,室温21~24℃,湿度50%~70%。按照随机数字表法将大鼠分为正常对照组(NC组)和实验组(OHSS模型组 )。
1.2 主要试剂与仪器 重组人卵泡刺激素(r-hFSH,艾美捷科技有限公司);人绒毛膜促性腺激素(hCG;丽珠制药厂);亚甲蓝(Methylene blue,MB,江苏济川制药);Trizol(invitrogen公司,Cat. No. 15596026);RIPA裂解液(Proteintech公司,美国);qRT-PCR检测试剂盒(TaKaRa公司);VEGFR1一抗(批号:13687-1-AP)、VEGFR2一抗(批号:26415-1-AP)和VEGFR3一抗(批号:20712-1-AP)和内参β-Tubulin(批号:10094-1-AP)购于美国Proteintech公司;兔二抗购于天津索罗门生物公司。ECL(Perkin Elmer,NEL100001EA);光学显微镜(奥林巴斯,日本);721分光光度计(UV-4802型,UNICO公司);高速离心机(5424R,Eppendorf公司);PCR扩增仪(BIOER公司,浙江杭州);凝胶成像系统(BIO-RAD公司,美国);电泳仪(DYY-50型,北京六一仪器厂)等。
1.3 造模方法及取材 按照参考文献造模方法[7],对照组(n = 10)从第22日龄开始连续5d皮下注射0.1mL生理盐水;OHSS组(n = 10)从第22日龄开始连续4d皮下注射10IU的r-hFSH,第5天皮下注射30 IU人绒毛促性腺激素(hCG)诱导OHSS。在hCG注射后48h卵巢显著增大,表面紫褐色,有多个卵泡形成,出现腹水表明模型建立成功。测量大鼠造模前后体重变化、腹膜血管通透性,随后进行双侧卵巢切除和分离腹膜,测量卵巢体积,拍照,取双侧卵巢组织及一部分腹膜组织置于4%多聚甲醛溶液中固定,用于卵巢组织HE染色和腹膜免疫组织化学检测;另一部分腹膜组织置于液氮储存待检。
1.4 检测项目
1.4.1 观察腹水形成和测定腹腔液亚甲蓝含量 第28日龄两组大鼠均肌肉注射盐酸氯胺酮(0.1 mg/kg)麻醉大鼠。并通过尾静脉注射1%的亚甲蓝0.1 mL。注射后充分按摩腹部。30min后,按颈椎脱臼法处死大鼠。正中切开腹腔,观察有无腹水, 用5 mL生理盐水冲洗腹腔。将冲洗液收集到试管中,稀释至10 mL, 加0.1 mol/L氢氧化钠0.05 mL过滤,并以3 000 rpm的速度在室温下离心10 min。然后用分光光度计在波长590 nm测定OD值,根据OD 值绘制标准曲线,算出腹腔冲洗液MB含量。
1.4.2 大鼠造模前后体重测量 电子天平称重并记录其重量。
1.4.3 卵巢体积的测定 取下双侧卵巢用游标卡尺测卵巢各径线,算出体积并记录。
1.4.4 卵巢组织形态观察 肉眼及HE染色显微镜观察各组大鼠卵泡数及卵巢组织形态学变化。
1.4.5 免疫组织化学检测腹膜VEGFR1、VEGFR2和VEGFR3蛋白水平 两组腹膜标本流水冲洗, 4%多聚甲醛固定、梯度乙醇脱水,石蜡包埋,切片(厚度4μm)。然后进行脱蜡,水化,PBS清洗3次。组织切片用3%过氧化氢溶液阻断内源性过氧化物酶活性。抗原煮沸热修复,滴加PBS稀释10%山羊血清封闭。一抗孵育过夜:分别滴加VEGFR1、VEGFR2、VEGFR3 的一抗(1∶200)。PBS 清洗3次。 二抗孵育,SABC 孵育,DAB 显色,苏木素复染,透明,封片。显微镜观察,阳性着色呈棕黄色,Image pro plus 6.0软件进行平均光密度值半定量分析。
1.4.6 qRT-PCR检测腹膜VEGFR1、VEGFR2和VEGFR3 mRNA表达水平 用Trizol提取腹膜组织的总RNA。紫外分光光度法测定 RNA 在 260nm 和 280nm 的吸光度,计算 RNA 含量并确定其完整性。Primer Premier 5.0软件设计上下游引物(引物设计和合成由天津瑞吉因生物有限公司完成),引物序列见表1。取5μg RNA运用MMLV逆转录酶(Promega公司,Cat No: 9PIM170)及相关试剂进行逆转录反应,反应体系为20μL。取0.5 μL反转录产物运用SYBR® Premix Ex TaqTM (TaKaRa公司)进行实时定量PCR反应。反应体系如下:SYBR Green Mix (2x) 10 μL,ROX Reference Dye II 0.4μL,Primer 1 (5 pmol/μL) 1μL,Primer 2 (5 pmol/μL) 1μL, RT产物 0.5 μL, dd H2O 7.1 μL。PCR反应条件:94℃,4 min,(94℃,30 s;50℃,30 s)×40;95℃,15 s;60℃,30 s;95℃,15 s。以β-actin为内参,按2-ΔΔCT法计算待测目的基因相对表达量。
表1引物序列
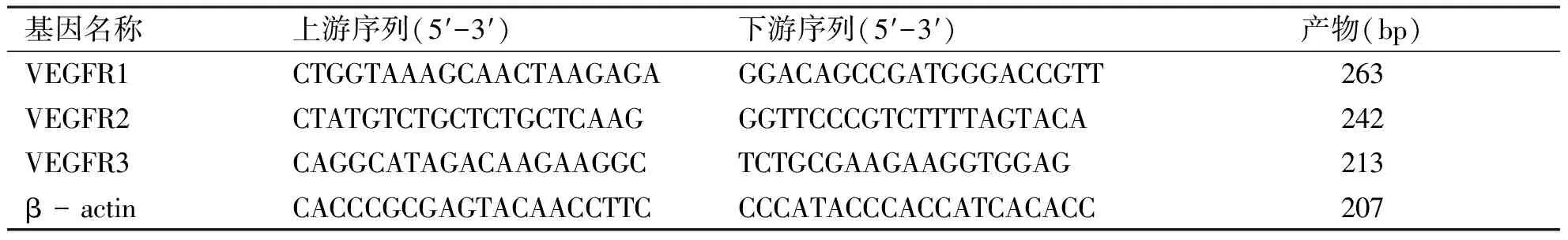
基因名称上游序列(5′-3′)下游序列(5′-3′)产物(bp)VEGFR1CTGGTAAAGCAACTAAGAGAGGACAGCCGATGGGACCGTT263VEGFR2CTATGTCTGCTCTGCTCAAGGGTTCCCGTCTTTTAGTACA242VEGFR3CAGGCATAGACAAGAAGGCTCTGCGAAGAAGGTGGAG213β - actinCACCCGCGAGTACAACCTTCCCCATACCCACCATCACACC207
1.4.7 Western blot 检测腹膜VEGFR1、VEGFR2和VEGFR3蛋白水平 称取腹膜组织,按照每1g组织加4mL RIPA裂解液,匀浆器研磨组织,以12 000 r/min离心提取蛋白, BCA法测定蛋白浓度,-80℃保存。SDS-PAGE凝胶电泳分离蛋白,转膜,封闭,VEGFR1特异性抗体按1∶1 000比例稀释于封闭液中孵育。洗膜后将辣根过氧化物酶偶联的二抗按1∶10 000的比例稀释进行孵育,洗膜后用ECL检测,显影。同法检测VEGFR2和VEGFR3。以β-Tubulin为内参。用凝胶成像系统拍照,图片经labworks 4.0扫描图像进行统计学分析。
2 结果
2.1 两组大鼠卵巢形态学观察 肉眼观察正常对照组大鼠卵巢形态正常,表明淡红;OHSS组大鼠卵巢体积明显增大,表面紫褐色,充血、肿胀明显;显微镜下正常对照组卵巢可见各个发育阶段的卵泡,间质细胞分布均匀,未见增生。OHSS组大鼠卵巢可见部分发育期卵泡数增多,见多发性卵泡囊肿及黄体囊肿,黄素化明显,间质水肿,卵泡呈多囊性扩张(见图1~2)。

图1 两组大鼠卵巢形态学改变(肉眼观察)
2.2 两组大鼠体重、卵巢体积、卵泡数和腹腔液MB含量比较 两组大鼠体重比较差异无统计学意义。对照组大鼠无腹腔积液形成,OHSS组大鼠形成明显腹腔积液;OHSS组大鼠卵巢体积、卵泡数量及腹腔液MB含量明显高于正常对照组(P<0.05,见表2)。

A:对照组;B:实验组;×200。图2 两组大鼠卵巢形态学改变


组 别28日龄大鼠体重(g)卵巢体积(mm3)卵泡数腹腔液MB含量(μg/mL)对照107.71±4.7922.10±4.495.00±1.000.05±0.03实验105.08±3.1483.13±6.92∗15.80±2.17∗0.31±0.08∗
*:与对照组相比,P<0.05。
2.3 两组腹膜VEGFR1,VEGFR2和VEGFR3免疫组织化学染色比较 与对照组比较,VEGFR1在实验组表达呈阳性,VEGFR2在实验组表达呈强阳性,VEGFR3在实验组和对照组均有表达(见图3)。半定量分析显示实验组VEGFR1和VEGFR2的平均光密度值与对照组相比差异具有统计学意义(P<0.05),VEGFR3的平均光密度值与对照组相比差异无统计学意义(见表3)。
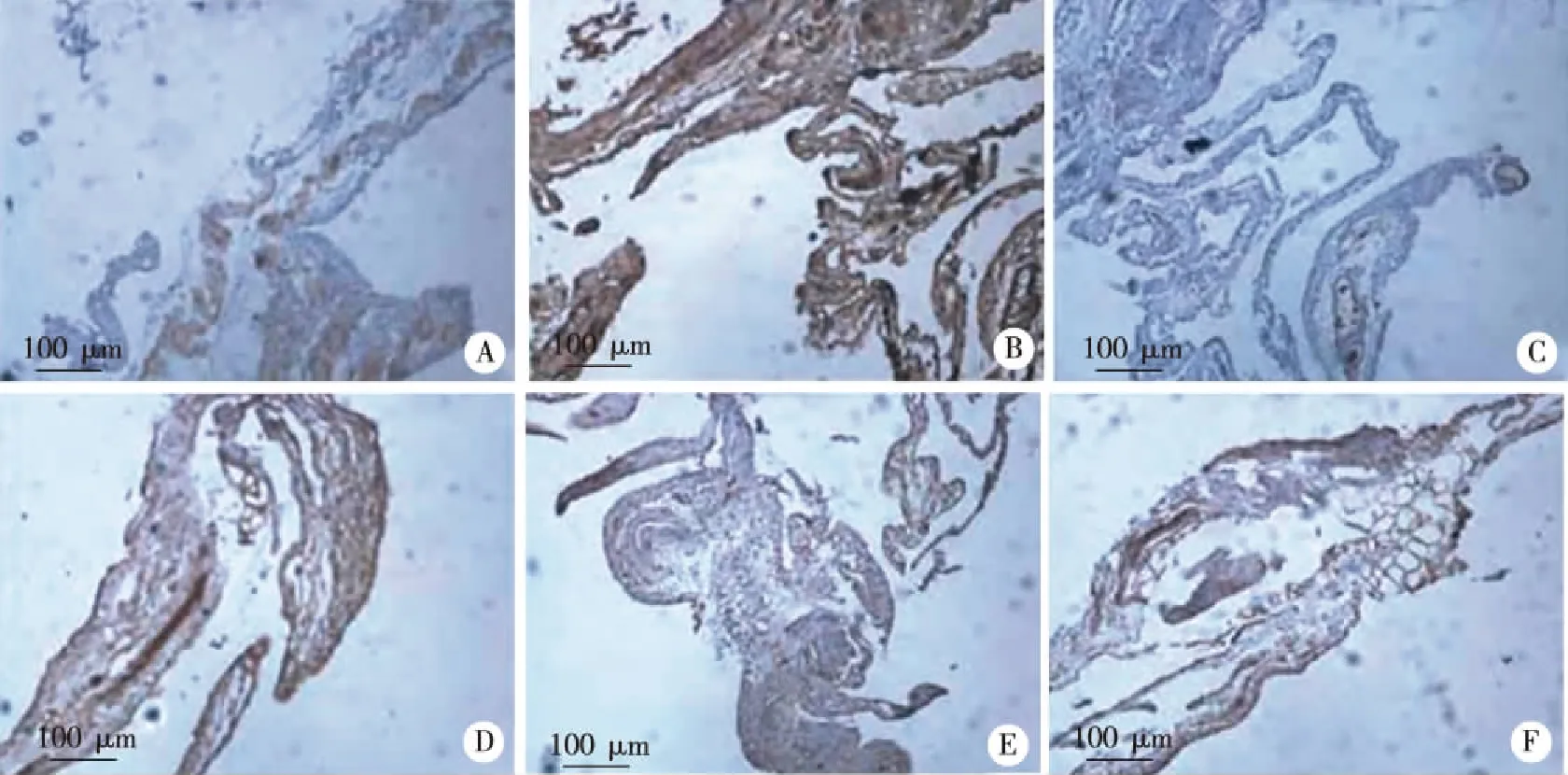
A:对照组VEGFR1;B:实验组VEGFR1;C:对照组VEGFR2;D:实验组VEGFR2;E:对照组VEGFR3;F:实验组VEGFR3;×100。图3 免疫组化检测两组大鼠腹膜VEGFR1、VEGFR2和VEGFR3的表达
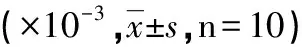

组别VEGFR1VEGFR2VEGFR3对照133.04±16.0669.01±7.24109.20±27.58实验244.60±28.50∗130.20±16.69∗141.60±60.85
*:与对照组相比,P<0.05。
2.4 血管内皮生长因子受体亚型(VEGFR1、VEGFR2和VEGFR3)mRNA表达水平的比较 实验组大鼠腹膜VEGFR1、VEGFR2 mRNA的相对表达水平较对照组相比差异具有统计学意义(P<0.05,P<0.01),VEGFR3 mRNA的相对表达水平在两组间比较差异无统计学意义(P>0.05,见图4)。
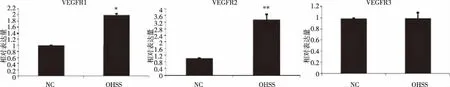
NC:对照组 ;OHSS :实验组;*:P<0.05,**:P<0.01。图4 荧光定量检测PCR VEGFR1、VEGFR2、VEGFR3 mRNA相对表达量
2.5 血管内皮生长因子受体亚型(VEGFR1、VEGFR2和VEGFR3)蛋白表达水平的比较 实验组大鼠腹膜VEGFR1和VEGFR2蛋白的相对表达水平较对照组相比差异具有统计学意义(P<0.05,P<0.01),VEGFR3 蛋白的相对表达水平在两组间比较无明显统计学差异(P>0.05,见图5)。

*:P<0.05,**:P<0.01。图5 VEGF受体亚型的代表性蛋白免疫印迹(左)和光密度相对定量(右)
3 讨论
卵巢过度刺激综合征具体发病机制至今尚未完全阐明。该病主要的病理生理改变是毛细血管通透性明显增加[3]。研究认为血管通透性增加主要与血管内皮细胞的完整性破坏,细胞之间紧密连接和粘附连接打开以及血管内皮细胞的回缩等有关[8]。VEGF是调节以上因素引起血管通透性增加的主要因子[1,9],VEGF家族成员包括VEGF(A、B、C、D、E)和胎盘生长因子(PLGF),卵巢分泌的VEGF主要是VEGF-A[10],其常作用于腹膜、胸膜等血管床,能迅速增加血管通透性[11]。VEGF-A主要通过结合 VEGFR1(Flt-1)和 VEGFR2( Flk-1 / KDR)发挥分子生物学效应, VEGFR1与VEGF-A结合对血管通透性的调节主要起负向作用,而当VEGFA与VEGFR2募集TSAd接头蛋白复合物结合,可调节VEGFA诱导的酪氨酸激酶Src活化和血管通透性,激活Src也调节粘着斑激酶介导的细胞基质附着力,有助于增强渗透效应[12]。VEGFR3与VEGF-C/D 结合主要调节淋巴管的生成和发育[13]。
本研究参照课题组前期制模方案成功建立OHSS大鼠模型。腹膜免疫组织化学结果显示OHSS大鼠腹膜存在VEGFR1、VEGFR2及VEGFR3蛋白的表达,前两者平均光密度值在实验组增加,与对照组比较差异具有统计学意义,表明腹膜VEGFR1,VEGFR2可能与OHSS的发病机制有关。荧光定量PCR和Western blot结果显示实验组大鼠腹膜VEGFR1 mRNA及蛋白的相对表达水平上调,VEGFR2 mRNA及蛋白的相对表达水平明显上调,提示可能卵巢分泌过多VEGF-A与腹膜局部高表达的VEGFR1和VEGFR2结合进而影响血管通透性。本实验VEGFR1在实验组大鼠腹膜高表达,与Shibuya等[14]研究认为VEGFR1有较高的亲和力有相似之处。但Koch等研究认为VEGFR1激酶活性很低,其对血管通透性主要起负向调节作用[15]。在我们研究中尚未完全体现,还需进一步研究。Gomez等研究认为OHSS卵巢组织高表达VEGF-A主要与其VEGFR2结合增加血管通透性,并已证实卵巢VEGFR2的存在[16]。Brien等研究认为VEGFR2在OHSS的发生中起到了关键作用[17]。本研究也证实腹膜组织VEGFR2 mRNA及蛋白的相对表达水平较对照组显著上调,与以上结果相符合。VEGFR2引起血管通透性增加的可能机制为OHSS大鼠卵巢分泌的VEGF-A与腹膜高表达的VEGFR2结合将引起c-Src通路的激活导致VE-钙粘蛋白过度磷酸化,进而介导TSAd衔接蛋白依赖性SRC酪氨酸激酶活化,导致受体内化,内皮细胞间连接的松散和血管通透性增强引起血管内液体的外渗[12,18]。故我们推测腹膜VEGFR1,VEGFR2与卵巢过度刺激大鼠血管通透性增加所致腹腔积液形成有关,VEGFR2可能起主要作用。
本研究的不足在于对VEGFR1血管通透性的负向调节作用未能证实,可能其与VEGFR2介导的信号通路存在差异,这将是我们以后研究的方向,若能找到VEGFR1和VEGFR2之间调节血管通透性的平衡点,将为OHSS局部靶向治疗提供新的思路。

