MiR-29a及其靶向基因在宫颈癌中的表达和临床意义
徐启英,郭桂兰
宫颈癌是最常见的妇科恶性肿瘤,其发病率呈逐年升高的趋势。全世界每年约有新发病例50万[1]。MicroRNA(miRNA)是一类内源性的非编码RNA,它们经过一系列的加工后可以形成大小约20~22 bp的单链小分子RNA,通过识别miRNA的3′UTR可以靶向诱导相应的miRNA降解或抑制其翻译[2],从而影响蛋白质的表达,Tong和Nemunaitis[3]认为机体内具有癌基因活性的miRNA和具有抑癌基因活性的miRNA是保持动态平衡状态的,一旦这种平衡被打破,细胞就会向恶性转化。因此,miRNA成为深入研究恶性肿瘤发生发展,诊断治疗的新靶点。MicroRNA-29a(miR-29a)目前是miRNAs系列中研究热点的成员之一,研究已证实,miRNA-29a在很多不同类型的肿瘤中如前列腺癌、肾细胞癌、胃癌和胰腺癌不表达或者低表达,但miRNA-29a在宫颈癌中的作用尚不清楚。本研究旨在检测miRNA-29a在宫颈鳞癌组织和细胞中的表达水平,并探讨miRNA-29a的靶向基因DNA甲基转移酶3A(DNA-methyltransferase 3 A,DNMT3A)基因、DNMT3B基因在宫颈癌组织和宫颈癌细胞中的表达水平,为进一步研究宫颈癌的发病机制和寻找肿瘤标志物及开发治疗方法提供初步理论依据。
1 材料与方法
1.1 材料
1.1.1 临床样本 收集青海大学附属医院妇科2015年6月—2017年6月收治的20例宫颈鳞癌患者的癌组织及癌旁组织,所有标本的临床分期均根据国际妇产科联盟(1995),其中Ⅰb期12例,Ⅱa期8例,均为鳞癌。患者术前均签署知情同意书,研究方案经本院伦理委员会批准。
1.1.2 实验细胞、主要试剂和仪器 人宫颈癌细胞系Hela和人正常宫颈细胞株ECT-1(购自中国科学院上海细胞库,由青海大学高原医学研究中心保存);miR-29a模拟物(miR-29a mimic)、无关序列阴性对照(microRNA negative control,miR-NC)片段及靶向基因DNMT3A、DNMT3B的引物片段(购自上海吉玛生物公司),mRNA提取试剂(日本TaKaRa公司),实时荧光定量PCR(real time quantitative PCR,qRT-PCR)试剂(德国DBI公司),焦碳酸二乙酯(美国Sigma公司),RNasin(美国Promega公司),逆转录试剂盒(德国DBI公司),标准胎牛血清(英国Gibico公司),RPMI1640培养液(美国HyClone公司),分光光度计(型号:UV-1206,日本岛津公司),PCR扩增仪(型号:ABI9700,美国ABI公司),qRT-PCR仪(型号:Stratagene Mx3000P,美国Agilent公司),DNMT3A、DNMT3B酶联免疫吸附测定试剂盒(美国Epigentek公司),酶标仪(美国Thermo Fisher公司)。
1.2 方法
1.2.1 qRT-PCR法检测组织和细胞中miR-29a的表达 Trizol法提取组织或细胞总RNA,检测浓度与质量,光密度(optical density,OD)值在1.8~2.2间方可使用。按照BestarTMqRT-PCR RT Kit以及DBI Bestar®SybrGreen qRT-PCR masterMix进行反转录和PCR。用Agilent Stratagene qRT-PCR仪Mx3000P进行qRT-PCR实验。实验按照2-△△Ct方法处理数据。其中,△Ct=(目的基因Ct-内参Ct)的平均值±标准偏差;△△Ct=(待测样品中目的基因△Ct-参照样品中目的基因△Ct)的平均值±标准偏差(若无参照样品则选择Ct最大的样品为参照进行计算)。MiR-29a引物由日本TaKaRa公司设计合成,序列为:5′-TAGCACCATCTGAAATCGGTTA-3′。以U6作为内参,其特异性引物序列为:5′-CTCAACTGGTGTCGTGGA-3′。重复3次。
1.2.2 ELISA法检测细胞中DNMT3A、DNMT3B的表达 按照DNMT3A、DNMT3B酶联免疫吸附测定试剂盒操作方法进行操作,分别设空白孔、标准孔、待测样品孔,用酶标仪在450 nm波长测量各孔的OD值,以标准物的浓度为横坐标,OD值为纵坐标,绘出标准曲线图,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品的浓度,再乘以稀释倍数,即为样品的实际浓度。
1.2.3 Western Blot法检测组织中DNMT3A、DNMT3B表达 将组织用RIPA裂解液进行裂解,裂解的蛋白需要BCA进行定量,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(恒流35 mA、1 h)。经凝胶电泳分离后,将蛋白半干转至聚偏二氟乙烯膜上(20 V,1 h),用含5%脱脂奶粉的TBS进行封闭。一抗(兔抗人DNMT3A、兔抗人DNMT3B)室温孵育2 h,TBST洗膜3×5 min;二抗(羊抗兔HRP)室温孵育1 h,TBST洗膜3×5 min,ECL显影。使用Image J软件测定条带灰度值。
1.2.4 Western Blot法检测细胞中DNMT3A、DNMT3B表达 宫颈癌细胞系Hela和人正常宫颈细胞株ECT-1细胞生长于RPMI1640培养液,置于37 ℃、100%饱和湿度、5%浓度的CO2培养箱中培养。细胞呈单层贴壁生长,细胞融合度达到80%~90%时进行常规传代。将Hela细胞以3×104/孔接种于24孔板中,实验分为3组:Hela细胞空白(control)组、miR-29a模拟物(miR-29a mimic)组、无关序列阴性对照(microRNA negative control,miR-NC)组。根据Lipo3000(美国ThermoFisher公司)的说明书进行细胞转染操作。转染48 h后,收集细胞并用60 μL 1×SDS buffer裂解。以下的操作同1.2.3。

2 结果
2.1 MiR-29a在宫颈鳞癌组织和癌旁组织中的表达 2%琼脂糖凝胶电泳显示PCR产物为单一条带,表明qRT-PCR可特异扩增miR-29a片段。MiR-29a在宫颈鳞癌组织中的相对表达量(2-△△Ct)为0.39±0.21,低于癌旁组织1.10±0.49,差异比较具有统计学意义(P<0.01,图1)。
2.2 宫颈鳞癌组织中miR-29a的表达和临床分期的关系 不同临床分期的宫颈鳞癌组织中miR-29a的表达有差异,Ⅱa期宫颈鳞癌组织中miR-29a的相对表达量为0.23±0.07,低于Ⅰb期0.50±0.20,差异比较具有统计学意义(P<0.01,图2)。
2.3 MiR-29a在人宫颈癌细胞系Hela和正常宫颈细胞系ECT-1中的表达 经qRT-PCR检测miR-29a在人宫颈癌细胞系Hela中的相对表达量为0.37±0.19,低于在正常宫颈细胞系ECT-1中的相对表达量1.16±0.82,差异比较具有统计学意义(P<0.01,图3)。

图1 宫颈鳞癌组织和癌旁组织中miR-29a的相对表达量图2 不同临床分期宫颈鳞癌组织中miR-29a的相对表达量图3 宫颈癌细胞和正常宫颈细胞中miR-29a的相对表达量
2.4 DNMT3A、DNMT3B在组织中的表达和与临床分期的关系 经Western Blot检测宫颈鳞癌组织中DNMT3A的相对表达量为1,癌旁组织中的相对表达量为0.28±0.09;Ⅱa期宫颈癌组织中DNMT3A的相对表达量为1.17±0.17,高于Ⅰb期的0.88±0.12;Ⅱa期宫颈鳞癌癌旁组织中DNMT3A的相对表达量为0.38±0.11,高于Ⅰb期的0.21±0.06,差异比较具有统计学意义(P<0.01)。宫颈鳞癌组织DNMT3B的相对表达量为1,癌旁组织中的相对表达量为0.14±0.04,Ⅱa期宫颈鳞癌组织中DNMT3B的相对表达量为1.29±0.21,高于Ⅰb期的0.80±0.14;Ⅱa期宫颈鳞癌癌旁组织中DNMT3B的相对表达量为0.18±0.03,高于Ⅰb期的0.11±0.02,差异比较具有统计学意义(P<0.01)。图4。
2.5 DNMT3A、DNMT3B在人宫颈癌细胞系Hela中mRNA的表达 Hela细胞株过表达miR-29a后,qRT-PCR检测Hela细胞不同转染组中的DNMT3A,DNMT3B的mRNA表达水平,结果表明miR-29a模拟物(miR-29a mimic)组DNMT3A mRNA(0.41±0.11),DNMT3B mRNA(0.26±0.08)的相对表达量远低于Hela细胞空白(control)组和无关序列阴性对照(miR-NC)组,差异比较具有统计学意义(P<0.05,图5)。

注:与癌旁组织比较,**P<0.01;与Ⅱa期比较,*P<0.01图4 宫颈鳞癌和癌旁组织中DNMT3A、DNMT3B的相对表达量
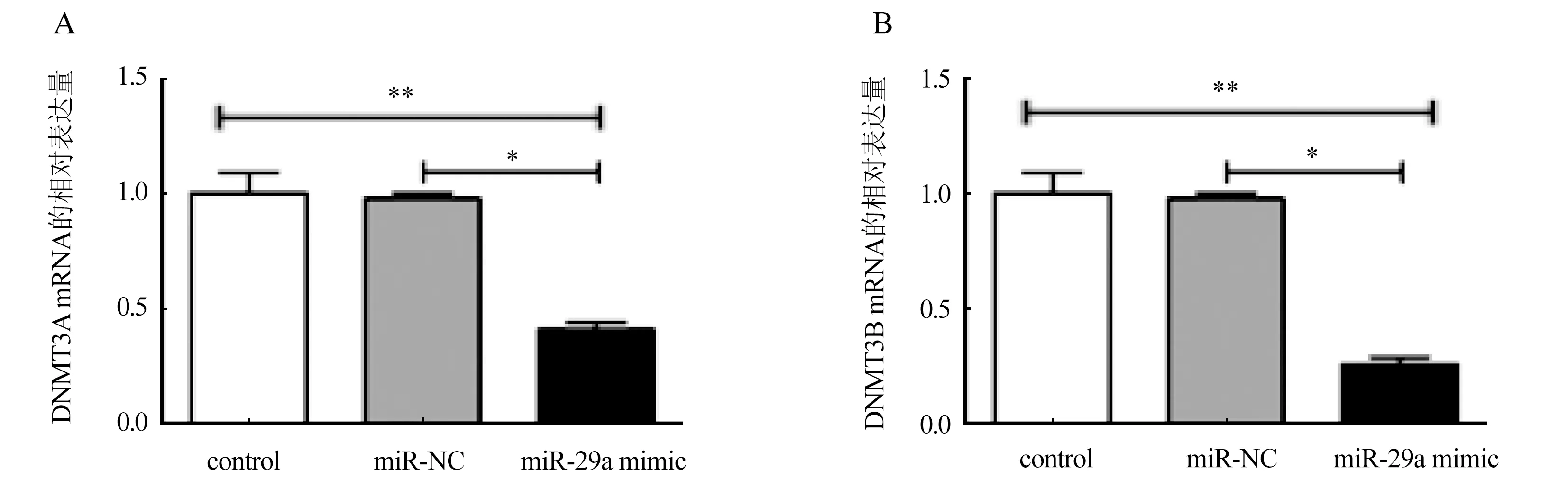
注:与miR-NC组比较,*P<0.01;与control组比较,**P<0.01图5 人宫颈癌细胞系Hela中DNMT3A、DNMT3B的mRNA表达量
2.6 DNMT3A、DNMT3B在人宫颈癌细胞系Hela中蛋白的表达 用ELISA实验测定不同转染组中DNMT3A,DNMT3B蛋白表达水平,结果表明Hela细胞过表达miR29a后,DNMT3A,DNMT3B的蛋白表达均下降,差异比较有统计学意义(P<0.01,表1)。同时经Western Blot再次检测Hela细胞在不同转染组中DNMT3A,DNMT3B的蛋白表达水平,结果显示与Hela细胞空白(control)组和无关序列阴性对照(miR-NC)组比较,miR-29a模拟物(miR-29a mimic)组中DNMT3A,DNMT3B的蛋白表达均不同程度的下调,差异比较具有统计学意义(P<0.01,图6)。Western Blot检测结果与ELISA的结果相吻合。

表1 不同转染组细胞中DNMT3A、DNMT3B的蛋白表达水平
注:与Hela细胞空白(control)组和无关序列阴性对照(miR-NC)组比较,*P<0.01
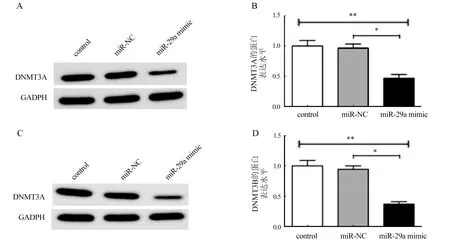
注:与miR-NC组比较,*P<0.01;与control组比较,**P<0.01图6 人宫颈癌细胞系Hela中DNMT3A、DNMT3B的蛋白表达水平
3 讨论
人乳头瘤病毒持续感染是宫颈癌发病的初始步骤,但是其发展还需要多因素的共同作用,miRNA被认为是此过程中的重要因素。自从miRNA在B细胞慢性淋巴细胞白血病的表达发生改变被证实后[4],对miRNA在不同组织和细胞中差异性表达的研究显著增多,有大量的研究对宫颈癌中miRNA的表达谱进行了分析[5-7],表明了一些miRNA在宫颈癌中的差异性表达,而这些差异性表达的miRNA可能成为宫颈癌早期诊断和治疗的重要靶点。其中miR-29a表达下调显著[5],miR-29可调控人体细胞中参与细胞代谢、分化、凋亡、迁移、免疫等过程的相关基因表达,多种肿瘤和疾病中存在miR-29的异常表达。在横纹肌肉瘤细胞和原发性肿瘤中miR-29a可诱导细胞分化并抑制肿瘤生长,此过程受NF-κB-YY1通路调控[8]。体外细胞培养模型,乙肝病毒X蛋白在促进肝癌细胞HepG2迁移中miR-29a-PTEN-Akt调控起关键作用[9]。但是目前国内有关miR-29a与宫颈癌的发生发展的相关研究报道不多。
黄智述和任黔川[10]的研究显示,不同的宫颈病变组织中表达水平有差异,随着宫颈病变由正常宫颈和低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)逐步向高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)和宫颈癌演变的过程中,miR-29a的表达水平逐步减低,miR-29a在正常宫颈和LSIL组织中表达水平相对较高,而在宫颈鳞癌及HSIL组织中呈低表达,且miR-29a在宫颈鳞癌组织中的表达低于HSIL。吴玉萍[11]的研究也表明miR-29a在宫颈癌组织中的表达量明显低于正常宫颈组织,且miR-29a在Ⅱa期宫颈癌组织中的表达量明显低于Ⅰa期和Ⅰb期。本研究显示,miR-29a在宫颈癌组织中的表达量低于癌旁组织,且Ⅱa期宫颈癌组织中miR-29a的相对表达量低于Ⅰb期,与国内学者的研究结果基本一致。同时本研究对正常宫颈细胞系和宫颈癌细胞系检测发现,miR-29a在宫颈癌细胞系中的mRNA和蛋白的表达均低于正常宫颈细胞系,推测miR-29a的表达下调可能与宫颈癌的发生、发展有关。
DNMT3A和DNMT3B分别位于2p23和20q11.2,其编码的蛋白质为DNA甲基转移酶DNMT3A和DNMT3B,可使未甲基化的DNA双链发生甲基化。DNA甲基化异常与恶性肿瘤的发生、发展密切相关,当DNA甲基化酶水平升高,其可导致抑癌基因失活或癌基因的激活,进一步影响恶性肿瘤易感性及机体对化疗的敏感性[12]。DNMT3A和DNMT3B在多种实体肿瘤和造血系统肿瘤中表达升高,但有关宫颈癌的相关研究较少。在本研究中,DNMT3A、DNMT3B在宫颈鳞癌组织中的表达明显高于癌旁组织,且在Ⅱa期宫颈癌组织中的相对表达量高于Ⅰb期,考虑DNMT3A、DNMT3B的高表达与肿瘤的侵袭、转移及预后相关。在本研究中,转染人宫颈癌Hela细胞株过表达miR-29a后DNMT3A、DNMT3B的mRNA和蛋白的相对表达量均明显下降,也证实了DNMT3A、DNMT3B是miR-29a的靶基因,但其具体作用机制仍有待进一步研究。
肿瘤细胞的增殖、凋亡、侵袭及转移等恶性生物学行为是肿瘤进展的重要原因。本研究显示miR-29a在宫颈癌组织中呈低表达,DNMT3A及DNMT3B在宫颈癌组织中呈高表达,且转染人宫颈癌Hela细胞株过表达miR-29a后DNMT3A及DNMT3B的mRNA和蛋白的相对表达量明显下降,推测miR-29a可能为抑癌基因,它可能通过降低DNMT3A及DNMT3B的表达来发挥其抑癌作用,推测miR-29a可能调控宫颈癌的发生与发展,但有关miR-29a调控肿瘤细胞恶性生物学行为的具体分子生物学机制尚不明确。目前国内外对于miR-29a、DNMT3A及DNMT3B在宫颈癌中的具体作用及其机制研究尚不完善,本研究虽然提示miR-29a在宫颈癌组织中的表达量低于癌旁组织,DNMT3A及DNMT3B在宫颈癌组织中的表达量高于癌旁组织,且随着肿瘤分期的增加,miR-29a的相对表达量有所降低,DNMT3A及DNMT3B的相对表达量有所增加,但是由于样本量较少的客观原因,仍需要更大样本量的研究以验证。

