类志贺毒素Ⅱ型变异体(SLT-IIe)基因表达及间接ELISA方法的建立
王警 张雪寒 郭芸芸 张碧成 吴庆侠 何孔旺

摘要:试验针对产类志贺毒素大肠杆菌SLT-IIe初步建立一种猪水肿病大肠杆菌的血清学检测方法。通过原核表达构建出重组崖pET28a-sumo-SLT-IIe/BL21在IPTG诱导下获得表达,表达产物以包涵体形式产生,使用十二烷基肌氨酸钠(SKL)变性的生化提纯步骤获取有生物学活性的重组蛋白。将提取的SLT-He蛋白作为抗原包被ELISA板,初步建立了特异性强的猪水肿病诊断方法,方阵滴定确定抗原最佳包被浓度为2μg/孔,最佳血清稀释浓度是1:25,HRP-羊抗猪二抗的工作浓度1:15000,5%脱脂奶封闭1h,显色15min。该方法的建立对猪水肿病流行病学调查以及预防和控制该病的发生有重要意义。
关键词:猪水肿病;产类志贺毒素大肠杆菌;SLT-IIe;ELISA
中图分类号:S852.61 文献标识码:B doi:10.3969/j.issn.2096-3637.2019.08.003
0 引言
猪水肿病是仔猪的一种急性致死性传染病,主要由O138、O139等血清型产类志贺毒素大肠杆菌引起的肠毒血症[1],主要发生于断奶仔猪。发病率通常为10%~35%,病死率高达90%[2]。类志贺毒素Ⅱ型变异体(SLT-IIe)又称猪水肿毒素,是猪水肿病的重要致病因子[3],其分子结构由1个A亚单位和5个B亚单位组成[4]。
产SLT-IIe大肠杆菌的传统诊断方法是用Vero细胞和小鼠神经毒性试验,并以抗SLT-IIe血清或单克隆抗体做中和试验鉴定,但诊断程序比较繁琐。以SLT-IIe特异性抗体为诊断试剂的ELISA具有高度的特异性[5]。试验通过原核表达SLT-IIe重组蛋白,并以此作为包被抗原建立同时检测SLT-IIe抗体的间接ELISA方法,研制检测SLT的试剂盒。
1 材料与方法
1.1 菌株、质粒及血清
原核表达载体pET28a-sumo(带有11.2kD的sumo标签)、IPTG、猪SLTEC标准阳性血清和阴性血清,均为江苏省农业科学院兽医研究所保存;Sac-1与Bsa-1购自BioLabs;辣根过氧物酶(HRP)标记的羊抗猪IgG购自BETHYL。
1.2 原核表达载体构建及重组蛋白表达和提取
参考Gen Bank上公布的SLT-IIe基因序列(登录号:M21534)设计特异性引物,大小为219bp。将SLT-IIe基因双酶切后克隆入pET28a-sumo载体,构建重组质粒。
阳性重组菌OD600值达到0.4~0.6时,加入IPTG进行诱导表达12h后进行SDS-PAGE鉴定表达情况。将菌液离心后的沉淀裂解后用20% SKL贮存液提取SLT-IIe重组蛋白。
1.3 间接ELISA檢测方法
用pH为9.6的碳酸盐缓冲液将纯化的重组蛋白以4μg/孔、2μg/孔倍比稀释至0.03125μg/孔后,每孔100μL包被酶标板,血清从1:25、1:50倍比稀释至1:12800进行矩阵滴定;二抗1:15000稀释,用TMB显色,2mol/L的H2SO4终止反应测定OD450nm值。选择阳性OD大于1,阴性OD介于0.1~0.2,P/N值最大时的抗原浓度和血清稀释度。在此基础上分别对酶标二抗的工作浓度、封闭液种类、封闭时间等逐优化。计算10份未感染SLT-IIe的阴性猪血清与标准阳性血清OD450nm的比值S/P以及其平均值X及标准方差SD,阴阳性临界值=X+3SD作为EMSA判定标准。
1.4 特异性试验
按已建立的间接ELISA方法操作,分别检测已知PEDV、TGEV、FMDV、O157:H7和大肠杆菌F4和F5阳性血清,每份血清做2个重复。用酶标仪测定各孔OD450nm值,确定该间接ELISA方法的特异性。
1.5 临床样品检测
检测实验室保存的不同日龄未免疫猪水肿病疫苗的猪血清共409份,其中新生未吃初乳的仔猪血清10份、2周龄30份、3周龄67份、4周龄35份、5周龄50份、6周龄及以上周龄母猪血清共206份。
2 结果
2.1 原核表达载体的构建与重组蛋白的表达
重组崖pET28a-sumo-SLT-IIe/BL21经IPTG诱导,目的蛋白获得高效表达,分子量大小约为25kD,条带单一,见图1。
2.2 间接ELISA方法的建立
经方阵滴定法确定并优化的ELISA反应条件:包被抗原浓度为2ug/孔,血清稀释度为1:25;酶标二抗的稀释度为1:15000,封闭时间为1h,底物最佳反应时间为15min。经计算,10份血清的S/P平均值X=0.140,SD=0.0330,因此ELISA阴阳性临界值为X+3SD=0.239。
2.3 特异性试验
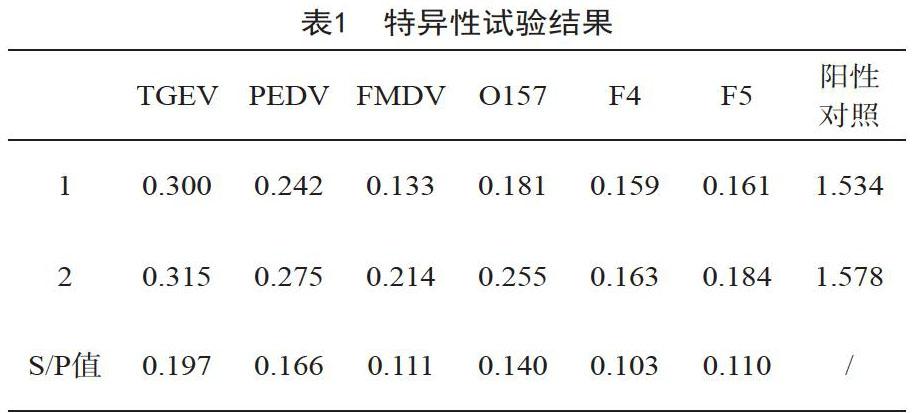
检测已知的PEDV、TGEV、FMDV、O157、F4和F5的阳性血清S/P值均小于0.239,判定为阴性,表明该方法具有良好的特异性,见表1。
2.4 临床猪血清检测
检测本实验室保存的不同日龄猪血清409份结果显示,新生仔猪阳性率为0,2周龄阳性率达83.33%,此后的阳性率呈逐步上升趋势,5周龄的增幅相对较高。新生未吃初乳仔猪几乎不发病,但2周龄的猪阳性率显著增高,呈现出大面积流行和爆发,分析其原因可能是该猪场存在环境的污染和带菌猪的广泛传播;5周龄阳性率偏高,据了解该猪场生猪在5周龄断奶,可能导致了阳性率的升高,这与猪水肿病的流行病学规律一致。
3 讨论与结论
近年,SLT-IIe大肠杆菌LAMP检测方法的建立及被初步应用[6],Craig S[7]开发并鉴定了4种针对SLT-IIe的单克隆抗体,使用这些单抗对SLT-IIe的检测限为11.8pg/mL,这些免疫学方法的建立比较耗时且成本较高。研究中建立的间接ELISA方法成本低,可以检测血清中的IgG抗体。
研究通过SLT-He基因的克隆和原核表达,用SLT-IIe表达蛋白作为包被抗原,采用方阵滴定方法确定抗原的最佳包被浓度和血清最佳稀释倍数,优化了各项反应条件。利用建立的SLT-IIeELISA诊断方法对409份本实验室保存的不同日龄未免疫猪水肿病疫苗的猪血清进行检测,未吃初乳的小猪阳性率为。,2周龄的仔猪呈现爆发性流行,分析其原因这可能是由临床环境引起,猪水肿病的传染源来自病猪和带菌仔猪,其粪便会排出大量的致病性大肠杆菌。作为一种条件性致病菌,在一定条件下,携带有SLT-IIe毒素蛋白的大肠杆菌在猪舍间广泛传播,导致猪场环境被污染,进而造成猪水肿病的爆发和地方流行。研究中建立的SLT-IIeELISA诊断方法可以有效的检测猪场中SLT-IIe的携带和感染状况,阳性率高低能反应猪群的实际感染情况,对猪水肿病流行病学调查以及控制该病的发生十分重要。
参考文献
[1]孙海清.Stx2e毒素酶活性位点突变体毒素生物学特性及免疫保护性的研究[D].扬州:扬州大学,2013.
[2]Moxtey R A.Veterinary Clinics of North America Food AnimalPractice[J].Edema disease,2000,16(1):175-185.
[3]楊明柳.致猪水肿病大肠杆菌二重PCR检测方法及三价灭活菌苗研究[D].武汉:华中农业大学,2007.
[4]林艺远.致猪水肿病大肠杆菌ELISA抗体检测方法及基因工程亚单位疫苗的初步研究[D].武汉:华中农业大学,2006.
[5]张强,张雪寒,何孔旺,等.ETEC F4-F5融合基因表达及间接ELISA方法建立[J]中国兽医学报,2016,36(8):1312-1317.
[6]丁建民,江馗语,朱江巍,等.致猪水肿病主要毒力因子-产志贺毒素Ⅱ型变异体大肠杆菌LAMP检测方法的建立及初步应用[J].农家致富顾问,2017(16):35-38.
[7]Craig S,Stephanie P,Hernlem B J,et al.New Stx2eMonoclonal Antibodies for Immunological Detection andDistinction of Stx2 Subtypes[J].PLOS ONE,2015,10(7):e0132419.
基金项目:江苏省重点研发计划(BE2017341-1)
作者简介:王警(1993-),女,硕士研究生,主要从事食源性病原菌分离、鉴定和遗传进化分析工作。
通信作者:吴庆侠,副教授,从事家畜生殖内分泌与生殖免疫研究。
何孔旺,研究员,从事人兽共患病防控技术和致病机制研究。

