Alda-1通过激活线粒体乙醛脱氢酶2改善大鼠肺缺血再灌注损伤
张裕坚,林婷婷,夏芳芳,董娇娇,金周晟,刘乐
(温州医科大学附属第一医院 麻醉科,浙江 温州 325015)
肺缺血再灌注损伤(lung ischemia-reperfusion injury,LIRI)广泛存在于各种临床事件中,如肺栓塞、肺移植、体外循环术等,期间形成活性氧自由基、炎症级联反应、钙超载、细胞凋亡等一系列病生理过程,严重影响患者的预后[1]。线粒体乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)是机体内醛类物质代谢的关键酶,可将有毒性的醛类物质转化为无毒性的羧酸类物质起到解毒作用。近年来研究发现激活ALDH2 可减轻心[2-5]、脑[6]、肝[7-8]、肾[9]、肠[10]等脏器的缺血再灌注损伤。本研究在现有基础上,给予ALDH2 激动剂Alda-1对LIRI进行预处理,检测肺病理学、醛类物质和ALDH2,从而探求Alda-1减轻LIRI的保护作用。
1 材料和方法
1.1 材料健康成年SPF级雄性SD大鼠,体质量300~350 g,由温州医科大学实验动物中心提供,动物生产许可证号:SCXK(浙)2015-0001。丙二醛(malondialdehyde,MDA)测定试剂盒(硫代巴比妥酸比色法,南京建成生物工程研究所);大鼠4-羟基壬烯醛(4-hydroxynonenal,4-HNE)ELISA试剂盒(上海研谨生物科技有限公司);兔抗β-actin多克隆抗体(美国Abcam公司,货号:ab8227),兔抗ALDH2单克隆抗体(美国Abcam公司,货号:ab108306),ALDH2 活性比色法检测试剂盒(美国Biovision公司);BCA蛋白浓度测定试剂盒(美国Thermo公司)。
1.2 方法
1.2.1 动物分组及构建大鼠LIRI模型:参考钱小英等[11]的方法复制大鼠在体LIRI模型,采用随机数字表法将大鼠进行分组,分为假手术组(Sham组)、肺缺血再灌注组(I/R组)和Alda-1预处理组(Alda-1组),每组8只。Sham组开胸后仅显露左肺门,但不进行结扎;I/R组开胸后阻断左肺门30 min,再开放恢复供血和通气120 min;Alda-1组于缺血前1 h腹腔注射Alda-1(6 mg/kg),其余同I/R组。实验结束取大鼠动脉血用于测MDA及4-HNE;左肺上段置于4%中性甲醛溶液中固定,待作光镜病理观察;左肺中段用于肺湿干重比(W/D)测定;左肺下段用于MDA、4-HNE和ALDH2含量及活性的测定。
1.2.2 肺病理学改变:左肺上段固定后做成石蜡包块,切片,HE染色,并在光镜下观察肺泡形态、结构改变及肺间质充血水肿等情况。
1.2.3 W/D测定:取出左肺中段组织,滤纸吸净表面水分立即称重并记录湿重(W),然后置于80 ℃烘箱烘干24 h至恒重,称干重(D),求得W/D值。
1.2.4 血浆和肺组织的MDA、4-HNE醛类物质含量及肺组织ALDH2的活性:动脉血离心取上层血浆,
左肺下段组织匀浆离心取上清液,根据相应的试剂盒说明书检测MDA、4-HNE含量及ALDH2活性。
1.2.5 Western blot检测肺组织ALDH2蛋白相对表达量:左肺下段组织加入含1% PMSF的RIPA强效裂解液,匀浆提取总蛋白,用BCA法测定蛋白浓度并配置上样蛋白。用SDS-PAGE分离胶10%,浓缩胶5%电泳,之后采用湿法转膜将蛋白转印至0.45 µm的PVDF膜。用含5%脱脂奶粉的TBST室温下封闭1 h,一抗稀释液配制ALDH2抗体(1:1 000)和β-actin抗体(1:1 000),将膜放入相应一抗液中4 ℃水平摇床孵育过夜,次日加入1:5 000的山羊抗兔IgG(H+L)HRP室温孵1 h,后加入ECL发光液,用凝胶成像仪(美国Bio-Rad公司)自动显影读取条带灰度值,以β-actin为内参,计算目的蛋白条带灰度值与内参条带灰度值的比值。
1.3 统计学处理方法所有数据应用SPSS22.0软件进行统计分析。计量资料用±s 表示,3组间比较采用单因素方差分析,方差齐性者采用LSD法,方差不齐者采用Dunnett’s T3检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺病理学改变Sham组肺泡结构基本完整,肺间质无明显充血水肿;I/R组大部分肺泡被破坏,肺泡璧明显增厚,腔内有大量的红细胞及水肿液聚集,肺间质明显水肿伴大量中性粒细胞浸润;Alda-1组较I/R组,肺泡破坏程度明显改善,腔内仅有少量红细胞渗出,肺间质水肿液明显减少(见图1)。
2.2 W/D值与Sham组相比,I/R组的W/D值显著升高,差异有统计学意义(P <0.05);与I/R组比较,Alda-1组的W/D值显著下降,差异有统计学意义(P<0.05),见表1。
2.3 血浆和肺组织MDA、4-HNE醛类物质含量的变化
I/R组的血浆和肺组织的MDA、4-HNE含量均高于Sham组(均P<0.05);Alda-1组的血浆和肺组织的MDA、4-HNE含量均低于I/R组(均P<0.05),见表1。2.4 肺组织ALDH2的含量和活性变化 3组肺组织的ALDH2含量差异无统计学意义(P>0.05);但在ALDH2活性上,I/R组低于Sham组(P<0.05),Alda-1组显著高于Sham组及I/R组(P<0.05),见表2。
3 讨论
肺缺血再灌注过程中产生的活性氧自由基(reactive oxygen species,ROS)夺取细胞膜不饱和脂肪酸侧链上的氢原子,启动脂质过氧化链式反应,进而生成大量的MDA(短链脂肪醛类)、4-HNE(中长链脂肪醛类)等毒性醛类物质。这些高活性的脂膜过氧化产物在体内可通过多种途径产生生物毒性,如作为内源性诱导因子促进细胞凋亡及自噬[12],修饰含硫蛋白的相关位点,抑制有效蛋白生成或活性改变[13],作为脂质过氧化的终末产物可诱导巨噬细胞的聚集活化,促进炎症发生[14]。对于肺组织而言,在保留通气的条件下发生缺血时,由于持续的氧气供给,诱导巨噬细胞/内皮细胞/炎症细胞产生较其他组织器官更多的活性氧自由基,进而形成大量的毒性醛类物质,因此机体对于肺组织内毒性醛类物质的代谢就显得尤为重要。

图1 各组肺组织HE染色图(×200)
表1 各组肺组织W/D及血浆肺组织MDA、4-HNE含量的比较(每组n=8±s)

表1 各组肺组织W/D及血浆肺组织MDA、4-HNE含量的比较(每组n=8±s)
与Sham组比:aP <0.05;与I/R组比:bP <0.05
?
表2 各组肺组织ALDH2蛋白相对表达量及活性比较(每组n=8,±s)
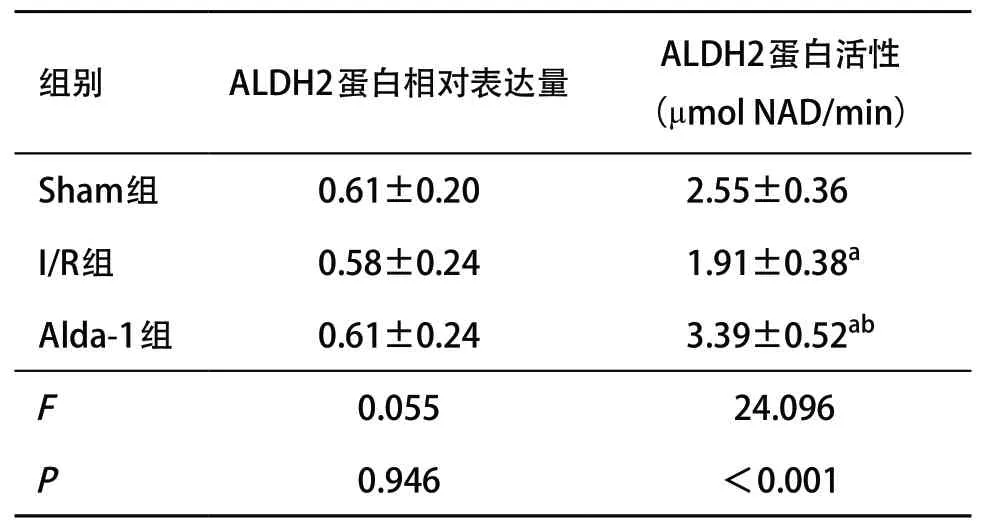
表2 各组肺组织ALDH2蛋白相对表达量及活性比较(每组n=8,±s)
注:NAD为氧化型烟酰胺腺嘌呤二核苷酸。与Sham组比:aP<0.05;与I/R组比:bP <0.05
?
ALDH2是已发现的ALDH家族19个成员中对醛类代谢能力最强的同工酶,广泛参与体内醛类物质的氧化反应。近几年关于ALDH2与肺部疾病的关系研究也越来越多,CHEN等[15]发现DNA碱基切除修复蛋白XRCC1高表达的肺癌患者总体存活率较差,也许与ALDH2基因低表达,减少醛类代谢有关。AU YEUNG等[16]指出ALDH2突变与肺功能呈负相关,是肺功能不佳、可能发生慢性阻塞性肺疾病的遗传危险因素。研究表明Alda-1作为一种高选择性ALDH2小分子激动剂[17],可以减轻醛类诱导的急性肺损伤和内皮屏障功能障碍[18-19]。
本研究显示,I/R组的肺组织损伤严重,但外源性给予Alda-1 预处理后,可明显减轻肺组织水肿、改善肺病理学变化,说明Alda-1对LIRI具有保护作用。I/R组的肺组织和血浆中堆积大量的MDA、4-HNE,而Alda-1组则改善了毒性醛类堆积的情况;但3组间的ALDH2蛋白相对表达量没有变化,只是ALDH2的活性发生了改变,这说明肺缺血再灌注过程并没有抑制ALDH2的合成,而是通过抑制ALDH2的活性造成醛类堆积,从而造成损伤;而Alda-1主要是通过激活ALDH2的活性,而并不是通过增加ALDH2的合成来发挥加速醛类物质代谢的作用。

