CRISPR/Cas9系统介导的斑马鱼kctd1纯合突变体的构建
刘 姣, 黄 姣, 胡金萌, 李伟明, 任建峰
(1. 海洋生物科学国际联合研究中心(上海海洋大学)中国科学技术部, 上海 201306;2. 水产种质资源发掘与利用教育部重点实验室(上海海洋大学), 上海 201306;3. 水产科学国家级实验教学示范中心(上海海洋大学), 上海 201306)
人体中包含26个钾离子通道四聚体蛋白(potassium channel tetramerization domain, KCTD),该家族成员均含有序列相似的钾离子电压门控(voltage-gated K+channels, Kv channels)的细胞质结构域[1-2]。KCTD蛋白在N端具有保守的BTB(Bric-a-brack,Tram-track, Broad complex, BTB)结构域,也称为POZ(poxvirus and zinc finger)结构域,但是却具有多变的C端。含有BTB结构域的蛋白通过该结构域介导蛋白互作,其功能包括转录抑制、细胞骨架调节、离子通道的四聚体化、与泛素化连接酶E3(Cul3)相互作用等[3-7]。KCTD蛋白参与多种信号通路,包括Shh信号通路、Wnt/β-catenin信号通路和GABA信号通路等[2,8-15]。KCTD蛋白在增殖、分化、凋亡和新陈代谢等方面具有重要的调控作用,研究表明KCTD基因表达异常导致人类疾病的发生,如乳腺癌、髓母细胞瘤和肥胖等[2,6-19],但该家族绝大多数成员的具体功能还不清楚。
CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9, CRISPR/Cas9 )系统是继锌指核酸内切酶(zinc finger endonuclease, ZFN)和类转录激活因子效应物核酸酶(transcription activator-like effector nuclease, TALEN)之后的第3代人工核酸内切酶,可以实现特定基因的高效编辑[20-22]。
斑马鱼(Daniorerio)具有生殖周期短、胚胎透明和产卵量大等优点,已成为研究器官发育以及疾病模型构建等研究的模式生物[23]。KCTD1突变导致人类表皮-耳朵-乳头综合征(Scalp-ear-nipple syndrome, SEN),其临床表现包括头皮表皮发育不全,没有乳头,耳朵畸形等[24]。本研究利用CRISPR/Cas9技术构建斑马鱼kctd1基因突变体,并对kctd1在斑马鱼多个组织的表达水平进行定量分析,以期为进一步研究kctd1基因功能提供基础。
1 材料与方法
1.1 主要仪器与试剂
野生型斑马鱼AB品系购自中国科学院生物化学与细胞生物学研究所,zCas9 质粒由北京大学生命科学学院张博教授实验室惠赠,pUC19-scaffold 质粒由北京大学分子医学研究所熊敬维教授实验室惠赠;DH5α 菌株购自天根生化科技(北京)有限公司;Cas9体外转录试剂盒mMESSAGE mMACHINETM®T7 Ultra Kit(AM1345)和gRNA体外转录试剂盒MAXIscript®T7inVitroTranscription Kit(AM1314)购自Ambion公司;DNA纯化试剂盒DNA Clean & ConcentratorTM-5 (D4014)购自Zymo Research公司;Phusion®High-Fidelity PCR Master Mix(M0531L)和T7 Endonuclease I(M0302L)购自NEB公司;2×EasyTaq®PCR SuperMix for PAGE(AS112)购自北京全式金生物技术有限公司;TRIzol(15596-018)购自Invitrogen公司;反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (RR047A)购自Takara公司;LightCycler®480 SYBR Green I Master(Roche, 04887352001)和LightCycler®480II(Roche)实时荧光定量PCR系统均购自罗氏公司。
1.2 靶点及检测引物的设计
在 Ensembl 网站(http://asia.ensembl.org/Danio_rerio/Info/Index)上查找目的基因序列,在zifit网站(http://zifit.partners.org/ZiFiT/)上设计一段20 bp大小的靶序列,在网站http://asia.ensembl.org/Danio_rerio/Tools/Blast?db=core上对靶序列进行BLAST比对,验证靶点特异性。gRNA 体外转录模板的上游引物如下: 5′-TAATACGACTCACTATAGCAGCCTGGCCACATTAACCGTTTTAGAGCTAGAAATAGC-3′;下游引物如下:5′-AAAAAAAGCACCGACTCGGTGCCAC-3′。
在斑马鱼kctd1多个转录本共有区域即基因的第3个外显子上设计靶点(图1)。

注:红色碱基代表Cas9蛋白识别的PAM(protospacer adjacent motif)位点
图1靶点设计示意图
Figure 1 Diagram of target site design
本实验采用T7E1核酸内切酶酶切检测的方法进行突变体的筛选。该酶能够识别并切割不完全配对的DNA Holliday 结构或交叉DNA等。设计的引物需要符合以下原则:上下游引物距离靶位点两侧距离都大于 100 bp,两个引物到靶点的距离差至少大于50 bp,PCR扩增产物大小范围在300 bp至500 bp之间,且条带单一。通过NCBI网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计合适的引物,并由生工生物工程(上海)股份有限公司合成,表1为所列引物序列信息。
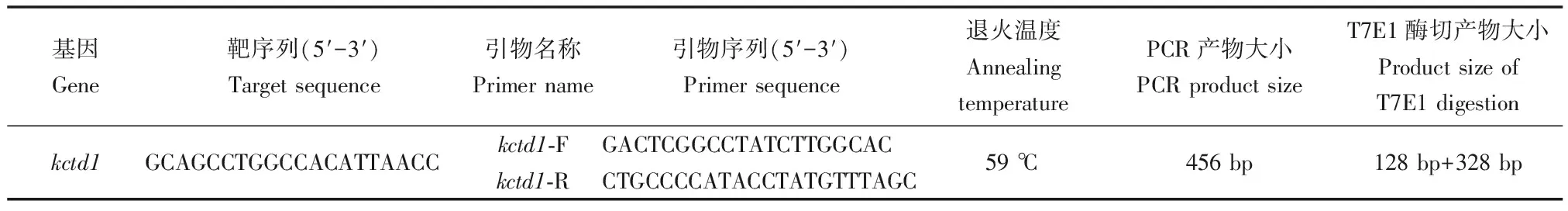
表1 靶点及检测用的引物序列信息
1.3 gRNA和Cas9 mRNA合成
gRNA合成。合成模板的准备:高保真酶PCR反应体系包括12.5 μL Phusion®High-Fidelity PCR Master Mix,9.5 μL RNase-free H2O,1.0 μL(50 ng/μL)gRNA 质粒, 1.0 μL上游引物,1.0 μL下游引物。反应程序:98 ℃ 预变性30 s;98 ℃ 变性10 s,65 ℃ 退火15 s,72 ℃ 延伸50 s,共34个循环;72 ℃ 再延伸5 min。gRNA体外转录:按照试剂盒步骤进行RNA合成。
Cas9 mRNA合成。合成模板准备:X-baⅠ酶切体系包括1.0 μL Restriction Enzyme,1.0 μg Cas9 plasimid,5.0 μL 10×NEB Buffer,X μL RNase free H2O,反应总体积50.0 μL。反应程序是37 ℃ 20 min。Cas9 mRNA体外转录:按照试剂盒步骤进行RNA合成。
1.4 显微注射及敲除检测
在斑马鱼胚胎一细胞期进行注射,注射体系为Cas9 mRNA∶gRNA=400 ng/μL∶100 ng/μL,注射剂量V=1 nL。注射完成后,将胚胎置于28.5 ℃培养箱中进行培养,并定期换水。
取注射后2 dpf的胚胎(5枚/管,3管),向每管样品中加入50 μL 50 mmol/L NaOH,95 ℃ 加热10 min,振荡;重复加热振荡;加入5 μL pH 8.0 1 mol/L Tris-HCl,10 000 r/min,离心5 min,上清即为基因组。根据表1所列引物进行PCR扩增反应。PCR反应体系包括2.0 μL DNA模板,1.0 μL上游引物,1.0 μL下游引物,8.5 μL ddH2O,12.5 μL 2×EasyTaq®PCR SuperMix for PAGE。PCR反应程序:94 ℃ 预变性3 min;94 ℃ 变性30 s,59 ℃ 退火30 s,72 ℃ 延伸40 s,共34个循环;72 ℃ 再延伸5 min。将PCR产物进行T7E1酶切检测,将酶切成功的PCR产物送生工测序,若敲除成功,靶点附近及以后出现套峰。
1.5 F0斑马鱼生殖细胞对突变的遗传性检测
将敲除成功的F0胚胎饲养至性成熟,与显微注射时留作对照的野生型成鱼外交,收集发育2 dpf的胚胎(5枚/管,3管),提取基因组后PCR扩增,T7E1酶切及测序检测靶位点突变情况,将 T7E1 酶切成功的PCR产物进行测序,并将有突变对应的F1胚胎养起来。
1.6 F1成年斑马鱼基因型鉴定
对54尾F1成年斑马鱼剪尾提取基因组,通过T7E1酶切及测序检测,将酶切成功的PCR产物纯化后进行TA克隆,每条F1挑选PCR产物的5个TA单克隆进行测序确定突变类型。
1.7 F2纯合突变体的筛选
将获得的两种突变类型为+7 bp和-8 bp的F1杂合体成鱼分别内交,分别得到41尾和72尾F2。对F2成鱼剪尾提取基因组,PCR产物进行T7E1酶切检测,PCR产物切开对应的个体为杂合子;未切开对应的个体为WT或纯合子,通过PCR产物测序及序列比对,确定F2基因型。
1.8 qRT-PCR检测kctd1组织表达情况
用TRIzol法提取WT成鱼的心脏、肝脏、皮肤、脑和鳃5个组织的总RNA,每个组织3个生物学重复。使用试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser进行RNA反转录获得cDNA。在NCBI网站设计kctd1 qRT-PCR引物(表2),使用罗氏SYBR和罗氏LightCycler®480II 实时荧光定量PCR系统进行荧光定量检测,使用2-ΔΔct法计算基因相对表达量,使用软件Graphpad prism5绘制柱状图。

表2 qRT-PCR 引物序列
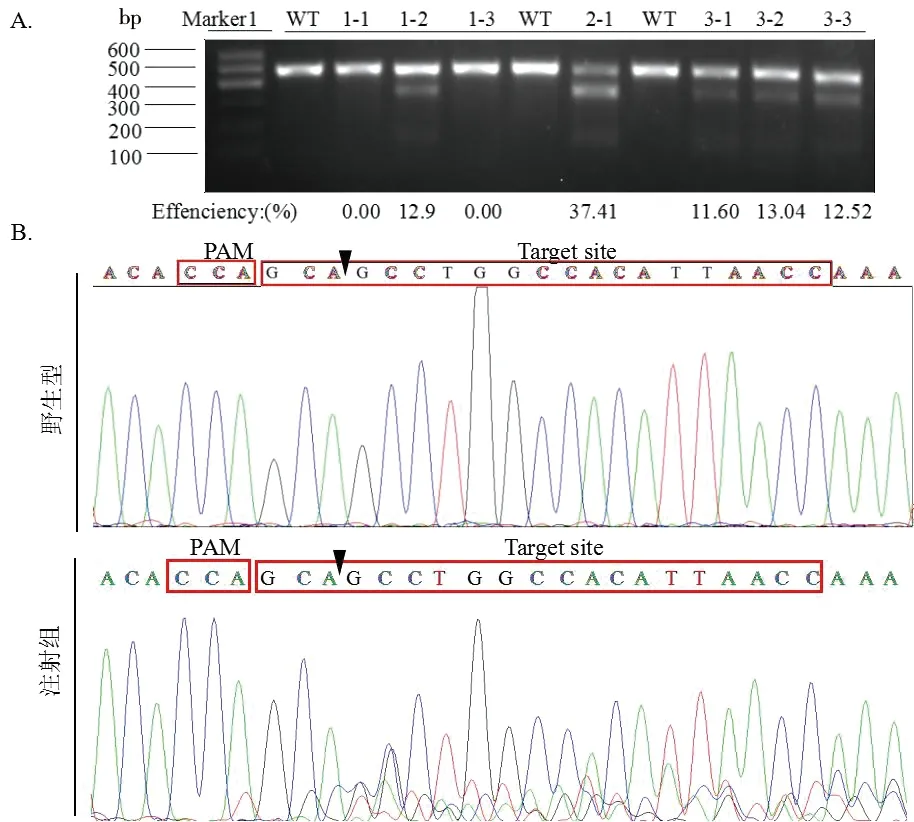
红框代表PAM和靶序列,黑色箭头代表Cas9切割位置
图2kctd1注射敲除后T7E1酶切检测和测序分析
Figure 2 T7E1 assay and sequencing analysis ofkctd1 knock-out after injection
2 结果与分析
2.1 F0显微注射敲除检测
经过T7E1酶切检测,根据公式100×{1-sqrt[1-(b+c)/(a+b+c)]}计算敲除效率,a为未切开条带灰度值,b、c为切开条带的灰度值[26]。得出kctd1显微注射的敲除效率范围是11.60%~37.41%,将酶切成功对应的PCR产物进行测序,发现在靶点附近及以后出现乱峰,说明敲除成功(图2)。
2.2 F1突变类型检测
通过F1成鱼剪尾及PCR产物TA克隆检测,成功获得kctd1两种突变类型,为+7 bp和-8 bp(图3)。
2.3 F2纯合突变体的筛选
经过序列比对,得到F2两种突变类型的纯合突变体-8 bp-/-18尾,+7 bp-/-11尾,F2具体基因型统计情况如表3所示。

红框代表靶序列,红色箭头代表Cas9切割位置

图3 F1突变类型检测
2.4 kctd1组织表达检测
TRIzol法提取WT成鱼心脏、肝脏、皮肤、鳃和脑组织RNA,qRT-PCR检测kctd1基因的组织表达情况。定量结果显示,相较于心脏、肝脏、皮肤和鳃组织,kctd1在脑组织中显著高表达(图4)。

***表示P<0.001
图4野生型斑马鱼中kctd1组织表达分析
Figure 4 Expression ofkctd1 in WT zebrafish
3 讨论与结论
CRISPR/Cas9作为第3代人工核酸内切酶,能够实现单基因以及多基因的敲除,与TALEN、ZFN相比操作更加简便。斑马鱼基因组与人类基因组具有很高的相似性,已经成为研究器官发育与疾病模型构建的理想模型。这些都大大提高了我们利用CRISPR/Cas9技术构建斑马鱼kctd1基因突变体的可行性[20-23]。
KCTD家族在进化上具有保守性。有研究报道,KCTD1能够与细胞朊蛋白(cellular prion protein,PrPC)相互作用,而且能够抑制AP2α的转录活性[28-29]。人类中,KCTD1基因的突变则会导致头皮-耳朵-乳头综合征,与TFAP2A异常导致的觸裂眼面综合征(Branchio-oculo-facial syndrome, BOFS)具有相似的临床表型,表明SEN和BOFS的发病机制可能具有相似性[24, 30]。人类KCTD1基因在乳腺、肾、脑和卵巢中表达,亚细胞定位显示KCTD1属于核蛋白[19]。我们的定量分析结果显示,斑马鱼kctd1基因在野生型成鱼脑组织中显著高表达,对进一步研究kctd1基因功能有一定的参考价值。Kumar等用ENU构建了小鼠Kctd1突变体,即Kctd1I27N,杂合突变体表现出肾功能衰竭,纯合突变体在围产期死亡[27]。我们用CRISPR/Cas9技术成功构建了斑马鱼kctd1纯和突变体,但是尚未发现明显的表型,一方面可能是该基因在鱼类和人类中功能有所差别,另一方面可能是因为斑马鱼中kctd基因家族其它成员基因补偿效应造成的,需要进一步研究。
目前,关于斑马鱼kctd基因突变体方面的研究很少。Tong等研究报道发现一尾斑马鱼kctd10的自发突变体,并利用TALEN技术重新构建了斑马鱼kctd10突变体,研究结果表明,Kctd10通过抑制Tbx5a转录活性调控斑马鱼心脏的形态发生[31]。本研究利用CRISPR/Cas9技术成功构建了斑马鱼kctd1基因突变体,显微注射后检测突变效率为11.60%~37.41%,最终筛选获得可稳定遗传的插入缺失纯和突变体(+7 bp-/-和-8 bp-/-)。斑马鱼kctd1基因突变体的构建,为进一步研究kctd1基因功能提供了基础;同时,斑马鱼研究结果将对人类KCTD1基因功能以及KCTD1致病机制的研究具有参考价值。

