格拉斯哥评分对局部晚期食管癌放化疗预后判断的价值探讨
林贵山,骆华春
研究证实,肿瘤相关炎症反应能够通过促进肿瘤细胞增殖、提高肿瘤细胞运动与侵袭能力、诱导肿瘤血管生成、抑制机体抗肿瘤免疫反应等多种途径,促进肿瘤的发生、增殖、侵袭和转移[1-3]。大多数肿瘤与炎症关系的相关研究采用如下炎症指标:C反应蛋白(C-reactive protein,CRP)、血清白蛋白、格拉斯哥评分(Glasgow prognostic score,GPS)或改良GPS(modified Glasgow prognostic score, mGPS)、中性粒细胞和淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板和淋巴细胞比值(platelet to lymphocyte ratio,PLR)、CRP和白蛋白比值(CRP to albumin,CAR)、预后指数(prognostic index,PI)和系统免疫-炎症指数(systemic immune-inflammation index,SII)等[1-2]。Ross等通过荟萃分析,得出GPS和NLR这两个指标与不可手术的恶性肿瘤的预后相关性较为明确[1]。本研究通过回顾性分析局部晚期食管鳞癌放化疗后的预后影响因素,并动态观察治疗前后GPS的变化能否更好地预测放化疗后的疗效,希望给临床治疗提供一定的参考。
1 对象和方法
1.1对象 收集2014年4月-2016年3月在福建省立医院和南京军区福州总医院治疗的局部晚期食管鳞癌患者117例,男性76例,女性41例,年龄(50.2±2.35)岁(23~75岁)。按AJCC第七版分期,Ⅱ~Ⅳ期各34,51和32例。入组标准:病理证实为鳞状细胞癌;未行肿瘤相关治疗;不可手术切除或不愿手术者;治疗前3天内已检查CRP、血清白蛋白。排除标准:非鳞癌者;合并或既往存在其他肿瘤;不能耐受同步放化疗者;术前1周内存在感染征象;远处转移者。患者的一般资料见表1。
1.2方法
1.2.1收集数据 收集治疗前1周内以及治疗结束时的三大常规、CRP和生化全套,患者治疗前一般情况(性别、年龄、肿瘤部位、组织分化程度、TNM分期)以及治疗后的影像学资料等。计算治疗前和治疗结束时的GPS,分别记为GPS1和GPS2。
GPS评分法:血清白蛋白<35 g/L为异常,CRP>10 mg/L为异常。白蛋白和CRP均异常者GPS记为2;二者均正常者记为0;任一个指标异常者记为1。根据治疗前后GPS的变化,把病例分成3组:A组为GPS好转者(GPS由2变为1或0,以及由1变为0);B组为GPS无变化者;C组为GPS恶化者(GPS由0变为1或2,以及由1变为2)。
1.2.2治疗方式 患者治疗前均行胃镜检查、颈胸部和全腹部CT、食管造影、CRP以及三大常规和生化全套检查,颅脑MRI和ECT骨显影作为可选项。患者均进行同步放化疗,放疗设备:直线加速器(600C/D或Trilogy,美国瓦里安公司);放疗方式:6MV-X线,剂量60 Gy/30F/6W,调强放射治疗;放疗计划软件:CMS或Pinnacle(11.0,荷兰飞利浦公司);化疗方案:安素泰(紫杉醇注射液,美国辉瑞公司)45 mg/m2+铂尔定(卡铂注射液,意大利施贵宝公司,AUC=2),放疗期间每周1次,共6周,静脉输注。
表1117例局部进展期食管癌患者的一般资料
Tab 1Characteristics of 117 patients of locally advanced esophageal cancer

一般资料n%年龄/岁 <657765.8 ≥654034.2性别 男7665.0 女4135.0BMI/(kg·m-2) <18.52521.4 18.5~23.95950.4 >23.93328.2分化程度 高3126.5 中4941.9 低3731.6原发位置 颈段3630.8 上段3126.5 中段2723.1 下段2319.6T分期 11512.8 22319.7 34941.9 43025.6N分期 02420.5 11916.2 25849.6 31613.7TNM分期 Ⅱ3429.1 Ⅲ5143.6 Ⅳ3227.3GPS1 02117.9 16152.2 23529.9GPS2 01815.4 15950.4 24034.2
BMI:指体质量指数;GPS1及GPS2:分别指治疗前及治疗后患者的格拉斯哥评分.
1.2.3随访、观察指标和疗效评定 治疗第1天为观察起点,前3年每3月复查1次,3~5年每半年复查1次,末次随访时间为2018-06-30。患者均完成整个放疗疗程和4次同步化疗,109例完成第5次化疗,104例完成第6次化疗。未完成化疗的原因:3级消化道反应、放射性食管炎和骨髓抑制。局部无复发生存时间(recurrence free of survival,RFS)定义为开始放疗至食管原发灶复发的时间间隔;总生存时间(overall survival,OS)定义为开始放疗至患者死亡的时间间隔。近期及远期疗效按实体瘤疗效评价标准RECIST1.1标准进行评估[1];毒副反应按照WHO化疗毒副反应分级标准及美国放射肿瘤协作组急性放射性损伤标准进行评价。
1.3统计学处理 采用SPSS 23.0软件进行统计学处理,不同表达组的差别采用χ2检验;采用Kaplan-Meier法绘制生存率曲线,并行Log-rank检验;预后多因素采用Cox比例风险模型。α=0.05为显著性检验水准。
2 结 果
2.1治疗前后的GPS 入组患者均可评价疗效,无失访者。治疗前GPS为0,1,2的例数分别为21,61和35例,而治疗后GPS为0,1,2的例数分别为18,59和40例。治疗前后GPS有变化者51例(43.59%),其中治疗后好转者21例(17.95%)、恶化者30例(25.64%)。
2.2近期和远期疗效 治疗结束后进行疗效评价,肿瘤完全缓解32例(27.35%)、部分缓解73例(62.39%)、疾病稳定12例(10.26%)、疾病进展0例。局部RFS为8.79~42.21月,中位时间21.71月(95%CI:20.36~23.95月);OS为11.90~51.2月,中位时间27.12月(95%CI:25.32~29.56月)。患者1~4年的局部无复发生存率分别为100%,65.14%,25.28%及10.21%,而总生存率分别为100%,83.23%,41.13%及19.38%。
2.3不同GPS患者的局部无复发率和总生存率 治疗前不同GPS患者的局部无复发生存率(χ2=6.325,P=0.042)和总生存率(χ2=6.638,P=0.039)差别均有统计学意义,治疗后不同GPS患者的局部无复发生存率(χ2=8.304,P=0.016)和总生存率(χ2=8.377,P=0.015)差别也均有统计学意义。治疗前后不同GPS变化组间的局部无进展生存率(χ2=26.406,P=0)和总生存率(χ2=19.325,P=0.001)差别均有统计学意义,生存曲线相对GPS1和GPS2差别更为明显(图1)。

A:治疗前不同GPS的RFS曲线; B:治疗前不同GPS的OS曲线; C:治疗后不同GPS的RFS曲线; D:治疗后不同GPS的OS曲线; E:治疗前后不同GPS的RFS曲线; F:治疗前后不同GPS的OS曲线.
2.4RFS和OS预后的单因素和多因素分析结果 单变量分析显示,性别、原发位置、治疗前后GPS评分和TNM分期Ⅳ期可影响局部RFS(P=0.048,0.043,0.029,0.021和0.036);原发位置、治疗前后GPS评分和TNM分期Ⅳ期可影响OS(P=0.045,0.032,0.024和0.042)。Cox比例风险模型多因素分析显示,治疗前后GPS评分和TNM分期Ⅳ期可影响RFS及OS(P=0.025,0.011,0.031和P=0.027,0.014,0.043,表2)。
2.5治疗相关副作用 治疗过程中,急性放疗毒副反应主要有放射性食管炎和放射性肺炎;化疗毒副作用主要有骨髓抑制和消化道反应(表3)。
2.6放射性食管炎与治疗前后GPS的相关性 各级放射性食管炎在治疗前后不同GPS值的例数分布见表4,χ2检验显示组间差别无统计学意义。
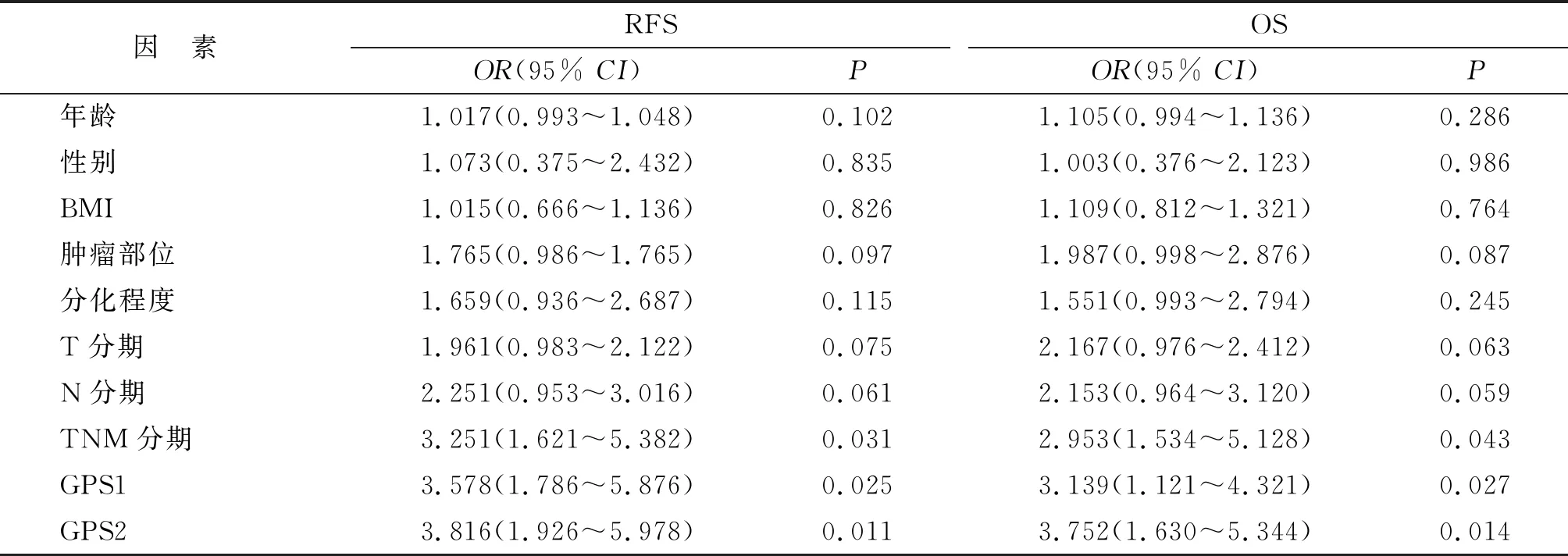
表2 影响RFS和OS的多因素分析
RFS:局部无复发生存时间;OS:总生存时间;BMI:指体质量指数;GPS1及GPS2:分别指治疗前及治疗后患者的格拉斯哥评分.

表3 治疗过程中的急性毒副反应

表4 放射性食管炎与GPS
3 讨 论
根据全球癌症流行病学统计显示,全球每年食管癌新发病例数约455 800例,死亡人数约400 200例[4]。中国是世界上食管癌发病率最高的地区之一,其5年生存率仅为20%[5]。食管癌的生物学特点往往具有较高局部复发率和远处转移率,总体预后差。对于局部晚期食管癌,近年来相关研究显示,同步放化疗可显著延长患者的中位生存期,但仍有部分患者无法从中获益。因此,探讨同步放化疗疗效评估的有效指标,也是提高疗效的基础[6]。
近年来,恶性肿瘤相关炎症反应与患者预后的关系成为研究热点。研究证实,炎症指标综合反映患者的营养水平和免疫状态,与恶性肿瘤的预后存在着密切关系[7-13]。GPS与预后的相关性已较为明确,其机制主要表现为肿瘤的慢性炎症反应导致患者的基础代谢增加、消耗增多、体质量下降、低蛋白血症,从而加快恶液质进程。研究证实,GPS用于肠癌、肝癌、胃癌、肾癌、食管癌、非小细胞肺癌和头颈部癌的术前疗效预测以及不能手术的实体瘤放疗、化疗或同步放化疗疗效的预测是可靠的[1-3]。本研究结果显示,治疗前后不同GPS患者的RFS和OS差别均有统计学意义,GPS高者生存率明显降低。Cox比例风险模型多因素分析也显示,治疗前后的GPS是影响RFS和OS的独立因素,与文献报道一致[1]。
本研究中,治疗前后GPS有变化者51例,其中治疗后好转者21例,恶化者30例;GPS变化不同的组别之间,RFS和OS差别均有统计学意义;生存曲线相对GPS1和GPS2差别更为明显。说明动态观察GPS用于预测局部晚期食管癌同步放化疗的疗效,相对于静态观察更有意义。其机制可能在于,肿瘤患者的炎症反应和免疫状态是一个动态的变化过程,特别对于局部晚期食管鳞癌患者,治疗前均有不同程度的进食受限,存在炎症反应和较差的营养状态,随着治疗的进行,疗效较佳的患者进食逐渐改善,GPS不断改善;而疗效较差者,肿瘤未明显退缩,放疗后局部炎症加重,GPS也进一步恶化[14-15]。Chang等的研究结果显示,不同治疗前GPS、治疗后GPS组间OS差别有统计学意义;GPS好转组的OS优于恶化组[15]。多因素分析显示,动态观察头颈部癌同步放化疗的GPS变化,相对于治疗前GPS,更有助于预测治疗的疗效。Otowa的研究也证实,通过动态观察食管癌新辅助治疗,26%患者GPS发生变化,其中好转16%、恶化10%,新辅助治疗前不同mGPS组间的OS和RFS差别无统计学意义,而新辅助治疗后不同mGPS组间以及治疗后不同mGPS组间(分成好转、稳定和恶化)的OS差别均有统计学意义,可以更准确地预测新辅助治疗的疗效[14]。另外,Quyen等研究显示,卡氏评分、体质量指数、能量和蛋白摄入等不影响GPS值[16],这也是GPS可以作为独立预后因素的原因。本研究结果显示,治疗后GPS评分的变化与放射性食管炎的程度无相关性。
总之,GPS是个简便、有效的肿瘤炎症指标,在临床上可用于预测肿瘤的疗效。动态观察治疗前后的GPS可更好预测局部晚期食管鳞癌放化疗的疗效。但本研究病例数较少,结果的可靠性还需进一步扩大病例数加以证实。

