IL-1β对华勒变性早期雪旺细胞增殖与凋亡的影响
罗晓荷,陈 刚,王宜梅,王 炜,朱 飞
再生医学作为极具潜力的新兴医学领域,通过修复、替换或再生器官和组织的方式恢复受损组织的功能[1]。人类具有有限的再生修复组织和器官的能力,当周围神经损伤后即发生华勒变性(wallerian degeneration,WD),损伤处残存的雪旺细胞(schwann cells,SCs)的数量和增殖分化能力是影响神经再生修复的关键因素。在此过程中SCs去分化,分泌大量生长因子,促进轴突生长和髓鞘形成,从而促进神经的再生修复[2]。同时,受损的周围神经系统产生白细胞介素-1β(interleukin-1β,IL-1β)和其他炎症因子,参与一系列免疫应答反应。既往研究[3-4]证明IL-1β在组织再生过程中发挥多种作用。例如促进血管平滑肌的增殖,促进髓核细胞增殖等。由此推断,除了参与WD中的免疫应答作用,IL-1β对SCs的增殖和凋亡也具有一定影响。该研究将观察周围神经系统WD早期IL-1β对SCs增殖和凋亡的影响,并探讨其相关作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 6~8周龄清洁级雄性SD大鼠18只,体质量220~260 g,饲养环境温度为18~26 ℃,相对湿度为40%~70%,由上海交通大学附属第九人民医院中心实验室提供。
1.1.2主要试剂 胎牛血清FBS、DMEM高糖培养液购自美国Invitrogen公司;三抗(100×青霉素、链霉素、两性霉素B)购自美国GIBCO公司;重组大鼠IL-1β购自美国R&D Systems公司;96孔培养板、6孔培养板、90 mm培养皿、50 ml离心管购自美国BD公司;RIPA裂解液购自连云港碧云天公司;anti-Ki67 antibody、anti-Bax antibody、anti-Bcl-2 antibody购自美国Abcam公司;Tunel法凋亡检测试剂盒购自美国罗氏公司。
1.1.3主要仪器 仪器:流式细胞仪购自美国BD公司;CO2培养箱购自德国HERAEUS公司;光学显微镜购自日本Olympus公司;立体解剖显微镜购自日本Carl Zeiss Jena公司;超净工作台购自苏州净化设备厂;离心机购自上海手术器械公司;酶联免疫检测仪购自美国Thermo公司。
1.2 方法
1.2.1体外WD模型的制备 参照Thomson et al[5]于1993年报道的vitroWallerian degeneration制备方法,并根据实验需要进行了改进所制备的体外WD模型。制备过程:将6~8周龄健康雄性SD大鼠麻醉后处死,75%酒精浸泡消毒,于超净台俯卧位固定,暴露坐骨神经全长,切取大鼠坐骨神经全长,立体解剖显微镜下去除神经外膜,将神经分成絮状神经丝,置于含10%胎牛血清FBS和100 U/ml青霉素、100 mg/ml链霉素、0.25 mg/ml两性霉素B的DMEM培养液中,于37 ℃、5%CO2培养箱进行体外培养。
1.2.2免疫荧光染色法检测增殖标记Ki67表达情况 将去除神经外膜的大鼠坐骨神经组织离体后于体外WD模型中培养,给予不同浓度IL-1β干预(0 ng/ml和5 ng/ml)。干预培养48 h,收集坐骨神经组织样本,PBS洗涤2次;4%多聚甲醛固定15 min;弃除固定液,PBS洗涤3次;1%BSA封闭液封闭60 min;加入200 μl Ki67一抗(1 ∶100稀释)4 ℃孵育过夜;PBS洗涤3次;加入荧光标记的二抗,避光37 ℃孵育60 min;PBS洗涤3次;加入DAPI(1 ∶1 000)避光37 ℃孵育60 min,PBS洗涤3次;抗荧光淬灭封片剂封片,荧光显微镜下观察并计数。
1.2.3Tunel法细胞凋亡染色 去除神经外膜的大鼠坐骨神经组织离体后于体外WD模型中培养,给予不同浓度IL-1β干预(0 ng/ml和5 ng/ml)。干预培养48 h,收集坐骨神经组织样本,PBS洗涤2次;4%多聚甲醛固定15 min;弃除固定液,PBS洗涤3次;用0.1%枸橼酸钠缓冲液配0.1%的Triton X-100,冰上孵育2 min;PBS浸泡3次;加入Tunel反应液,37 ℃避光孵育1 h;PBS避光浸泡2次;DAPI染核,37 ℃避光孵育30 s;PBS避光浸泡3次;荧光封片剂封片,荧光显微镜下观察并计数,Tunel试剂标记红色和DAPI标记的蓝色同时阳性才被认为是凋亡细胞。
1.2.4Western blot检测B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2关联X蛋白(Bcl-2 assaciated X protein,Bax)蛋白表达 去除神经外膜的大鼠坐骨神经组织经体外WD模型中不同浓度IL-1β干预(0 ng/ml和5 ng/ml)后24 h收集样本,提取组织总蛋白,通过BCA法检测蛋白浓度并调整样品蛋白浓度后进行聚丙烯酰胺凝胶电泳,转移到聚偏二氟乙烯PVDF膜,放入5%BSA中封闭1 h,加入一抗4 ℃孵育过夜,TBST洗涤3次,二抗室温孵育1 h,TBST洗涤3次,显影仪扫描。
2 结果
2.1 IL-1β对体外WD模型中SCs增殖的影响不同浓度IL-1β干预培养48 h后,免疫荧光标记的Ki67均主要位于细胞核内;5 ng/ml浓度的IL-1β干预后,大鼠坐骨神经组织中SCs Ki67表达量较0 ng/ml浓度组有所升高(图1)。统计两组SCs的Ki67阳性率显示,5 ng/ml浓度组Ki67阳性率较0 ng/ml浓度组升高,差异有统计学意义(P<0.01)。见表1。

表1 不同浓度IL-1β干预后SCs Ki67阳性细胞和凋亡细胞比例
2.2 IL-1β对体外WD模型中SCs凋亡的影响Tunel阳性主要位于细胞核内;5 ng/ml IL-1β干预48 h后,大鼠坐骨神经组织中SCs Tunel表达量较0 ng/ml浓度组有所降低,见图2。统计两组SCs的Tunel阳性率显示,5 ng/ml浓度组Tunel阳性率较0 ng/ml浓度组降低,两组间差异有统计学意义(P<0.05)。见表1。
2.3 IL-1β对体外WD模型中Bcl-2和Bax蛋白表达情况的影响不同浓度IL-1β干预培养24 h后,用Western blot检测大鼠坐骨神经组织样本中Bax和Bcl-2表达量,并以β-actin作为内参。实验重复3次,分别检测5 ng/ml浓度组和0 ng/ml浓度组体外WD模型中Bcl-2和Bax表达量,统计分析两组体外WD模型中Bcl-2和Bax表达量差异,见图3、表2:5 ng/ml浓度组较0 ng/ml浓度组SCs凋亡抑制蛋白Bcl-2表达量升高(P<0.05);5 ng/ml浓度组较0 ng/ml浓度组凋亡促进蛋白Bax表达量降低(P<0.05)。这与Tunel法凋亡染色结果一致。进一步统计Bcl-2/Bax比例的差异,分析显示,5 ng/ml组较0 ng/ml组中SCs凋亡抑制蛋白Bcl-2/凋亡促进蛋白Bax表达量比例升高(P<0.05)。

表2 不同浓度IL-1β干预后SCs中Bcl-2和Bax蛋白表达量及其比值
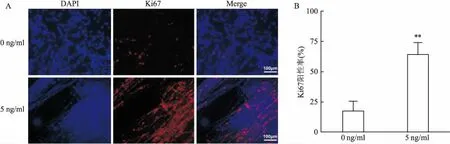
图1 不同浓度IL-1β干预48 h后SCs Ki67表达情况 A:免疫荧光染色×100;B:SCs Ki67阳性率;与0 ng/ml组比较:**P<0.01
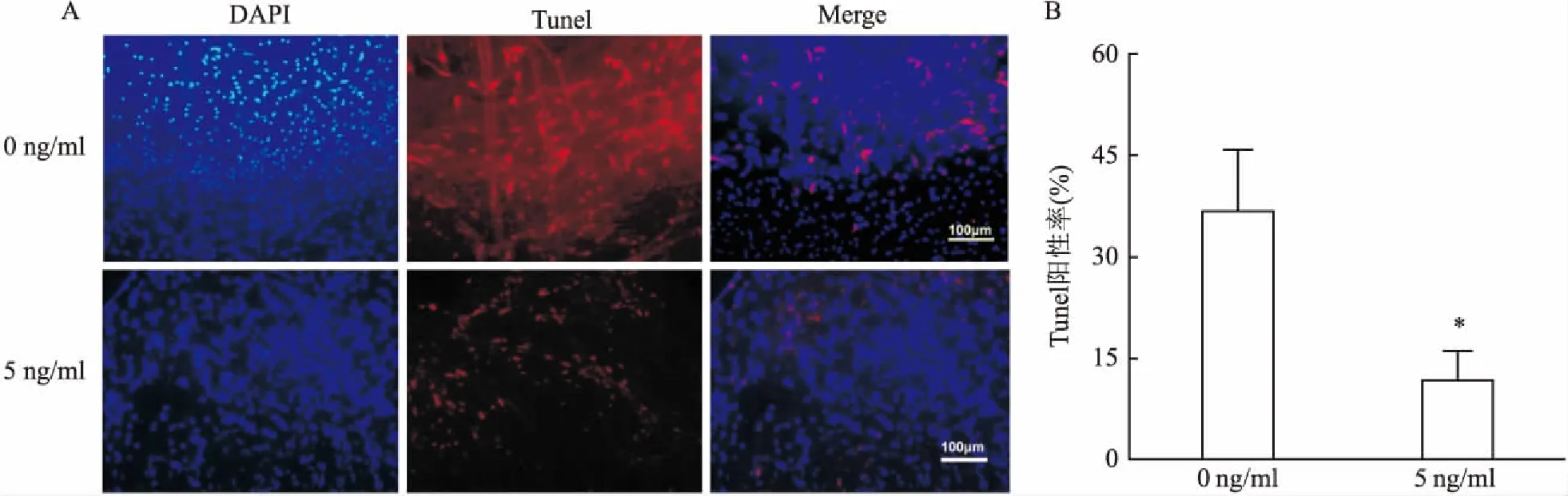
图2 不同浓度IL-1β干预48 h后SCs凋亡情况A:免疫荧光染色×100;B:SCs Tunel阳性率;与0 ng/ml组比较:*P<0.05

图3 不同浓度IL-1β干预24 h后SCs中Bcl-2和Bax蛋白表达情况A:Western blot检测Bcl-2和Bax蛋白表达; B: Bcl-2;C: Bax; D: Bcl-2/Bax;与0 ng/ml组比较:*P<0.05
3 讨论
在周围神经损伤发生WD的过程中,损伤处残存的SCs自发去分化和增殖,促进髓鞘形成和轴突再生。同时,受损的周围神经系统产生的IL-1β等多种炎症因子在神经损伤修复的过程中发挥重要作用。既往研究[6]表明IL-1β可增加损伤区域SCs神经生长因子的表达量,促进神经元存活及轴突生长,并诱导巨噬细胞清除髓鞘碎片,从而促进周围神经再生。但IL-1β对SCs增殖和凋亡作用的研究鲜有报道。
Ki67是一种核抗原,作为细胞增殖的特异性和敏感性标志物,是检测细胞增殖的可靠指标。Ki67在G0期和G1早期无表达,于G1中后期开始表达,位于细胞核周围区,S期、G2期表达逐渐增加,M期达到峰值[7]。本研究通过免疫荧光染色标记坐骨神经WD早期过程中SCs Ki67,并量化分析IL-1β干预前后其表达的阳性率差异。本研究显示适当浓度IL-1β干预后SCs Ki67表达量增加,Ki67阳性率升高,可见IL-1β具有促进坐骨神经WD早期SCs增殖的作用。
检测细胞增殖情况后,本研究进一步采用Tunel法凋亡细胞染色检测并分析IL-1β干预前后细胞凋亡率差异。结果显示适当浓度IL-1β可降低坐骨神经WD早期SCs凋亡率,抑制其细胞凋亡。细胞凋亡是由基因调控的细胞自主的程序性死亡。通常,促凋亡蛋白和抗凋亡蛋白之间的平衡是确定细胞是否经历凋亡的关键点[8]。Bcl-2蛋白家族则在其中扮演着重要角色,根据对细胞凋亡调控作用的不同及同源结构的不同,将Bcl-2蛋白家族分为3个亚组,一组具有抗凋亡作用,其他两组具有促凋亡作用, Bax和Bcl-2是该家族的主要成员,其在人体细胞中的作用受到广泛关注[9]。Bax和Bcl-2是同源基因,Bcl-2具有抗细胞凋亡作用。Bax是Bcl-2的拮抗基因,对Bcl-2具有拮抗作用。Bcl-2对细胞凋亡的影响与Bcl-2和Bax比例的变化密切相关,两者比例的改变决定了凋亡信号刺激后细胞发生凋亡或存活的最终命运[10]。Bcl-2基因可在多种正常细胞的刺激和发育中表达,但在成熟或凋亡细胞中不表达或最低限度表达。研究[11]表明Bcl-2通过多种途径联合作用调节细胞凋亡,其机制主要包括:抑制促凋亡细胞色素C从线粒体释放后进入细胞质;抗氧化作用和维持细胞内钙离子的平衡;阻止细胞质中的细胞色素C激活caspase,抑制DNA裂解[12]。Bax是一种关键的促凋亡蛋白,主要存在于细胞质,发生凋亡时,Bax易位到线粒体膜,形成同源二聚体促进凋亡,当与Bcl-2形成异源二聚体时,凋亡作用则被抑制。
通过Western blot检测显示,适当浓度IL-1β干预后WD早期抗凋亡蛋白Bcl-2表达量增加,促凋亡蛋白Bax表达量降低。统计结果显示适当浓度IL-1β干预后WD早期SCs Bcl-2/Bax表达量比例升高。这与Tunel法凋亡细胞染色结果一致表明适当浓度IL-1β可抑制坐骨神经WD早期SCs的凋亡。
综上所述,适当浓度的IL-1β可以促进WD早期SCs的增殖,并增加抗凋亡蛋白Bcl-2表达,降低促凋亡蛋白Bax的表达,从而抑制SCs凋亡。该研究对探寻局部组织损伤后炎症因子对组织再生的作用具有重要意义,为周围神经再生修复的治疗提供理论基础,值得进一步深入探讨。其确切的作用机制是下一步研究的重点。

