Box-Behnken响应面优化酒黄精多糖的超声提取工艺及其抗氧化活性研究
蔡兴航,谢 培,史鑫波,侯 青,黄文静
(1.陕西中医药大学 陕西省中药资源产业化协同创新中心,陕西 咸阳 712046;2.陕西中医药大学,陕西 咸阳 712000)
黄精是作为大宗药食同源植物之一,化学成分主要包括多糖、甾体皂苷、生物碱、木脂素、黄酮等,其中多糖和甾体皂苷类成分在黄精中含量较大,为其主要药效成分[1-6]。黄精多糖具有调节免疫力、改善记忆功能、抗抑郁、降血糖、调血脂和抗动脉粥样硬化等作用[7-13]。黄精经酒制后,不仅可以消除刺激性,而且能增强补益疗效[14],经推断或与酒黄精中新的化合物有关[15]。目前,鲜有酒黄精多糖抗氧化研究报道,所以本研究拟酒黄精为研究对象,通过超声波法对酒黄精多糖进行提取,并用Box-Behnken响应面法进行工艺条件优化,通过评价酒黄精多糖对DPPH自由基清除率,以及对SW620细胞抗氧化活性的影响,探寻酒黄精多糖的抗氧化作用,为酒黄精多糖的深层次开发提供有效的技术支持。
1 材料
实验所用材料购于陕西兴盛德药业有限责任公司。由陕西中医药大学刘世军副教授鉴定为酒黄精饮片。无水D-葡萄糖对照品(批号110833-201205,中国食品药品检定研究院)。浓硫酸、苯酚购于天津市凯信化学工业有限公司,所用试剂均为分析纯。
2 方法
2.1 酒黄精多糖的制备
将酒黄精样品用粉碎机粉碎,用石油醚回流脱脂2次,每次回流3 h。称取10 g脱脂酒黄精,以水为介质,按一定料液比、超声时间、温度提取,真空抽滤,离心去沉淀取上清液,用Sevage试剂(氯仿-正丁醇4:1)脱蛋白3次,溶液离心15 min(4 000 r·min-1),所得上清液进行抽滤,抽滤的上清液用4倍量80%乙醇沉淀,最后冷冻干燥沉淀物为酒黄精多糖[16],待用时,用蒸馏水配比为一定浓度。
2.2 酒黄精多糖的测定
采用苯酚-硫酸法进行酒黄精多糖测定,参照杜鹏瑶等[17]的方法,略有修改。称取25 mg葡萄糖溶解于适量的水中,然后定容于250 mL容量瓶中,配置成浓度为0.1 mg·mL-1的葡萄糖标准溶液。分别吸取上述标准溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,置于25 mL刻度试管中,依次加蒸馏水使其定容至2 mL,另以2 mL蒸馏水作为空白对照。然后加入1 mL浓度为5%的苯酚溶液,继续加入5 mL浓硫酸,置入4℃水浴中10 min,取出置于室温。每个刻度试管中取出200 μL溶液加入96孔酶标板中,用酶标仪在490 nm波长处测定其吸光度,所制得葡萄糖标准曲线为y=14.388x+0.1073,R2=0.999,线性关系良好。
酒黄精多糖含量的测定:取2 mL上述样品,加入1 mL浓度为5%的苯酚溶液,混匀,在加入5 mL浓硫酸溶液,摇匀放入冰水浴中10 min,取出放置室温,在波长490 nm处测其吸光度值。利用所得方程式计算出黄精多糖的得率,计算公式如下:
酒黄精多糖提取率(%)=(葡萄糖质量浓度×稀释倍数×提取液体积)/样品质量×100%
2.3 单因素试验
按照“2.1、2.2”项工艺流程,每次称取10 g酒黄精预处理粉末,考察3个因素对酒黄精多糖提取率的影响。单因素条件如表1所示。
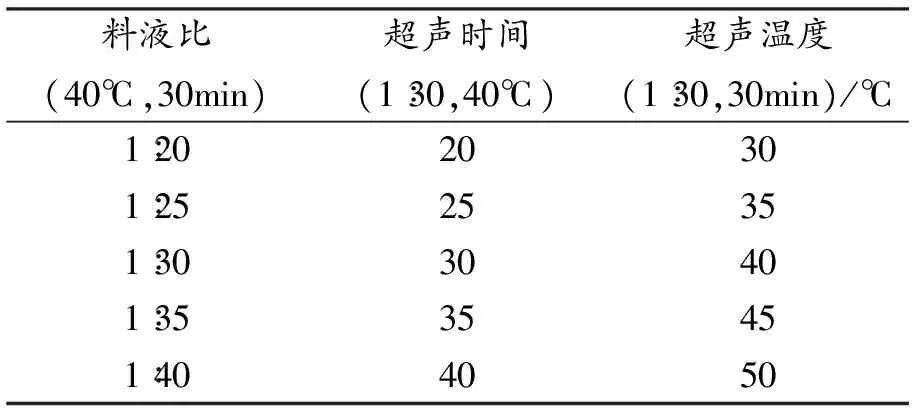
表1 单因素条件
2.4 响应面优化
在单因素的基础上,确定提取料液比(A)、超声时间(B)、超声温度(C)3个因素,用Box-Behnken响应面法优化3因素3水平试验,试验因素水平及编码见表2。
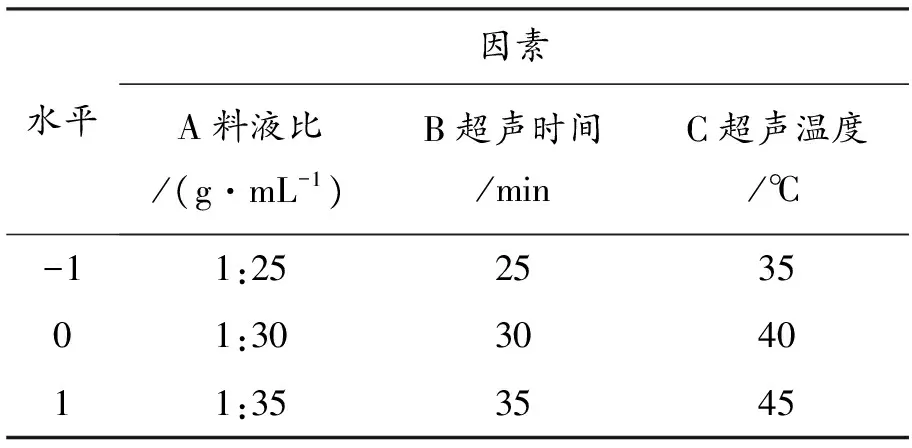
表2 试验因素水平及编码
2.5 酒黄精多糖抗氧化活性的研究
2.5.1 对DPPH自由基的清除作用 参照许女和冯书珍两人[18-19]的方法进行DPPH自由基清除测定,取1 mL不同质量浓度的酒黄精多糖溶液,加入1 mL用无水乙醇作为溶剂制成0.1998 mmol·L-1DPPH溶液,置于避光条件下30 min,取200 μL待测液加入酶标板中,用全波长扫描酶标仪在517 nm处测定其吸光度(AS),无水乙醇溶液代替DPPH乙醇溶液测定AC,蒸馏水代替酒黄精多糖溶液测定A0。清除率计算公式如下:
清除率/%=1-(AS-AC)/A0×100%
2.5.2 酒黄精多糖提取物对细胞抗氧化活性的作用 酒黄精多糖的细胞抗氧化活性评价采用Wolfe的方法[20]。将100μL培养好的SW620细胞接种于96孔板中(每孔细胞数计数为6×104个),每个浓度样品重复4个平行,放置于37℃、5%CO2细胞培养箱中贴壁培养20 h,然后取出弃去上清液,用无血清培养基将每孔各清洗一次。然后各孔依次加入用100 μl完全培养基配制的不同浓度的酒黄精多糖提取物和槲皮素标准液,空白各孔和对照各孔加入完全培养基替代样品提取液。将96孔板继续放入细胞培养箱中孵育1 h,然后取出并弃掉各孔上清液,每孔加入100 μL PBS盐水清洗一次,每孔再分别加入100 μL浓度为600 μmol·L-1的AAPH溶液(空白孔加入浓度为10 mmol·L-1Hepes的HBSS溶液),然后用酶标仪在490 nm波长条件下检测各孔荧光值,按照标准检测方法检测细胞抗氧化活性(CAA值),并以μmol槲皮素当量/100 g样品(μmol QE/100 g样品)来表示。
3 结果与分析
3.1 不同提取条件下单因素实验结果
料液比对酒黄精多糖得率的影响如图1所示。当料液比在1:20~1:30(g·mL-1)之间时,得率呈现上升趋势;当料液比为1:30(g·mL-1)时,得率为7.6%,达到最大,;当料液比在1:30~1:40(g·mL-1)之间时,得率随料液比的增加而下降,因此以料液比为1:30最为合适。
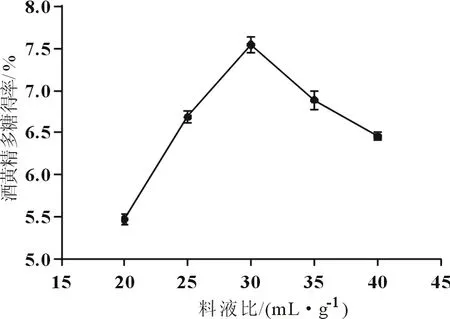
图1 料液比对酒黄精多糖得率的影响
超声时间对酒黄精多糖得率的影响如图2所示。当超声时间在20~30 min范围内时,得率呈现上升趋势;当超声时间为30 min时,得率为7.56%,达到最大;当超声时间在超过30 min,得率随时间的增加而下降;可能是因为过长时间的超声破坏了多糖分子链稳定性,导致得率降低,因此,超声时间为30 min最为合适。

图2 超声时间对酒黄精多糖得率的影响
超声时间对酒黄精多糖得率的影响如图3所示。当超声时间在30~40℃范围内时,得率随超声温度呈现上升趋势;当超声温度为40℃时,得率为7.52%,达到最大;当超声温度在40~50℃范围内时,得率随温度的增加而下降;因此,超声时间为40℃最为合适。
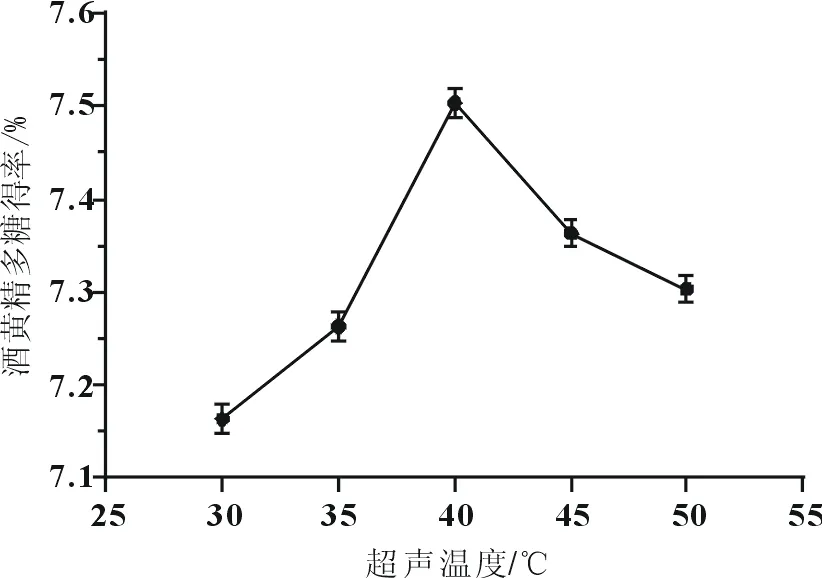
图3 超声温度对酒黄精多糖得率的影响
3.2 响应面优化提取条件
3.2.1 响应面试验结果分析 采用Box-Behnken响应面设计试验,根据表1中3因素3水平编码设计试验方案,结果与分析如表2,方差分析结果见表3。
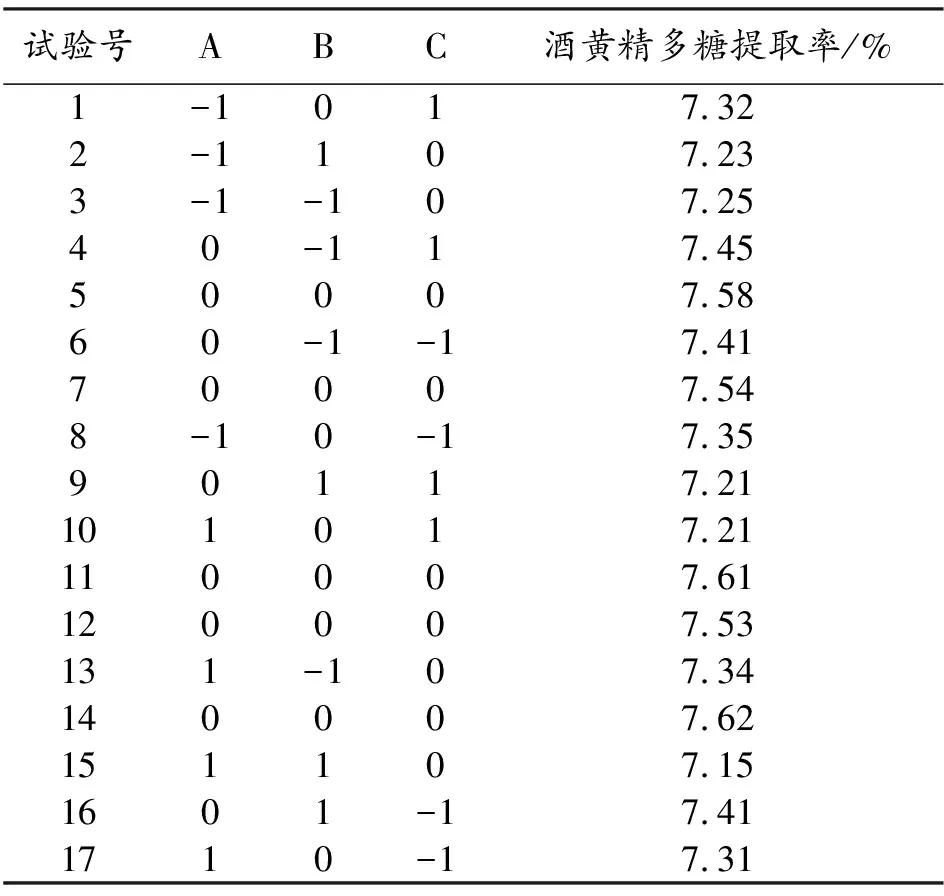
表3 酒黄精多糖提取工艺优化响应面试验结果与分析
通过Design-Expert.V8.0.6软件进行回归分析,得料液比、超声时间和温度对酒黄精多糖提取率影响的二次多项回归方程:Y=7.58-0.018A-0.056B-0.036C-0.042AB-0.018AC-0.06BC-0.2A2-0.13B2-0.076C2。由表3可知,该模型达极显著水平(P<0.01),失拟项不显著(P=0.5991>0.05)。所以,该二次方程模型拟合度较好,能够准确反映3因素对酒黄精多糖提取率的影响,表明此模型适用于工艺优化。从表3可以看出,一次项B和二次项A2、B2、C2对结果影响极显著(P<0.01),一次项C和交互项BC对响应值影响显著(P<0.05),一次项A和交互项AC、AB对响应值影响不显著(P>0.05)。通过比较个性F值可知,对酒黄精多糖提取率影响最大的是超声时间,其次是超声温度,最小的是料液比。
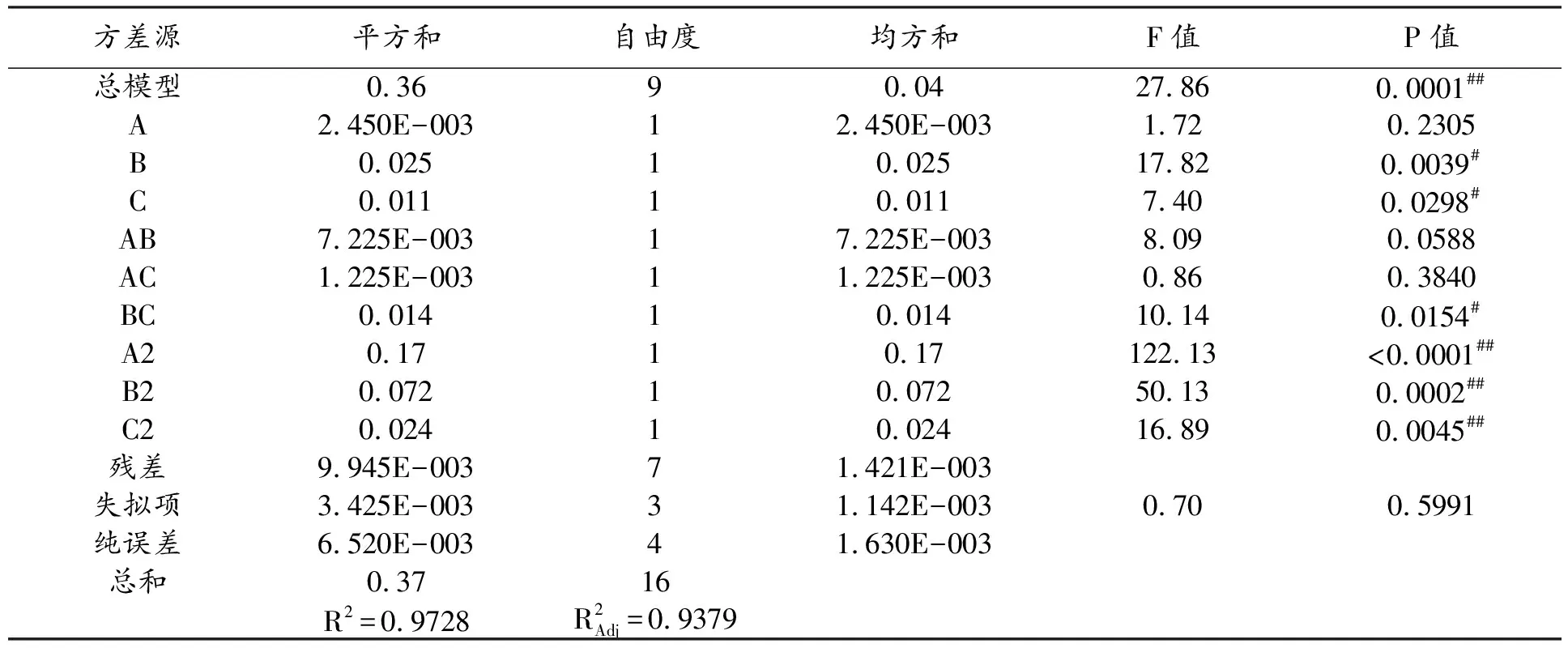
表4 回归模型的方差分析
注:##P<0.01,差异极显著;#P<0.05,差异显著。
3.2.2 响应面图分析 通过多元回归方程作三维效应曲面图和二维平面等高线图,从图4可以直观分析三个因素之间交换作用以及对多糖得率的影响。
由图4可知,A与B、A与C对酒黄精多糖得率的影响均不显著(P>0.05),B与C交互作用显示,B变化曲面比C变化曲面陡峭;等高线沿B方向变化稍高于C方向呈椭圆形,表明B对响应值的影响比C稍大,二者之间交互作用显著(P<0.05)。
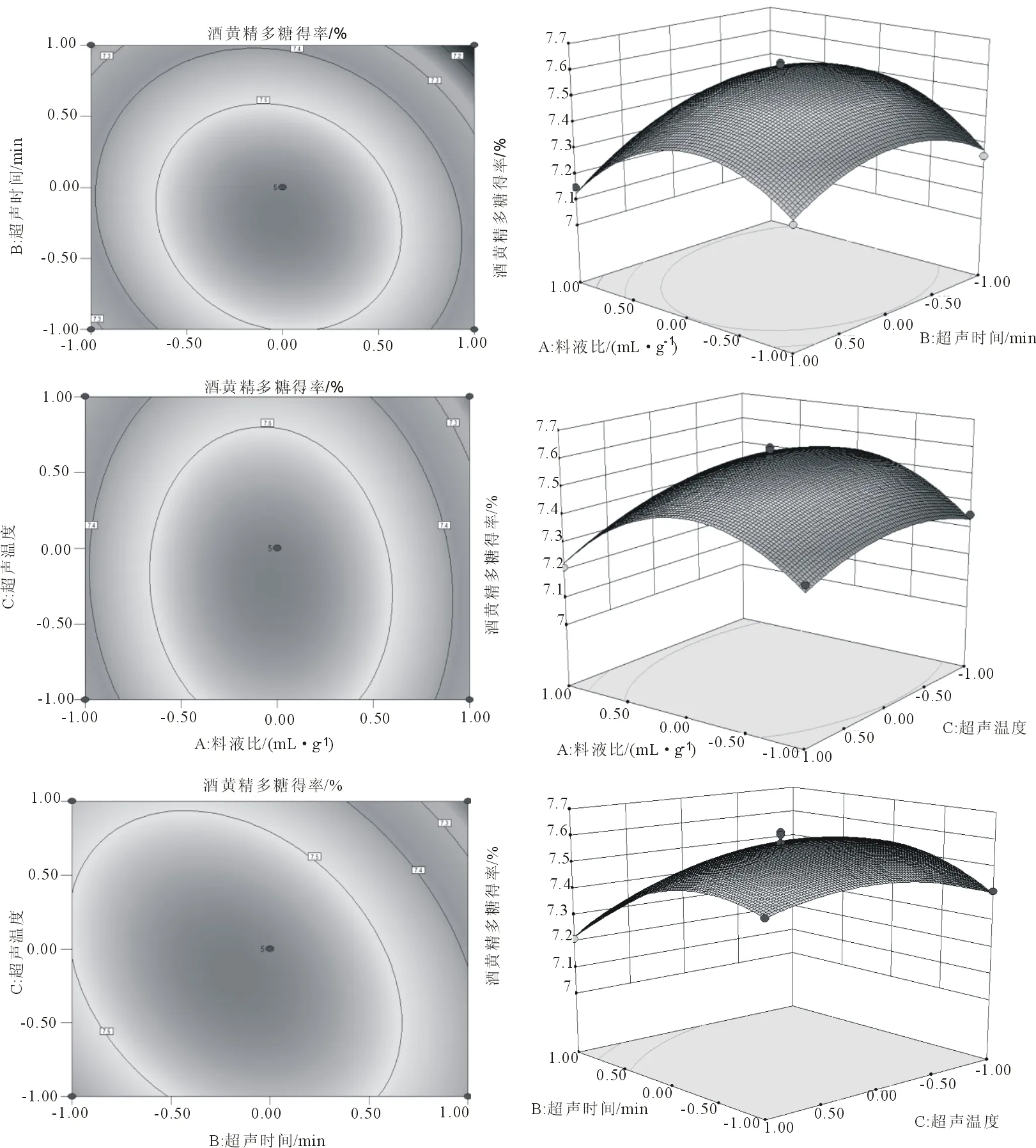
图4 A与B、A与C、B与C对酒黄精多糖提取率的响应面图和等高线
3.2.3 最佳条件优化及验证 根据响应面分析确定最佳工艺参数为:料液比为1∶32.84(g·mL-1),超声时间为28.69 min,超声温度38.99℃,对应酒黄精多糖提取率为7.52%。考虑试验操作的方便性,调整各因素为整数,料液比为1∶33(g·mL-1),超声时间为29 min,温度39℃,在上述条件下进行3次平行试验,得出酒黄精多糖实际得率为(7.49±0.08)%,与回归方程预测值基本符合,所以该模型有效。
3.3 抗氧化活性
3.3.1 酒黄精多糖对DPPH清除作用 从图7可知,酒黄精多糖浓度与DPPH自由基的清除率呈现正相关的趋势,在从0.2~0.92 mg·mL-1范围内呈一定量效关系。当酒黄精多糖质量浓度为0.9104 mg·mL-1时清除达到76.50%。

图5 不同浓度酒黄精多糖对DPPH·的清除作用
3.3.2 酒黄精多糖对细胞抗氧化活性的影响 采用CAA法对酒黄精多糖提取物细胞抗氧化活性评价表明(图8),根据预实验结果选取5~80 μg·mL-1作为工作浓度,酒黄精多糖抗氧化活性呈正相关,限值为80 μg·mL-1(工作浓度),具有最大的细胞抗氧化活性CAA值(12.31±0.78 μmol QE·100 g-1)。初步证实该提取法所得的酒黄精多糖都具有抗氧化活性,并呈浓度依赖性。
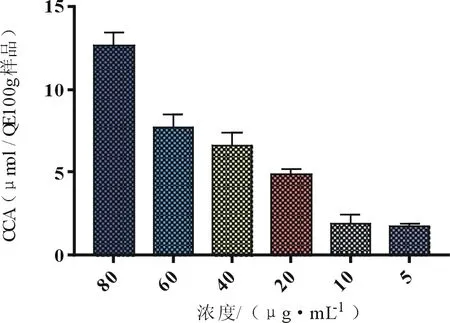
图6 超声法提取酒黄精多糖细胞抗氧化(CAA)活性
4 结论
笔者实验在单因素试验的基础上,采用Box-Behnken响应面法设计试验并及优化酒黄精多糖的超声提取工艺,所得的二次方程模型拟合度较好,失拟项不显著(P=0.5991>0.05),拟合度好,能够准确地反应料液比、超声时间、温度对酒黄精多糖提取率的影响。所得最佳工艺条件为:料液比1∶33,超声时间29 min、超声温度39℃。在此最优提取条件下,提取时间短,酒黄精多糖提取率高达7.49%。通过抗氧化研究发现,当酒黄精多糖浓度在0.2~0.92 mg·mL-1范围内呈一定量效关系,酒黄精多糖质量浓度为0.9104 mg·mL-1时清除达到76.50%。当酒黄精多糖浓度在5~80 μg·mL-1作为工作浓度时,抗氧化活性与浓度呈正相关,限值为80 μg·mL-1(工作浓度),具有最大的细胞抗氧化活性CAA值(12.31±0.78 μmol QE·100 g-1),表明酒黄精多糖具有一定的抗氧化能力。利用超声波法对酒黄精多糖进行提取,可以节约时间,提升工作效率。酒黄精具有较大的开发潜力,本研究可为酒黄精的综合开发利用提供理论依据。

