水热合成二氧化钛纳米颗粒及光致发光性能研究
付 新
(渭南师范学院化学与材料学院,陕西渭南714099)
TiO2因其无毒、高效、价格低廉等优点,一直以来备受人们的青睐,成为目前研究最多且应用最广泛的纳米材料之一[1]。纳米TiO2在很多领域都有着广泛应用,例如:光催化剂、废水处理、染料废物的降解及燃料电池等领域[2-4]。目前,可以通过不同的方法诸如化学沉淀法、水热合成法等控制合成纳米TiO2颗粒[5-6]。 M.Niederberger等[7]利用溶胶-凝胶法制备得到了小于10 nm的锐钛矿TiO2纳米颗粒。G.Melcarne等[8]通过水热合成法得到了直径较小的棒状TiO2纳米颗粒。M.Sedlacik等[9]利用微波辅助的熔盐法得到了棒状的TiO2纳米颗粒。相比于其他制备纳米TiO2的方法,水热合成法具有无污染、产品纯度高、操作简便等优点。本文采用价格低廉的钛酸丁酯为钛源,通过改变十六烷基三甲基溴化铵(CTAB)的量,制备得到了不同粒径的锐钛矿纳米TiO2颗粒,分析了粒径大小,讨论了颗粒堆积所形成的孔结构,探讨了粒径和孔径大小对TiO2纳米颗粒光致发光性能的影响。
1 实验方法
1.1 原料与试剂
钛酸丁酯(C16H36O4Ti),质量分数为 98%,AR;十六烷基三甲基溴化铵(C19H42BrN),质量分数为99.0%,AR;无水乙醇(CH3CH2OH),质量分数为 99%,AR;以及一些常用试剂。
1.2 仪器与设备
电子天平,AL204;立式电热鼓风干燥箱,DHG-9005A(300℃规格);马弗炉,KSL-1700X;氮吸附仪,ASAP 2406;X 射线衍射仪,XRD-6100; 荧光光谱仪,F-7000;扫描电镜,SIGMA 500;水热反应釜(100 mL);磁力搅拌机。
1.3 合成方法
第一步,称取一定量的CTAB,并满足n(CTAB)/n(Ti)分别为 0.25%、0.5%、0.75%、1.0%,分别溶于盛有30 mL去离子水的烧杯中,并在600 r/min的转速下搅拌30min,使模板剂充分溶解,直到溶液变透明。
第二步,用小烧杯分别称取30 g钛酸丁酯,并用胶头滴管以0.5滴/s的速度分别滴入相应的模板剂溶液中,待滴定结束后,继续搅拌30 min。
第三步,用玻璃棒将第二步所得到的4种溶液分别搅拌均匀,将其依次倒入相应的水热反应釜中,置于鼓风干燥箱中,并在180℃下保温600 min。
第四步,待水热反应结束后,将所得到的溶液分别抽滤,然后将所得白色沉淀放入鼓风干燥箱。等水分烘干后,置于马弗炉中,在300℃下煅烧50 min,从而得到TiO2纳米材料。所得样品分别记为:TiO2-1、TiO2-2、TiO2-3、TiO2-4。
2 结果与讨论
2.1 XRD分析
图1为不同模板剂添加量下所得样品的XRD谱图。由图1可以看出,在模板剂添加量不同时,所得XRD谱图均具有相同的衍射峰,衍射峰位置与锐钛矿TiO2的JCPDS标准卡片相对应,8个主要衍射峰对应锐钛矿的(101),(004),(200),(105),(211),(204),(220),(215)晶面特征峰,没有发现其他杂质的衍射峰,由此表明所有样品晶型相同均为锐钛矿型,且在 2θ为 25.46°附近出现最强峰[10]。 但是,因为模板剂添加量的不同,TiO2材料所对应衍射峰的强度以及峰宽都不一样,并且在添加量为0.5%时,谱图中(101)晶面的衍射峰相对较宽,表明晶粒尺寸相对较细小。根据谢乐公式:D=Kγ/Bcosθ(其中K为常数;D为晶粒粒径;γ为衍射线波长,0.154056 nm;B为实测样品衍射峰的半高宽;θ为衍射角)[8],计算出在添加量为0.5%时,晶粒尺寸为12.8 nm。同样,可得添加量为0.25%、0.75%及1.0%时,晶粒尺寸分别为24.2、19.6、21.7 nm。由此可见,当模板剂添加量为0.5%时,所获得的晶粒尺寸最小。
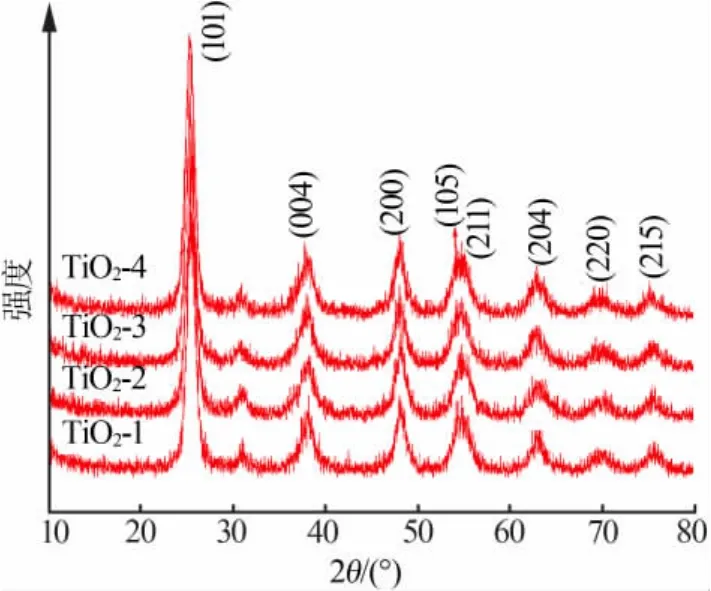
图1 4组样品的XRD谱图
2.2 扫描电镜分析
图2 为4组样品的SEM图片。由图2得出,不同添加量所得的TiO2纳米材料形貌基本一致,都由纳米颗粒堆积而成,但颗粒大小有所区别,颗粒与颗粒之间形成了一定的孔隙。在添加量为0.25%时(图2a),纳米颗粒直径约为12~30 nm,堆积形成的孔径约为8~15 nm;在模板剂添加量为0.5%时(图2b),其颗粒直径约为8~20 nm,孔径约为5~12 nm;随着添加量增加到0.75%时(见图2c),所得样品的直径约为 10~25 nm,孔径约为 5~12 nm;当添加量为1.0%时(图2d),所得TiO2纳米颗粒粒径约为 12~28 nm,孔径约为5~12 nm。由于纳米粒子其本身表面活性较大,容易引发团聚现象,而过多的模板剂缩短了粒子之间的距离,导致水分子与羟基结合形成的氢键相互作用,从而生成了新的化学键,引起纳米颗粒的大量堆积[5]。随着模板剂添加量的不同,所生成的TiO2纳米颗粒粒径有所区别,由纳米颗粒堆积所形成的孔径之间也有所差异。所以适量的模板剂可以抑制颗粒间的毛细管力、静电引力、范德华力等相互作用力,从而得到了分散性较好的纳米颗粒。

图2 4组样品的SEM图
2.3 氮吸附
采用氮吸附分析所制备TiO2纳米材料的孔结构。图3是不同模板剂下所制备的4组TiO2纳米材料N2吸附等温线和BJH孔径分布图。从图3a可以看出,等温线随相对压力的变化基本呈现出3个特征。1)低比压段,P/P0小于0.3时,该段曲线平缓,在这一阶段,N2分子以单层到多层的形式吸附于材料介孔内表面。2)中等比压段,P/P0为0.3~0.85时,吸附等温线的斜率迅速增大,这是样品发生毛细凝聚现象所引起的。并且,此段曲线的突越幅度明显,说明样品的孔径分布比较均匀,有序度较高。3)高比压段,P/P0>0.85,N2的吸附量随着P/P0的增大呈现出较为缓和的增加,说明此阶段有着多层吸附,TiO2表层以单层到多层的形式吸附N2分子。由以上结果可确定所合成的4组材料具有典型的介孔结构。

图3 4组TiO2纳米材料的氮气洗脱附等温线(a)及孔径分布图(b)
从图3b结合表1可以看出,4组样品具有较窄的孔径分布,随着模板剂添加量的增加,孔径逐步减小,比表面积逐步增大,但孔容基本没变化。所有样品的孔径主要集中在10 nm左右,当模板剂添加量为0.25%时,孔径分布主要位于10.5 nm;当添加量增加到1.0%时,孔径分布位于8.0 nm。以上结果充分说明随着CTAB用量的不断增大,TiO2纳米颗粒的尺寸会发生变化,堆积所形成的孔结构比表面积不断增加,孔径逐步减小。

表1 不同模板剂添加量下TiO2纳米材料的氮吸附数据
2.4 荧光光谱
图4是不同模板剂添加量下的光致发光光谱。从图4 可见,TiO2-1、TiO2-2、TiO2-3、TiO2-4 发射峰的中心位置分别集中在 378、393、378、375 nm。发射峰的强度随着模板剂添加量的增加,出现了先增大后减小的趋势,其中TiO2-2发射峰的强度最大。造成这种现象的主要原因是TiO2-2颗粒尺寸较小,受到纳米颗粒的限域效应[11],电子-空穴对在小体积中运动,增加了颗粒内部的内应力,导致电子波函数重叠加大,从而形成了强发射峰。此外,TiO2-2的发射峰的中心位置393 nm相比于其他3组样品的发射峰中心位置发生了明显的红移。这主要是由于受到量子尺寸效应的影响[12],粒子粒径越小,造成未被电子占据的分子轨道能级与已被电子占据的分子轨道之间的禁带宽度增大,从而出现“红移”。此外,由于孔结构的存在,纳米TiO2粒子表面结构出现变化,使原来的禁止电子跃迁变成允许电子跃迁,因此会看到相比于其他3组样品,TiO2-2的发射峰更强,且有红移变化的现象。
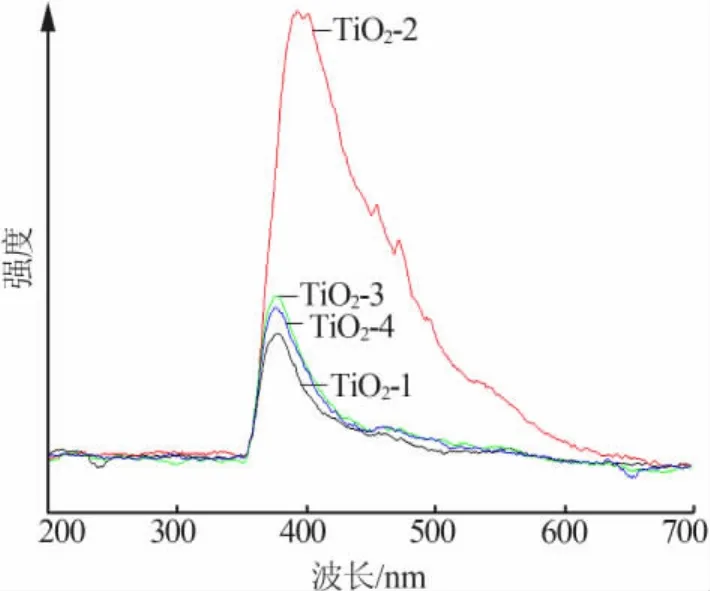
图4 4种样品的光致发光光谱
3 结论
1)采用水热法,改变模板剂CTAB的添加量,能够获得粒径小、孔道结构丰富、粒度分布窄及分散性较好的锐钛矿TiO2纳米材料。2)4组样品具有特殊的光致发光特性。由于TiO2-2颗粒尺寸较小,TiO2-2在393 nm处出现了最强的发射峰。受到量子尺寸效应和表面孔结构的影响,导致TiO2-2的发射峰的中心位置相比于其他3组样品的发射峰中心位置发生了明显的红移。

