病死猪圆环病毒2 型检测及全基因序列分析
高志强,汪 琳,赵相鹏,蒲 静,尹 羿,尹立勇,张 伟,任 彤
(1.北京海关技术中心,北京 100026;2.顺义区动物卫生监督所,北京 101300)
猪圆环病毒2 型(porcine circovirus type 2,PCV2)是一种重要的猪病病原,于1997 年在加拿大被首次发现,随后在大多数养猪国家被发现。PCV2 可引起猪的多种病症,包括断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)、猪呼吸道疾病综合征(PRDC)、繁殖障碍、肉芽肿性肠炎、坏死性淋巴结炎等。PCV2 感染还可造成猪群免疫力下降,导致多种疫苗免疫失败,猪只死亡率升高,因此对养猪业危害巨大[1]。PCV2 为圆环病毒科圆环病毒属成员,无囊膜,基因组为单链环状DNA,大小为1 767~1 768 nt,包含2 个开放阅读框(ORF),分别为ORF1 和ORF2。其中ORF1 编码复制相关蛋白(Rep 和Rep'),ORF2编码病毒衣壳蛋白(Cap)。ORF2 为病毒主要结构蛋白编码基因,也是核酸扩增检测的主要靶区域[2]。
PCV2 变异的研究表明,由于遗传变异导致目前国内PCV2 存在多种不同基因型。一些研究表明,PCV2 基因序列差异与分离地域相关,与致病性相关性不大。21 世纪以来,世界范围内PCV2 的优势基因型持续发生变异,其中基因型 PCV2b 流行最广泛且其致病性增强。一些报道也表明,Cap 基因一个单核苷酸的缺失突变可引起Cap 蛋白的延长。目前国际上根据ORF2 序列的遗传距离,即达到0.035 时,判定为不同基因型,从而将PCV2 分为3个基因型,分别为PCV2a、PCV2b 和PCV2c。其中,PCV2a、PCV2b 在猪群中广泛流行,而PCV2c仅在20 世纪80 年代在丹麦有报道,目前没有流行。近年来国内又报道了新的基因型PCV2d[3-4]。
本研究通过对国内外流行的3 个基因型(PCV2a、PCV2b 和PCV2d)毒株序列进行比对研究,建立了灵敏特异的PCV2 通用型荧光PCR 检测方法。用此方法从北京顺义区动物卫生监督所查获送检的2 批次病死猪的多脏器中检出PCV2,为进一步了解检出PCV2 病毒的基因特征,对3 份不同批次样品中分离的病毒进行了全基因组扩增检测分析,经进化分析确认为PCV2b 和PCV2d 基因型。
1 材料与方法
1.1 材料
1.1.1 病毒核酸及被检样品 猪瘟病毒HCLV cDNA、 伪 狂 犬 病 毒Nanyangju 核 酸、猪繁殖与呼吸综合征病毒MLV RespPRRS/Repro cDNA、 猪 传 染 性 胃 肠 炎 病 毒Purdue115 cDNA、PCV2 QD 株DNA,均为本实验室保存;人工合成含有PCV2 完整ORF2 基因(AY391729),克隆于质粒pBluescript II SK(+);被检样品,来自2017 年4 月—12 月采集的45 份病死猪脏器,由北京市顺义区动物卫生监督所送检。
1.1.2 主要试剂 血液/组织/细胞基因组提取试剂盒(DP304),购自天根生化科技有限公司;Ex HS Taq DNA 聚合酶、dNTP 等,购自TaKaRa 公司;核酸纯化柱及套管,购自上海生工。
1.1.3 主要设备 LightCycler 480,购自Roche 公司;AB 9700,购自AB 公司。
1.2 方法
1.2.1 引物和探针合成 随机选取国内存在的3个基因型(PCV2a、PCV2b 和PCV2d)毒株序列,在序列比对基础上,针对ORF2 设计合成1 套荧光PCR 引物探针,用于样品检测。探针序列比较结果见图1。同时依据文献合成一对反向交叉引物,用于扩增PCV2 全基因组[4]。引物探针名称、序列及靶基因见表1。

图1 引物探针设计区域的序列比对结果

表1 引物探针的名称、序列及靶基因
1.2.2 荧光定量PCR 反应条件优化 用ROCHE480 设备进行反应体系优化,对反应参数、各种成分的浓度进行优化。
1.2.3 灵敏度试验 应用建立的反应体系,对人工合成的含101~105基因拷贝的PCV2 DNA 进行检测,以验证方法的灵敏度。
1.2.4 特异性试验 应用建立的反应体系,对猪瘟病毒HCLV cDNA、 伪狂犬病毒Nanyangju核酸、 猪繁殖与呼吸综合征病毒MLV RespPRRS/Repro cDNA、猪传染性胃肠炎病毒Purdue115 cDNA、PCV2 QD 株DNA 进行检测,以验证方法的特异性。
1.2.5 送检样品检测 应用建立的方法,对北京市顺义区动物卫生监督所送检的总计45 份病死猪脏器样品进行检测,同时与行业标准SN/T 2708—2010 推荐的套式PCR 方法进行比较[5]。
1.2.6 PCR 扩增强阳性样品全基因序列 使用表1中的引物对PCV2-F/PCV2-R,进一步对分属2 批次的3 份样品进行扩增。采用50 μL 体系,每个反应体系均包含1×PCR Buffer、3.0 mmol/L MgCl2、200 nmol/L dNTP、0.8 μmol/L 的PCV2-F/ PCV2-R引物、2.5 U Taq DNA 聚合酶、5 μL 模板DNA。反应参数为95 °C/3 min;94 °C/30 s,61 °C/30 s,72 °C/min,40 个循环;72 °C 最后延伸10 min。扩增后取PCR 产物5 μL 用2%琼脂糖凝胶进行电泳。1.2.7 目的片段克隆、测序 将PCR 产物经琼脂糖凝胶电泳后,切胶回收目的片段,按照说明书克隆入pGEM-T 载体,转化Top10 感受态细胞,每个阳性质粒各挑取3 个克隆进行序列测定。对ORF2 基因序列和推导氨基酸序列进行变异分析,将测定获得的3 个全基因序列与NCBI 选取的21株代表性PCV2(涵盖PCV2a、PCV2b、PCV2c 以及PCV2d)全基因序列对比,使用MEGA 4.0 绘制进化树,确定测定序列的基因型。
2 结果与分析
2.1 荧光定量PCR 反应条件优化
经优化确立反应体系:每个反应体系均包含1×Ex Taq HS PCR Buffer、200 nmol/L dNTP、0.2 μmol/L 的PCV2-BF/PCV-BR 引 物、0.1 μmol/L的PCV2-P 检测探针。反应参数为95 °C /3 min,94 °C/10 s,60 °C/30 s,40 个循环。每个循环60 °C时收集荧光信号。
2.2 灵敏度试验
应用建立的反应体系可以检出10 拷贝的病毒DNA,表明方法的灵敏度可以满足要求(图2)。
2.3 特异性试验
应用建立的反应体系检测,对猪瘟病毒HCLV cDNA、伪狂犬病毒Nanyangju 核酸、猪繁殖与呼吸综合征病毒MLV RespPRRS/Repro cDNA、猪传染性胃肠炎病毒Purdue115 cDNA、PCV2 QD 株DNA 进行检测,结果发现建立的检测方法仅能检出PCV2 QD 株DNA。
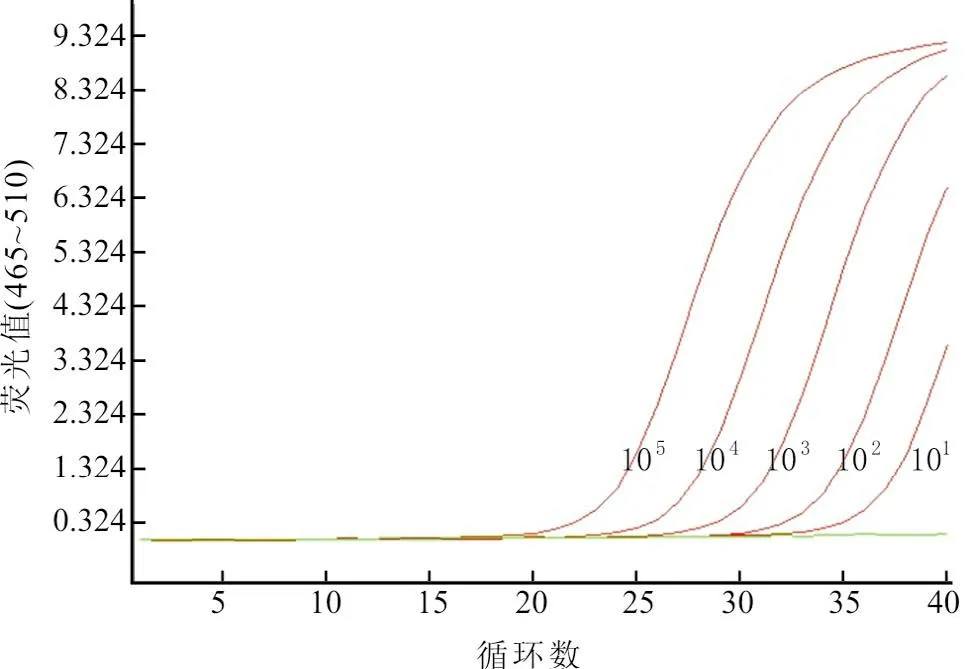
图2 灵敏度试验结果
2.4 送检样品检测
应用荧光PCR 检测方法,从2 批次45 份病死猪脏器中检出25 份阳性,与基于凝胶电泳的套式PCR 方法比较发现,仅有2 份样品的检测结果不一致,两种检测方法的复合率为95.6%。具体结果见表2。
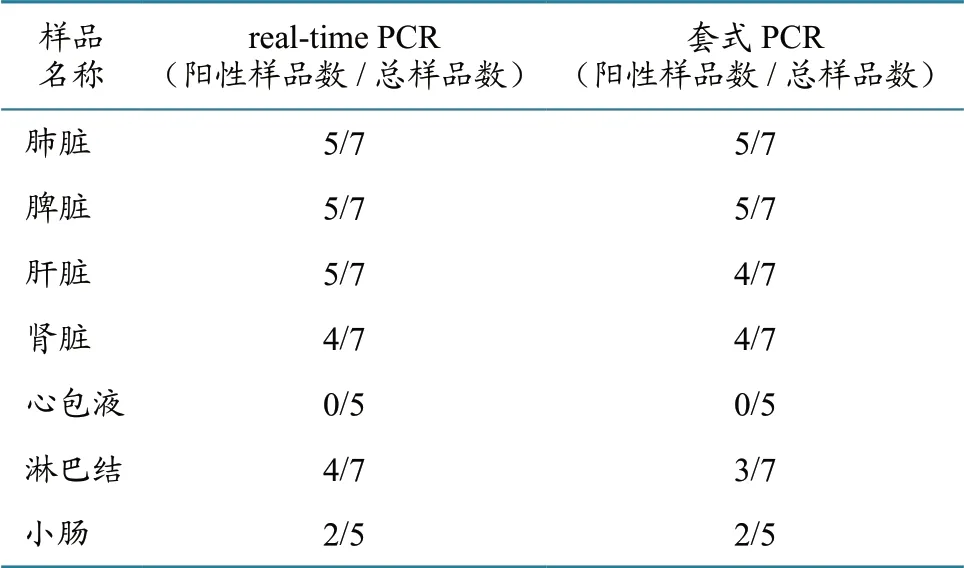
表2 样品检测结果 单位:份
2.5 强阳性样品病毒基因组扩增与克隆
对3 份强阳性样品采用PCV2-F 和PCV2-R 引物,经PCR 扩增了全长PCV2 基因组DNA,(图3)并将其克隆入pGEM-T 载体,质粒DNA 转化Top 10 感受态细胞,经菌落PCR 鉴定后,证明3个PCV2 基因组DNA 成功克隆入质粒载体,分别命 名 为pGEM-T-PCV25101、pGEM-T-PCV21201和pGEM-T-PCV215102。
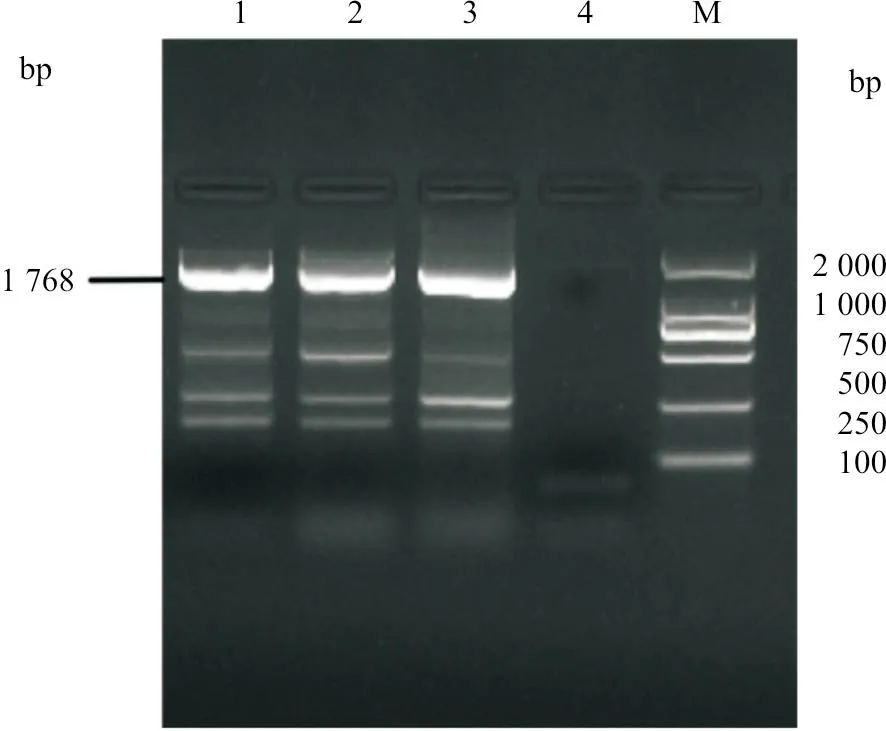
图3 3 个样品PCV2 基因组DNA 扩增结果
2.6 序列测定与变异分析
测序结果经blast 分析显示,目的片段均为PCV2 DNA,与预期一致,长度均为1 768 nt。其 中:PCV21201 和PCV215102 序 列 相 似 性 较高,为99.7%;PCV25101 与其他2 个全基因序列差异相对较大,序列相似性分别为95.9%和95.7%。对ORF2 推导氨基酸序列进行比对,同样是PCV21201 和PCV215102 序列相似性较高,为99.1%;PCV25101 与其他2 个全基因序列差异相对较大,序列相似性分别为94.4%和93.6%,因末端T 突变为C,导致终止密码子后移,编码的氨基酸比PCV21201 和PCV215102 多出1 个赖氨酸(图4)。
2.7 进化分析和亲缘性分析

图4 ORF2 推导氨基酸序列比对结果
将测定获得的3 个全基因序列与NCBI选 取 的21 株 代 表 性PCV2( 涵 盖PCV2a、PCV2b、PCV2c、PCV2d)全 基 因 序 列,使用MEGA 4.0 绘制进化树,确定测定序列的基因型。结果显示:PCV21201 和PCV215102基 因 型 为PCV2b, 而PCV25101 基 因 型 为PCV2d(图5)。
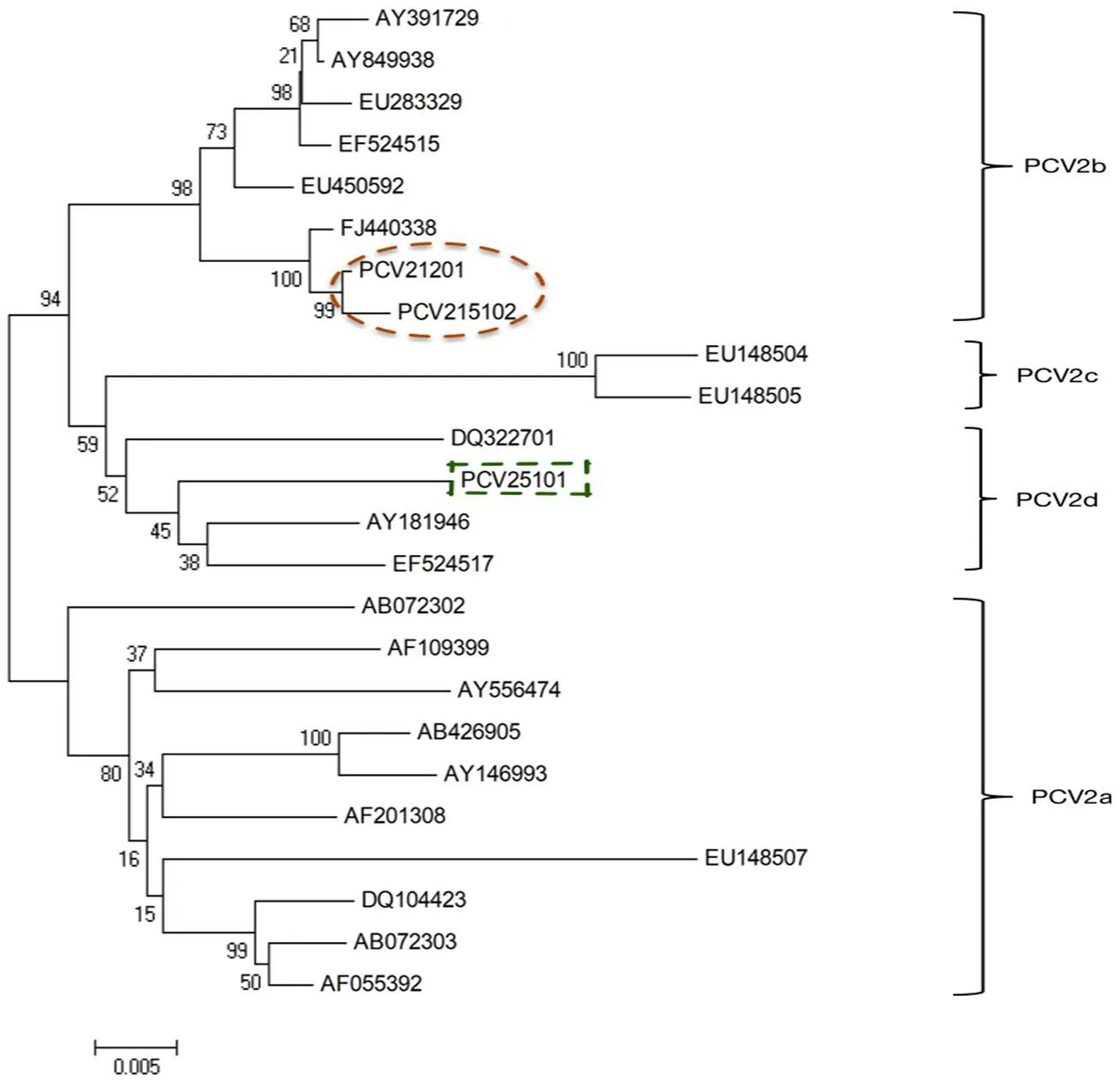
图5 24 个PCV2 全基因序列的进化分析结果(包括本研究获得的3 个序列)
3 讨论
近十多年来,PCV2 感染对我国养猪业危害巨大,有关PCV2 的检测和病毒基因变异研究在全球广泛开展。但国内有关PCV2 基因变异的研究还不是很多。因此在日常检疫工作中,对阳性结果的基因序列进行分析,不仅能确认检测结果,而且对充分了解国内PCV2 的变异具有一定意义,也有助于猪圆环病毒病的防控。
本研究中,与随机选取国内外流行的3 个基因型(PCV2a、PCV2b 和PCV2d)毒株序列进行比对,在此基础上设计通用型引物探针,建立和优化反应体系,并评估其敏感性和特异性,并用于送检样品的检测。从2 批次45 份病死猪脏器中检出25 份阳性,与出入境检验检疫行业标准中的套式PCR 方法比较,复合率达到95.6%。由于PCV2c仅在上世纪80 年代在丹麦有报道,目前没有流行,因此在建立方法时并未参考该基因型的毒株序列。但考虑到目前相关荧光PCR 检测标准方法的检测目标也未针对PCV2c,下一步开展能覆盖4 个基因型毒株的荧光PCR 方法用于本病的检测对于本病的防控检测会更有意义。此外,从2 批次的3 份PCV2 强阳性样品中扩增了3 个全基因序列,经序列分析显示,2 个批次中获得的3 个全序列中,1个(第2 批次)与另外2 个(第1 批次)差异明显,分别属于PCV2b 和PCV2d。
ORF2 编码的Cap 蛋白是PCV2 的主要结构蛋白和保护性抗原,尽管该蛋白基因相对保守,但近年来不断发生变异。该基因的变异可导致蛋白C末端多出1~2 个氨基酸。Knell 等[6]曾报道1 042处缺失1 个T 可致蛋白C 末端多出1 个赖氨酸。Olvera 等[7]报道ORF2 终止密码子的突变也可导致C 末端多出1 个赖氨酸,Guo[4]等也发现这一现象。本研究通过全基因测序鉴定出了PCV2d 基因型序列。该基因型病毒株ORF2 的一个碱基突变,致长度发生改变,与上述研究结果一致。此变异与病毒致病性的关系还有待于进一步研究。

