急性应激对小鼠AMPA受体跨膜转运和恐惧记忆的影响
陈元昊 周勐生 殷晓宇 贺怡 王伟 郝景茹 韩园 高灿


[摘要] 目的 探討急性束缚应激对小鼠AMPA受体跨膜转运和恐惧记忆的影响及其机制。 方法 将64只雄性C57BL/6小鼠采用随机数字表法分为对照组、普萘洛尔组、束缚应激组、联合组(束缚应激+普萘洛尔),每组16只。普萘洛尔组和联合组以10 mg/kg普萘洛尔溶液灌胃,同时对照组和束缚应激组以等容积的生理盐水灌胃,给药容积均为20 mL/kg。给药30 min后,束缚应激组和联合组小鼠用50 mL EP管束缚,束缚时间为30 min。采用条件性恐惧记忆实验测定小鼠的恐惧记忆;采用免疫印记法测定小鼠海马GluA1蛋白表达的变化、GluA1第831位(pS-831)和845位(pS-845)丝氨酸磷酸化水平变化、钙/钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)表达及其磷酸化(p-CaMKⅡ)水平变化以及神经元细胞膜上GluA1水平的变化。 结果 与对照组比较,束缚应激组的环境和声音依赖的冻结时间均增加(P < 0.05),海马pS-831和pS-845以及p-CaMKⅡ表达增加(P < 0.05),GluA1在细胞膜上表达增加(P < 0.05),而总蛋白中GluA1以及CaMKⅡ的表达差异无统计学意义(P > 0.05);与束缚应激组比较,联合组的环境和声音依赖的冻结时间均降低(P < 0.05),海马pS-831和pS-845以及p-CaMKⅡ表达减少(P < 0.05),GluA1在细胞膜上表达减少(P < 0.05),而总蛋白中GluA1、CaMKⅡ的表达差异无统计学意义(P > 0.05)。结论 急性束缚应激促进小鼠恐惧记忆的形成,其机制可能与调控GluA1亚基磷酸化,增加AMPA受体跨膜转运有关。此外,β-肾上腺素受体(β-ARs)可能是束缚应激促进恐惧记忆的重要作用靶点之一。
[关键词] 急性束缚应激;恐惧记忆;去甲肾上腺素;AMPA受体;跨膜转运;普萘洛尔
[中图分类号] R338 [文献标识码] A [文章编号] 1673-7210(2019)07(c)-0007-05
Effect of acute stress on AMPA receptors trafficking and fear memory in mice
CHEN Yuanhao1 ZHOU Mengsheng1 YIN Xiaoyu1 HE Yi1 WANG Wei2 HAO Jingru1 HAN Yuan1 GAO Can1
1.Jiangsu Province Key Laboratory of Anesthesiology & Jiangsu Province Key Laboratory of Anesthesia and Analgesia Application, Xuzhou Medical University, Jiangsu Province, Xuzhou 221004, China; 2.Department of Neurology, the First People′s Hospital of Huainan, Anhui Province, Huainan 232007, China
[Abstract] Objective To investigate the effect of acute restraint stress on AMPA receptors trafficking and fear memory in mice and its mechanism. Methods Sixty-four male C57BL/6 mice were divided into control group, Propranolol group, restraint stress group, combined group (restraint stress + Propranolol), according to random number table method, with 16 mice in each group. In the propranolol group and combined group, 10 mg/kg Propranolol solution was administered intragastrically, at the same time, the control group and the restraintstress group were intragastrically administered with an equal volume of normal saline, and the administration volume were 20 mL/kg. After 30 minutes of administration, the restraint stress group and combined group were restrained with 50 mL EP tube for 30 minutes. The fear memory of mice was evaluated by fear conditioning test. The expression of GluA1 in hippocampus, the level of serine phosphorylation at the 831th (pS-831) and the 845th (pS-845) of GluA1, the expression of calcium/calmodulin dependent protein kinase Ⅱ (CaMKⅡ) and its phosphorylation (p-CaMKⅡ) level, and the expression of GluA1 in the hippocampus cell membrane were measured by Western blot. Results Compared with the control group, the context-dependent and tone-dependent freezing time in the restraint stress group increased (P < 0.05), the expression of pS-831, pS-845 and p-CaMKⅡ in hippocampus increasd (P < 0.05), and the expression of GluA1 in cell membrane increased (P < 0.05), while the expression of GluA1 and CaMKⅡ in total protein had no significant difference (P > 0.05). Compared with the restraint stress group, the context-dependent and tone-dependent freezing time in the combined group decreased (P < 0.05), the expression of pS831, pS845 and p-CaMKⅡ in hippocampus decreased (P < 0.05), and the expression of GluA1 in cell membrane decreased (P < 0.05), while the expression of GluA1 and CaMK Ⅱ in total protein had no significant difference (P > 0.05). Conclusion Acute restraint stress can promote the formation of fear memory in mice, which may be related to the regulation of GluA1 subunit phosphorylation and the increased trafficking of AMPA receptors. Moreover, β-adrenergic receptors (β-ARs) may be one of the important targets for restraint stress-induced fear memory.
[Key words] Acute restraint stress; Fear memory; Norepinephrine; AMPA receptor; Trafficking; Propranolol
学习记忆是大脑的基本功能,适度的应激可以促进学习记忆[1]。应激时蓝斑核和侧脑脑干释放的去甲肾上腺素(norepinephrine,NE)被认为是调控记忆形成的重要因素[2],当NE与脑中β-肾上腺素受体(β-ARs)结合,能诱导长时程增强(long-term potentiation,LTP)的发生[3]。
现研究认为LTP主要是通过调控AMPA受体的跨膜转运实现的[4]。AMPA受体是一种离子型谷氨酸受体,它是由GluA1~GluA4四个亚基组成的四聚体[5]。其中GluA1亚基在AMPA受体跨膜转运方面发挥核心作用[6]。这种作用是通过GluA1亚基几个重要位点的磷酸化实现的。其中被蛋白激酶A(proteinkinase A,PKA)催化的GluA1亚基第845位丝氨酸(Ser-845)以及被蛋白激酶C(proteinkinase C,PKC)和CaMKⅡ催化的GluA1亚基第831位丝氨酸(Ser-831)的磷酸化最为重要[7]。NE作用到β-ARs可以激活cAMP-PKA级联信号通路[8],并增强CaMKⅡ的活性[9]。然而,急性束缚应激是否能通过NE激活β-ARs,对GluA1亚基磷酸化进行调控尚不十分清楚;急性束缚应激对小鼠AMPA受体跨膜转运以及学习记忆的影响也未见报道。本研究将通过急性束缚建立小鼠应激模型,观察小鼠学习记忆功能,检测海马总蛋白GluA1、pS-831、pS-845、CaMKⅡ、p-CaMKⅡ以及膜蛋白GluA1的变化,并采用β-ARs阻滞剂普萘洛尔干预,以进一步探讨其作用机制。
1 材料与方法
1.1 实验动物
64只雄性C57BL/6小鼠,8~10周龄,体重20~25 g,购自济南朋悦实验动物繁育有限公司[合格证号:SCXK(鲁)20140007]。所有大鼠置于室温25℃的动物房适应1周,自由饮食摄水。动物饲养及动物实验方案遵循国家《实验动物管理条例》。
1.2 主要试剂和仪器
盐酸普萘洛尔片(批号:1704146)购自江苏亚邦爱普森药业有限公司;GluA1抗体(批号:2955485)购自Millipore公司;GluA1 pS-831抗体(批号:GR46728-15)、GluA1 pS-845抗体(批号:GR246519-11)均购自Abcam公司;CaMKⅡ抗体(批号:E1908)、p-CaMKⅡ抗体(批号:E2013)、β-actin抗体(批号:D0618)均购自Santa Cruz公司;辣根過氧化物酶标记的山羊抗小鼠二抗(批号:052418181101)、辣根过氧化物酶标记的山羊抗兔二抗(批号:040818180510)、BCA蛋白测定试剂盒(批号:070517170815)、ECL发光试剂盒(批号:113016170307)均购自碧云天生物技术有限公司;生物素(EZ-Link sulfo-NHS-SS-Biotin)(批号:NG174 305)、亲和素琼脂糖(批号:ND170336)均购自Thermo Fisher公司。小鼠条件性恐惧检测箱购自Med Associates公司。
1.3 动物模型的建立
采用随机数字表法将小鼠分为对照组、普萘洛尔组、束缚应激组、联合组(束缚应激+普萘洛尔),每组各16只。普萘洛尔组和联合组以10 mg/kg普萘洛尔溶液灌胃,同时对照组和束缚应激组以等容积的生理盐水灌胃,给药容积均为20 mL/kg。给药30 min后,束缚应激组和联合组小鼠用50 mL EP管束缚,束缚时间为30 min,束缚期间各组小鼠禁水禁食。束缚结束后,各组立即取8只进行行为学检测,其余8只立即断头取脑,提取总蛋白和膜蛋白。
1.4 实验方法
1.4.1 条件性恐惧记忆实验 参照文献[10]进行,将各组小鼠依次放入条件性恐惧记忆检测箱体内,箱体四面为黑色背景,总时间为180 s,在150 s时给予声音30 s(10 kHz,75 dB),在声音结束时给2 s电刺激(0.7 mA恒流),24 h后,将小鼠放入同一环境中,记录小鼠冻结时间。另外将小鼠放入新环境箱体中,适应30 s后给予声音30 s,记录小鼠冻结时间。结果以冻结时间占总观察时间的百分比表示。
1.4.2 小鼠海马总蛋白提取 小鼠海马取材后,各组随机取4个海马组织加入含有PMSF的裂解液,用超声匀浆器超声10 s,共4次,间隔40 s。4℃,10 000 g离心10 min,收集上清并测蛋白浓度。按BCA法测定样本蛋白浓度后,用裂解液和上样缓冲液将蛋白浓度调为一致。
1.4.3 生物素标记法提取膜蛋白 参照文献[11]进行操作,每组剩余的4个海马组织剪碎后用4℃人工脑脊液(ACSF)洗涤3次,加入1 mL ACSF和40 μL生物素溶液。室温摇床上孵育30 min后用ACSF洗涤3次,加入含有PMSF的裂解液300 μL,用超声匀浆器超声10 s,共4次,间隔40 s。4℃,10 000 g离心10 min,收集上清液并按BCA法测样本蛋白浓度。测定蛋白浓度后,每管取出相同质量的上清液,加入40 μL亲和素琼脂糖,室温孵育30 min。4℃ 1000 g离心3 min,取沉淀,用裂解液洗涤沉淀3次后,加入200 μL裂解液和40 μL上样缓冲液配成小鼠海马膜蛋白样品。
1.4.4 免疫印记分析 等量蛋白样品经10%SDS聚丙烯酰胺凝胶电泳分离后,用湿转法将蛋白转移至PVDF膜。转移后的PVDF膜经5%脱脂奶粉的封闭液室温封闭1 h后加入适当稀释的一抗,4℃孵育过夜。用TBST洗膜5 min,共3次,加入相应的二抗,室温孵育1 h,用TBST洗膜5 min,共4次,滴加ECL发光液后,用Bio-rad成像系统检测,所得条带使用Image J软件分析。
1.5 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD(方差齐性)或者Dunnett T3(方差不齐),以P < 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠环境、声音依赖的冻结时间比较
与对照组比较,束缚应激组小鼠环境、声音依赖的冻结时间均增加(P < 0.05)。与束缚应激组比较,联合组小鼠环境、声音依赖的冻结时间均降低(P < 0.05)。见图1。
2.2 各组小鼠GluA1亚基在海马神经元细胞膜及总蛋白中的表达比较
与对照组比较,束缚应激组小鼠GluA1亚基在海马神经元细胞膜上的表达(S-GluA1)明显增加(P < 0.05),GluA1亚基在总蛋白中的表达(T-GluA1)差异无统计学意义(P > 0.05)。与束缚应激组比较,联合组小鼠S-GluA1的表达降低(P < 0.05),T-GluA1的表达量差异无统计学意义(P > 0.05)。见图2。
2.3 各组小鼠海马GluA1亚基pS-845和pS-831水平比较
与对照组比较,束缚应激组小鼠海马GluA1亚基pS-845和pS-831水平均提高(P < 0.05)。与束缚应激组比较,联合组小鼠海马GluA1亚基pS-845和pS-831水平均下降(P < 0.05)。见图3。
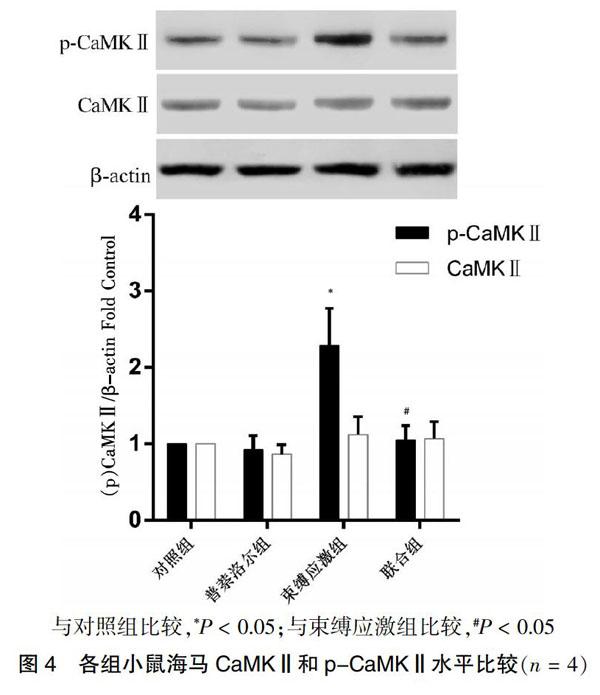
2.4 各组小鼠海马CaMKⅡ和p-CaMKⅡ水平比较
与对照组比较,束缚应激组小鼠海马p-CaMKⅡ水平升高(P < 0.05),而CaMKⅡ水平差异无统计学意义(P > 0.05)。与束缚应激组比较,联合组小鼠海马p-CaMKⅡ水平降低(P < 0.05),而CaMKⅡ水平差异无统计学意义(P > 0.05)。见图4。
与对照组比较,*P < 0.05;与束缚应激组比较,#P < 0.05
3 讨论
应激对机体的影响是双重的,过强的应激会引起学习记忆功能的下降,适度应激则能促进学习记忆[1]。本研究结果显示,束缚应激后的小鼠在环境和声音依赖的恐惧记忆测试中表现明显的冻结时间延长,提示急性束缚应激能增加小鼠的恐惧记忆。
在中枢神经系统中,AMPA受体介导大多数快速兴奋性突触传递[12]。AMPA受体可以快速地插入以及移出突触后膜,这种动态转运方式使其在多种形式的突触可塑性中发挥重要作用,并且调控突触上AMPA受体的数量可能是诱导LTP的机制之一[13]。含GluA1的受体被募集进入突触是AMPA受体跨膜转运的关键步骤[6]。本研究结果显示,束缚应激增加了GluA1亚基细胞膜表面表达量,提示束缚应激在促进AMPA受体跨膜转运和LTP中发挥重要作用,AMPA受体是束缚应激影响突触可塑性的关键作用靶点。
GluA1亚基定位到突触膜上,主要是依靠GluA1亚基Ser-845和Ser-831磷酸化调控的[7]。GluAl亚基Ser-845磷酸化是AMPA受体胞吐到突触外膜上的关键一步[14]。GluA1亚基Ser-831磷酸化,不仅能促使AMPA受体插入突触后膜,还可以增强其通道传导性[15]。本研究结果显示,束缚应激增加GluA1亚基在细胞膜表面表达的同时可以检测到pS-845和pS-831水平升高,提示束缚应激升高GluA1亚基磷酸化水平,从而影响GluA1亚基在细胞膜表面的表达。
急性应激可以促进蓝斑和侧脑脑干释放NE[16-17],并能投射到海马等区域[18]。NE激活海马β-ARs可以诱导LTP的发生,发挥提升学习记憶的作用[3]。本研究结果显示,普萘洛尔可以阻断束缚应激对小鼠恐惧记忆的促进作用,并且对束缚应激增强pS-845、pS-831水平以及细胞膜中GluA1亚基的表达也具有阻断作用。本研究结果提示,β-ARs是束缚应激促进恐惧记忆和GluA1亚基磷酸化以及增加细胞膜上GluA1表达的重要作用靶点之一。
GluA1亚基Ser-845磷酸化是依靠PKA催化的,GluA1亚基Ser-831磷酸化是依靠PKC和CaMKⅡ催化[19]。cAMP-PKA信号级联反应是β-ARs的经典信号通路,因此束缚应激激活β-ARs后可以进一步激活cAMP-PKA通路,催化GluA1亚基Ser-845磷酸化。然而,束缚应激促进GluA1亚基Ser-831磷酸化的机制尚不明确。在心肌细胞中,儿茶酚胺类物质作用到心肌β-ARs可以激活CaMKⅡ,诱导心肌细胞凋亡[20]。目前,束缚应激激活海马β-ARs对CaMKⅡ的作用尚鲜见报道。本研究显示,束缚应激后,小鼠海马p-CaMKⅡ水平升高,而CaMKⅡ水平无改变;普萘洛尔可以阻断束缚应激对小鼠海马p-CaMKⅡ水平的升高作用,而对CaMKⅡ水平无影响。提示束缚应激通过激活β-ARs,促进海马CaMKⅡ磷酸化从而提升其活性,进一步催化GluA1亚基Ser-831磷酸化。
综上所述,急性束缚应激可以增强小鼠的恐惧记忆,其可能机制是急性束缚应激促进蓝斑和侧脑脑干释放NE并投射到海马,激活海马β-ARs,进一步激活PKA和CaMKⅡ,催化GluA1亚基Ser-845、Ser-831磷酸化,促进AMPA受体的跨膜转运,最终增强小鼠的恐惧记忆。然而,本研究并不能排除其他磷酸化位点的作用。此外,对AMPA受体其他亚基在细胞中的分布也需进一步研究。
[参考文献]
[1] Whitehead G,Jo J,Hogg EL,et al. Acute stress causes rapid synaptic insertion of Ca2+ -permeable AMPA receptors to facilitate long-term potentiation in the hippocampus [J]. Brain,2013,136(Pt 12):3753-3765.
[2] Sara SJ. The locus coeruleus and noradrenergic modulation of cognition [J]. Nat Rev Neurosci,2009,10(3):211-223.
[3] Maity S,Rah S,Sonenberg N,et al. Norepinephrine triggers metaplasticity of LTP by increasing translation of specific mRNAs [J]. Learn Mem,2015,22(10):499-508.
[4] Lee HK,Kirkwood A. AMPA receptor regulation during synaptic plasticity in hippocampus and neocortex [J]. Semin Cell Dev Biol,2011,22(5):514-520.
[5] Bassani S,Folci A,Zapata J,et al. AMPAR trafficking in synapse maturation and plasticity [J]. Cell Mol Life Sci,2013, 70(23):4411-4430.
[6] Cz?觟nd?觟r K,Thoumine O. Biophysical mechanisms regulating AMPA receptor accumulation at synapses [J]. Brain Res Bull,2013,93:57-68.
[7] Lee HK,Takamiya K,He K,et al. Specific roles of AMPA receptor subunit GluR1 (GluA1) phosphorylation sites in regulating synaptic plasticity in the CA1 region of hippocampus [J]. J Neurophysiol,2010,103(1):479-489.
[8] Hall RA. Beta-adrenergic receptors and their interacting proteins [J]. Semin Cell Dev Biol,2004,15(3):281-288.
[9] Zhang X,Szeto C,Gao E,et al. Cardiotoxic and cardioprotective features of chronic β-adrenergic signaling [J]. Circ Res,2013,112(3):498-509.
[10] Hu R,Wei P,Jin L,et al. Overexpression of EphB2 in hippocampus rescues impaired NMDA receptors trafficking and cognitive dysfunction in Alzheimer model [J]. Cell Death Dis,2017,8(3):e2717.
[11] Shi XD,Sun K,Hu R,et al. Blocking the Interaction between EphB2 and ADDLs by a Small Peptide Rescues Impaired Synaptic Plasticity and Memory Deficits in a Mouse Model of Alzheimer′s Disease [J]. J Neurosci,2016,36(47):11 959-11 973.
[12] Man HY,Sekine-Aizawa Y,Huganir RL. Regulation of {alpha}-amino-3-hydroxy-5-methyl- 4-isoxazolepropionic acid receptor trafficking through PKA phosphorylation of the Glu receptor 1 subunit [J]. Proc Natl Acad Sci U S A,2007,104(9):3579-3584.
[13] Shepherd JD,Huganir RL. The cell biology of synaptic plasticity:AMPA receptor trafficking [J]. Ann Rev Cell Dev Biol,2007,23:613-643.
[14] Oh MC,Derkach VA,Guire ES,et al. Extrasynaptic membrane trafficking regulated by GluR1 serine 845 phosphorylation primes AMPA receptors for long-term potentiation [J]. J Biol Chem,2006,281(2):752-758.
[15] Appleby VJ,Corrêa SA,Duckworth JK,et al. LTP in hippocampal neurons is associated with a CaMKII-mediated increase in GluA1 surface expression [J]. J Neurochem,2011,116(4):530-543.
[16] 陶楊,丁秀芳,陈育尧,等.急性应激对大鼠行为学及蓝斑TH、DBH基因表达的影响[J].热带医学杂志,2011, 11(3):274-277.
[17] Fanselow MS,Gale GD. The amygdala,fear,and memory [J]. Ann N Y Acad Sci,2003,985:125-134.
[18] Swift KM,Gross BA,Frazer MA,et al. Abnormal Locus Coeruleus Sleep Activity Alters Sleep Signatures of Memory Consolidation and Impairs Place Cell Stability and Spatial Memory [J]. Curr Biol,2018,28(22):3599-3609.e4.
[19] Henley JM,Barker EA,Glebov OO. Routes,destinations and delays:recent advances in AMPA receptor trafficking [J]. Trends Neurosci,2011,34(5):258-268.
[20] 孙凤姣,张译丹,张密霞,等.β-AR/PKA/CaMKⅡ信号通路在阿霉素诱导大鼠心肌细胞凋亡中的作用[J].中国药理学通报,2017,33(3):360-365.

