油茶Rubisco基因的鉴定及其在高产种质筛选中的应用
王保明, 李红波, 陈永忠, 莫 华
(1.湖南应用技术学院农林科技学院,湖南常德415000;2.中南林业科技大学经济林培育与利用湖南省高校“2011”协同创新中心,湖南长沙410004;3.湖南省林业科学院国家油茶工程技术研究中心,湖南长沙410004)
油茶是我国重要的木本油料树种,其种油含有67.7%~76.7%的油酸,82%~84%的不饱和脂肪酸,68%~77%的单不饱和脂肪酸,7%~14%的多不饱和脂肪酸,因而,具有较高食用价值和药用价值[1].目前,我国对茶油的需求日益剧增[2-3],为满足人民群众对茶油迫切需求,我国的油茶种植面积持续扩大,截至2013年,栽植面已积达到3.70×106hm2[4].但栽植面积增加仍不能满足对茶油的需求.这主要由于传统栽培种产量仅有105~225 kg·hm-2[5].油茶属于虫媒异花授粉树体,自交不亲和性导致自交不育.杂交是油茶培育的主要方法,传统育种和个体选择都是采用杂交育种.从杂交群体中筛选高含油量个体,培育新品种需要7~10年.经过区域性试验,新品种通过嫁接或根接等方式繁殖,培育成植株还需要2~4年才能进入结果期.因此,提高油茶育种的效率对提高产油量显得尤为迫切.由于基因遗传连锁的缘故,分子辅助育种能够提高育种效率,选择出与产量相关的性状,根据性状的后期表达筛选出高产优良植株[6].在油茶研究中,已经构建了油茶的EST文库[7]、油茶种质的微卫星标记[8].但是,与油茶产油相关的形态学、细胞学、分子标记研究仍然较少.
在高等植物光合作用中,核酮糖1,5-二磷酸羧化酶/氧化酶(ribulose 1,5-bisphosphate carboxylase oxygenase,Rubisco)具有催化CO2固定和调节二磷酸核酮糖加氧的双重功能,是决定净光合速率的关键酶[9].在多拷贝叶绿体基因组中,Rubisco全酶含有8个大亚基(large subunits,LSU,52-ku)和1个小亚基(small subunits,SSU,14-15-ku).其中,LSU由rbcL编码,SSU由rbcS编码.SSU前体加工进入叶绿体,与8个LSU组装形成Rubisco全酶[10].rbcL高度保守,而rbcS的保守性较低[11].分子系统发育研究表明[12-13]:rbcL的正向选择是植物中普遍现象.由于植物育种是人工演化的缘故[14-15],长期选育含油量高的油茶品种,能够增加Rubisco基因的转录丰度而提高光合效率,增加油脂合成,最终达到提高产油量的目的.因此,Rubisco基因能够作为提高油茶育种效率的分子标记.然而,在油茶中RubiscorbcL和rbcS还未分离出来.本研究的目标是从油茶中分离出这2个基因,分析它们在不同品种的转录表达水平,测定3个油茶品种的净光合速率,揭示基因转录表达、净光合速率和油产量间是否存在相互联系,以及确定它们是否可以用做油茶分子辅助育种的标记以提高油茶育种的效率.
1 材料与方法
1.1 植物材料
3个品种‘横冲89’、‘湘林14’和‘湘林1’,每个品种随机选择10株,共选用30株样树.栽培方式是株行距2.0 m×3.0 m.2011—2013年,每年采收成熟的鲜果取籽称重,记录鲜籽、干籽重量.另外,采集成熟种子的果实、叶片分别保存于-80℃超低温冰箱.
1.2 总DNA和RNA提取及cDNA第1链合成
利用植物基因组DNA提取试剂盒(天根生化科技北京有限公司)从油茶叶片的总DNA分离rbcL基因.按照 e.Z.N.ATM.Plant RNA Kit(OMEGA)试剂盒的说明提取油茶冷冻成熟种子的总 RNA,用 RNase-free DNase消除总RNA中DNA的污染.取少量RNA凝胶电泳检查总RNA的质量,RNA样品的浓度和纯度(如D260nm/D280nm)用 Nanodrop2000 检测,使D260nm/D280nm为 1.8~2.0.取 500 ng RNA 作为模板,用 M-MLV反转录酶,以oligo(dT)18做为引物,在20 μL体系中反转录cDNA的第1链.
1.3 油茶rbcL和rbcS的克隆与鉴定
参照拟南芥Arabidopsis thaliana(GenBank 登录号码:ATU91966)、油菜Brassica napus(AF267640)、大豆Glycine max(EU717256和Z95552)的rbcL序列,利用Primer Primer 5.0设计rbcL的正向与反向引物5′-GGGAGGGACTTATGTCACCA-3′和 5′-TGTATTCGGCTCAATCCTTT-3′进行 PCR 扩增.其体系为 20 μL,包括12.5 μL PrimeSTAR buffer,0.5 mmol·L-1dNTPs,1.5 mmol·L-1MgCl2,正反向引物各 0.5 mmol·L-1,1 U PrimeSTAR HS DNA Polymerase,20 ng基因组DNA.循环条件为:预变性98℃ 2 min,变性98℃ 40 s,退火54.5℃ 40 s,延伸72℃ 2 min,36个循环,最终延伸72℃ 7 min.采用EB染色的1.2%琼脂糖凝胶分析PCR产物.胶纯化用微量胶提取试剂盒,纯化产物连接到pMD18-T载体转化大肠杆菌DH5α,其阳性克隆用于测序分析.
通过兼并PCR克隆rbcS的部分片段,利用PrimerPrimer 5.0设计rbcS的正反向兼并引物5′-AAGAAGTTYGAGACSCTSTC-3′和 5′-GGCWTGWAGGCGATGAAYCTG-3′.在 20 μL 反应体系中进行 PCR 扩增,其中含有 1×PCR buffer 0.5 mmol·L-1dNTPs,1.5 mmol·L-1MgCl2,0.5 mmol·L-1rbcS引物,1 U DNA聚合酶2.0 μL cDNA第1链.循环条件为:预变性98℃ 2 min,变性94℃ 30 s,退火53℃ 30 s,延伸72℃2 min,35个循环,最终延伸72℃ 7 min中止反应.
利用 RACE(rapid amplification of cDNA ends)试剂盒获得rbcS的 5′和 3′末端序列.rbcS5′RACE 的特异引物(gene specific oligonucleotide)GSP1:5′-CCTCAACCTCCTTCAACA-3′;rbcS5′RACEGSP2:5′-TCCAGTATCGCCCATCGTAG-3′和rbcS5′RACE GSP3:5′-CACAAATCCTCCCACAACAG-3′.rbcS3′RACE 的特异引物rbcS3′RACEGSP1: 5′-ATGGGCGATACTGGACAATG-3′,rbcS3′RACEGSP2: 5′-GTGTTGAAGGAGGTTGAGGA-3′,rbcS3′RACE GSP3:5′-AGAAGGAATACCCACAAGCA-3′.在 25 μL 反应体系进行 PCR 扩增,其中包括 12.5 μL 2×MightyAmp Buffer[含有 Mg2+4 mmol·L-1(2×), dNTP 800 μmol·L-1(2×)]、UPM(long)、rbcS5′RACEGSP 0.75 μL(0.3 μmol·L-1),cDNA 第 1 链 2.0 μL,Mighty Amp DNA polymerase 0.5 U(1.25 U·μL-1),获得rbcS5′RACE 片段.循环条件为:预变性98 ℃ 2 min,变性 94 ℃ 30 s,退火54 ℃ 30 s,延伸68℃ 2 min,35个循环,最终延伸72℃ 7 min中止反应.设计正反向引物5′-ATGGTTGCCTCCATAC-3′和 5′-CACAGCCATTGATCTAACGA-3′,进行 PCR 扩增以获得rbcS的全长 cDNA.在 20 μL 反应体系中含有 12.5 μL PrimeSTAR 缓冲液,0.5 mmol·L-1dNTPs,1.5 mmol·L-1MgCl2,正反向引物各 0.5 mmol·L-1,1 U PrimeSTAR®HS DNA Polymerase,2.0 μL cDNA 第1 链.循环条件为预变性98 ℃ 2 min,变性98 ℃ 40 s,退火51℃ 40 s,延伸72℃ 2 min,35个循环,最终延伸72℃ 7 min中止反应.PCR产物的分离、纯化、连接、转化以及测序参照上述反应.
1.4 序列特征分析
利用 NCBI 数据库(http: //www.ncbi.nlm.nih.gov)、ProtParam (http://www.expasy.ch/tools/protparam.html), TMpred (http://www.ch.embnet.org/software/TMPRED_form.html) 和 SignalP 3.0 (http://www.cbs.dtu.dk/services/SignalP /)分析蛋白质的结构特点.用 SOPMA (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page= /NPSA/npsa_sopma.html)预测蛋白质的二级结构.利用 Vector NTI和 Gendoc 分析油茶与其它高等植物rbcL和rbcS的氨基酸序列的同源性.利用 ChloroP 1.1 (http://www.cbs.dtu.dk/services/ChloroP/)分析亚细胞结构和剪切位点.
1.5 荧光定量PCR的转录分析
以3个品种等量的RNA为模板,在20 μL体系中用反转录试剂盒合成cDNA第1链,oligo(dT)18为锚定引物.以cDNA第1链为模板在CFX96(Bio-Rad)进行荧光定量PCR扩增,20 μL PCR反应体系包括Maxima SYBR Green qPCR Master Mix(2×)、rbcL的正反向引物 5′-TGTACTACAGTTCGGCGGAG-3′,5′-TCCATACCTCACAAGCAGCA-3′和rbcS的正反向引物 5′-TGGGCGATACTGGACAATGT-3′,5′-CAGGCGATGAAACTGATGCA-3′.参照基因GAPDH(glyceraldehyde-3-phosphate-dehydrogenase)的正反向引物分别为 5′-GAAGGGTGGTGCAAAGAAGG-3′和 5′-GACCCTCAACA-ATGCCAAACT-3′.上述扩增片段分别为 194、165 和 185 bp.
1.6 光合测定
利用Li-6400光合仪(Li-COR Bioscience,Lincoln,NE,USA)测定3个油茶品种的新生成熟叶片净光合速率PN、气孔导度gs、胞间CO2含量Ci和蒸腾速率E.测定时间为上午11:00—12:00,每株取4片叶,每片叶记录3个数值,每个品种随机选择3株,测定参数设置为叶面温度25℃,光密度1000 μmol·m-2·s-1,相对湿度65%,CO2含量为0.04%.
1.7 数据分析
按照完全随机区组法测定3个品种的产量.2011—2013年采集鲜果,记录每株所采果实的鲜籽重和干籽重量,每公顷1650株.参照Zeng et al[16]所采用的索式抽提法提取茶油,采用SAS变量分析种子和油产量及光合数据,平均值采用Duncan的多重分析.采用Bio-Rad CFX 2.0软件分析荧光定量PCR数据.Co-rbcL和CorbcS相对表达量以GAPDH为参照基因.利用Pearson相关分析种子产量、油产量、Co-rbcL和Co-rbcS的转录表达及PN间的相互关系及相关的显著性[17].
2 结果与分析
2.1 籽产量和产油量
2011—2013年3个品种的干籽产量和种油产量如图1.其中,‘湘林14’的产量(657.7 kg·hm-1)显著高于‘横冲 89’和‘湘林 1’.而‘湘林 1’的种油产量高于‘横冲 89’(546.9 kg·hm-1).
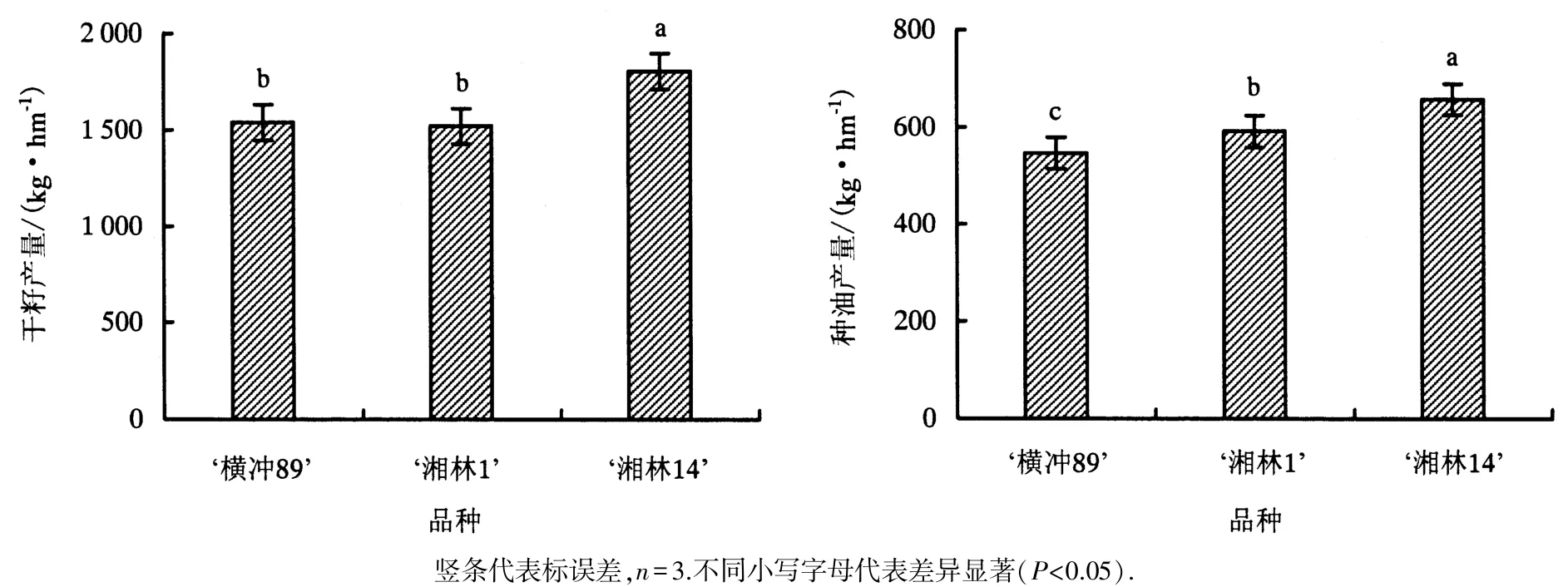
图1 2011—2013年‘横冲89’、‘湘林1’、‘湘林14’的平均干籽产量、油产量Fig.1 Mean dry seed and oil yields of‘Hengchong 89’, ‘Xianglin 1’ and ‘Xianglin 14’ in 2011—2013
2.2 油茶rbcL和rbcS cDNA的克隆与鉴定
以叶片总DNA为模板,PCR扩增得到约1600 bp的电泳条带(图2).测序确认产物长度为1522 bp,含有1425 bp的编码区,编码475个氨基酸,分子量为52.63 ku.它的核苷酸序列与茶叶Camellia sinensis(Gen-Bank 登录号 KC143082)、山茶Camellia japonica(L12602)和大苞山茶Camellia granthamiana(AF380034)山茶属植物rbcL的核苷酸序具有99%的同源性.高度的同源性表明这个片段是rbcL基因,命名为Co-rbcL.该序列已经登录 GeneBank(KJ721197).

图2 油茶Co-rbcL基因的克隆及其重组菌液PCRFig.2 PCR cloning of Co-rbcL from leaves of C.oleifera and its recombinant strains PCR
以油茶成熟种子总RNA反转录的cDNA为模板,采用简并RT-PCR,获得了324 bp的rbcScDNA序列(图3A、B),该cDNA编码108个氨基酸.它的核苷酸序列与茶叶Camellia sinensis rbcS的核苷酸序列(Gen-Bank登陆号EF011075)具有97%(310/320)的序列一致性,表明获得的基因片段是油茶的rbcS基因.通过设计5′和3′末端的引物,采用5′和3′RACE 分别获得的5′和3′末端序列(图3C~3F).最终获得的rbcS全长 cDNA基因为615 bp,其中含有1个528 bp的开放读码框,编码176个氨基酸,分子质量为19.69 ku.该序列启始密码子ATG位于第2~4个氨基酸,终止密码子TAA位于第530~532个氨基酸.该序列GC含量为49.15%.其编码区的核苷酸序列与茶叶Camellia sinensis的rbcSmRNA(登录号:EF011075)同源性超过95%,序列命名为Co-rbcS,并且已经登录到GeneBank(登录号KJ721196).
2.3 Co-rbcL和Co-rbcS蛋白的鉴定
油茶与大理茶Camellia taliensis[18]、茶叶Camellia sinensis(GenBank登录号 YP_007317256)、桃Prunus persica(GenBank 登录号 YP_004021673)、梨Pyrus pyrifolia(登录号 YP_004842247)、烟草Nicotiana tabacum[19]、松树Pirws thunbergii[20]等的rbcL氨基酸序列分别具有100%、99%、98%、98%、94%和92%的同源性.这些序列中含有165YGRPLLGCTIKPK177、K-177、321SGGDHI/VHAGTVVGKLEGER339、K-334、K-201 和 C-459 等活性位点[20].利用 ChloroP 1.1 Prediction Server (http://www.cbs.dtu.dk/services/ChloroP/)分析表明,油茶Co-rbcL蛋白的加工位点可能位于Lys 8(K)和Arg9(A)(图4).
图3 油茶叶片Co-rbcS基因的PCR克隆及其重组菌检测Fig.3 PCR cloning of Co-rbcS from leaves of C.oleifera and its recombinant strains
利用SignalP 3.0和隐马尔可夫模型(HMM),在Co-rbcS蛋白中发现2个跨膜α螺旋、信号肽以及在跨膜区该蛋白可能的剪切位点(位于第16和17个氨基酸).酸性残基和碱性残基占25.5%和12.25%,疏水残基和极性残基分别为28.90%和18.89%.Co-rbcS推导的氨基酸序列与茶叶(ABK15574)序列一致性为96%;与棉花(AFS41732)和梨 (BAA00450)的序列一致性为78%,与甘蓝型油菜的rbcS(ABB51649)序列一致性为77%;与拟南芥的核酮糖-1,5-二磷酸羧化酶2B小链(NP_198658)和小链1B(NP_198659)的序列一致性为75%和76%(图5).
2.4 Co-rbcL和Co-rbcS在不同油茶品种中的表达
荧光定量PCR分析表明,Co-rbcL在‘湘林14’中的表达比‘湘林1’、‘横冲89’高42%和103%;在‘湘林1’中的表达比‘横冲 89’高41%(图6A).Co-rbcS在‘湘林14’和‘湘林1’相似(图6B),是在‘横冲89’表达的2.5 倍.
2.5 光合测定
2011—2013 年数据表明,3 个品种中,‘湘林 14’的净光合速率 PN最高,其值为 12.55 μmol m-2·s-1,‘湘林1’显著高于‘横冲89’.‘湘林14’的气孔导度(gs)显著高于‘湘林 1’,而‘湘林 1’高于‘横冲 89’;‘横冲89’的胞间 CO2浓度(Ci)显著高于‘湘林14’和‘湘林1’,‘湘林14’和‘湘林1’的蒸腾速率(E)相似,显著高于‘横冲89’(表1).
2.6 产油量、PN和Co-rbcL与Co-rbcS表达的关系
Pearson相关分析表明:产油量与Co-rbcL和Co-rbcS在P<0.001和P<0.01水平上显著相关,相关系数(r)分别为 0.94 和 0.78(表 2).产油量与光合速率 PN相关性最高,为 0.97(P<0.001).Co-rbcL与干籽产量相关性最密切0.94(P<0.001),与鲜籽量相关,相关系数为 0.86(P<0.01).然而,Co-rbcS与干籽量、鲜籽量无相关性.另外,PN与干籽量相关,但与鲜籽量无相关性.

图4 油茶rbcL蛋白与茶叶、大理茶、桃、梨、松树、烟草的rbcL蛋白的氨基酸序列比对Fig.4 Comparison of the deduced amino acid sequences of rbcL protein from C.oleifera, C.sinensis, C.taliensis, Prunus persica,Pyrus pyrifolia, pine (Pirws thunbergii), and tobacco (Nicotiana tabacum)
3 结论与讨论
Rubisco催化RuBP(ribulose-1,5-bisphosphate)结合CO2形成3-磷酸甘油酸酯[9],它是植物叶片中最丰富的可溶性蛋白[21].Rubisco决定光合作用的效率,增强光合作用能够增加作物的产量[22-23].光合作用提供脂肪酸从头合成的碳源和ATP,增加碳供应能够提高脂肪酸的合成速率[24-25].因此,Rubisco基因可作为提高油茶育种效率的潜在分子标记.
本研究从油茶中分离了Rubisco亚基基因,如图4所示,油茶rbcL的氨基酸序列与它有亲缘关系的C.taliensis[17]和C.sinensis(GenBank登录号YP_007317256)的rbcL具有100%和99%的序列一致性,与其它高等植物的rbcL的序列一致性超过90%.因而,油茶rbcL基因高度保守[11].它含有YGRPLLGCTIKPK、K-177、SGGDHI/VHAGTVVGKLEGER、K-334、K-201、C-459 等结构域和活性位点以及加工位点.它在第 84、172、192、221、247、284、427和459个氨基酸中包括8个组氨酸残基(cysteine,Cys).172~192和449~459中的组氨酸通过二硫键连接每个大亚基,Cys-247是联系2个亚基的纽带[26].Asp473不但可以作为门闩置于大亚基的C端第六环以稳定催化作用的紧邻构象结构,而且还是CO2/O2特异性所不可少的组成[27-28].Lysine-334在羧化与氧化反应转换中起着稳定性作用,以便利于五碳烯二醇化物与气体底物反应[29].油茶rbcS的氨基酸序列与其它植物rbcS的一致性略高于75%(图5),表明rbcS的保守性不如rbcL[11].根据SOPMA prediction[30]预测,该蛋白含有跨膜α螺旋、信号肽以及跨膜区等结构域与前体剪切位点,包括22.16%的α螺旋、24.43%的β折叠、6.25%的β转角以及47.16%的随机卷曲.另外,利用ChloroP 1.1Prediction Server分析获得Co-rbcS的前体加工位点可能位于 Gln(Q)52和 Cys(C)53之间.

图5 油茶rbcS蛋白与茶叶、棉花、梨、油菜、拟南芥rbcS蛋白的氨基酸序列比对Fig.5 Alignment of the amino acid sequence of rbcS from C.oleifera with the sequences from C.sinensis, G.hirsutum,P.pyrifolia, Brassica napus, Arabidopsis thaliana

图6 油茶Co-rbcL(A)、Co-rbcS(B)在‘横冲89’、‘湘林1’、‘湘林14’叶片中的表达Fig.6 Expression of Co-rbcL (A) and Co-rbcS (B) in leaves of 3 cultivars

表1 3个油茶品种的净光合速率PN、气孔导度gs、胞间CO2浓度、蒸腾速率E1)Table 1 Net photosynthetic rate, stomatal conductance, intercellular CO2concentration, transpiration rate of three cultivars of C.oleifera

表2 油茶的主要经济性状、基因表达ꎬ以及净光合速率PN间的相关性分析1)Table 2 Person′s correlation coefficients of main economic traits in relation to the gene expression and net photosynthetic rate (PN) in C.oleifera
3年田间研究表明:油茶种籽产量和产油量最高的是‘湘林14’,‘横冲89’产籽量和产油量最低.‘湘林1’与‘横冲89’产籽量相似,但它的产油显著高于‘横冲89’,表明长期选择产油量会导致脂肪酸合成的品种间差异(图1).随后荧光定量PCR分析显示Co-rbcL在‘湘林14’中显著高于‘湘林1’,而‘湘林1’显著高于‘横冲89’(图6A).Co-rbcS在‘湘林 14’和‘湘林 1’中的表达相似,它们显著高于‘横冲 89’(图6B).叶片光合作用测定显示PN在‘湘林14’显著高于‘湘林1’,‘湘林1’则高于‘横冲89’(表1).Pearson相关性分析显示Co-rbcL表达水平与产油量和干籽产量显著相关(P<0.001),并与鲜籽产量相关(P<0.01).而Co-rbcS表达只与产油相关(P<0.01).PN与产油量相关(P<0.001),也与干籽产量相关(P<0.05)(表2).这表明Co-rbcL和Co-rbcS,特别是Co-rbcL不但具有高含油品种早期选择的分子标记的潜力,而且这种选择还综合考虑光合速率这个因素.因此,将Co-rbcL和Co-rbcS标记融入到育种中能够尽快识别高产油品种,显著缩短油茶育种时间以增加育种效率,因而可以作为早期选择高产油茶品种的分子标记.
研究表明:光照因素对油茶产量有一定的影响[31].本研究也揭示了光合作用对油茶产量具有重要意义,这主要由于Rubisco决定光合效率,进而影响碳同化、还原力、脂肪酸合成所需的ATP,而连续性和长期性的选择能够增加Rubisco基因的丰度,提高光合性能和光合效率或能力,进而提高产油量[32-34].本研究还表明:通过选择能够使油脂生物合成相关基因富集[16].今后需进一步研究增加Co-rbcL和Co-rbcS表达的潜在机制,还需要研究一些油脂合成基因在‘湘林14’中的表达情况.以前研究已经揭示了油脂合成基因ACCase的2个亚基基因accC和accD的表达与油茶的含油率关系密切,这为研究Rubisco基因,特别是Co-rbcL的研究能为提高油茶育种效率的分子标记提供依据[35].

