干扰素-γ对乳腺癌细胞HLA-Ⅰ分子表达的影响
刘丽 孙立新 赵明珍
摘要:目的 研究干扰素-γ(IFN-γ)对乳腺癌细胞表面HLA-Ⅰ类分子表达的影响,并探讨其在乳腺癌治疗中的免疫作用机制。方法 培养乳腺癌SKBR3细胞株,根据IFN-γ浓度将其分为25 U/ml、50 U/ml、100 U/ml组,未加药组为空白对照组。通过实时荧光定量PCR和流式细胞术实验检测经不同浓度IFN-γ作用后的乳腺癌SKBR3细胞内HLA-Ⅰ mRNA的含量,以及表面的HLA-Ⅰ类抗原的表达。结果 实时荧光定量PCR结果显示,空白对照组、25 U/ml、50 U/ml、100 U/ml组HLA-Ⅰ mRNA的表达量分别为(1.00±0.00)、(2.26±0.54)、(3.89±0.81)、(5.94±0.97),三个浓度组均较空白对照组表达量高(P<0.05);流式细胞术结果显示,空白对照组、25 U/ml、50 U/ml、100 U/ml组细胞表面HLA-Ⅰ蛋白表达量为(14.87±2.80)、(44.33±3.36)、(48.80±2.63)、(56.77±1.93),三个浓度组均高于对照组(P<0.05)。结论 IFN-γ上调乳腺癌细胞HLA-Ⅰ类抗原的表达有利于抗乳腺癌作用。
关键词:干扰素-γ;乳腺癌;HLA;免疫治疗
中图分类号:R737.9 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.04.029
文章编号:1006-1959(2019)04-0088-03
Abstract:Objective To investigate the effect of interferon-γ (IFN-γ) on the expression of HLA class Ⅰ molecules on breast cancer cells and to explore its immune mechanism in the treatment of breast cancer. Methods Breast cancer SKBR3 cell line was cultured and divided into 25 U/ml,50 U/ml and 100 U/ml groups according to IFN-γ concentration. The untreated group was a blank control group. Real-time quantitative PCR and flow cytometry were used to detect the content of HLA-Ⅰ mRNA and the expression of HLA-Ⅰ antigen on the surface of breast cancer SKBR3 cells treated with different concentrations of IFN-γ. Results The real-time PCR results showed that the expression levels of HLA-Ⅰ mRNA in the blank control group, 25 U/ml, 50 U/ml and 100 U/ml were (1.00±0.00),(2.26±0.54),(3.89±0.81),(5.94±0.97),the three concentration groups were higher than the blank control group (P<0.05); the flow cytometry results showed that the blank control group, 25 U/ml, 50 U/ml The expression of HLA-Ⅰ protein in the cell surface of the 100 U/ml group was (14.87±2.80), (44.33±3.36), (48.80±2.63), (56.77±1.93), and the three concentration groups were higher than the control group (P<0.05). Conclusion IFN-γ up-regulates the expression of HLA-Ⅰ antigen in breast cancer cells, which is beneficial to the anti-breast cancer.
Key words:Interferon-γ;Breast cancer;HLA;Immunotherapy
乳腺癌(Breast cancer)是目前世界上第2大常見的恶性肿瘤,位居女性恶性肿瘤第1位。发病率占成人恶性肿瘤的3%,仅次于肺癌。2018年新增的乳腺癌病例超过200万例[1]。尽管乳腺癌的早期筛查、手术治疗、放化疗、内分泌治疗以及分子靶向治疗已取得重大进展,但乳腺癌仍然是女性肿瘤死亡的重大疾病[2]。肿瘤免疫理论认为免疫逃逸机制在肿瘤的发生和发展过程中起着关键作用。近年来,免疫逃避已被公认为癌症进展的标志[3]。MHC(人类为HLA)-Ⅰ类分子表达缺陷是肿瘤免疫逃逸的重要机制。研究发现IFN-γ可以上调多种肿瘤细胞表面MHC-Ⅰ类分子的表达,有利于阻断肿瘤免疫逃逸。但对乳腺癌细胞表面MHC-Ⅰ类分子表达的作用有待进一步研究。本研究应用低表达HLA-I的乳腺癌细胞探索IFN-γ对其细胞表面HLA-Ⅰ类分子表达的上调。
1材料与方法
1.1药品与试剂 DMEM细胞培养基、胰酶、PBS购买自美国Gibco公司和胎牛血清购买自以色列BI公司。IFN-γ购于美国peprotech公司;HLA-ABC抗体购于天津三箭生物公司;HLA-ABC以及GAPDH引物购自Invitrogen公司。SKBR3乳腺癌细胞为本实验室保存。
1.2实验方法
1.2.1细胞培养 将乳腺癌SKBR3细胞以DMEM完全培养基(含10%胎牛血清),置于5% 的CO2恒温恒湿培养箱中培养,待细胞密度达到90%左右时传代。弃去旧的细胞培养基,PBS漂洗细胞2次,3 ml 0.25%胰蛋白酶消化1.5 min,吸去胰酶,加入10%胎牛血清DMEM培养基3 ml吹打成单细胞悬液,将细胞悬液传至3个新培养瓶中,加入5 ml10%胎牛血清DMEM完全培养基继续培养。
1.2.2荧光定量PCR 实时荧光定量PCR实验组分别加入终浓度为25 U/ml、50 U/ml、100 U/ml IFN-γ,未加药物组为空白对照组。用TRIzol抽提各组细胞总RNA。按照Thermo逆转录试剂盒说明书配置实验反应液,反转录反应参数为:42℃1 h;72℃5 min。qPCR循环参数为:95℃预变性10 s后,随后按60℃30 s,72℃20 s进行45个循环;实验以GAPDH基因内参表达水平为对照,以2-△△Ct法分析细胞中HLA-Ⅰ类分子的mRNA表达水平。扩增HLA-I基因引物:正向引物:5'-GCTACTACAACCAGAGCGAGG-3',反向引物:5'-GTGTGATCTCCGCAGGGTAGA-3';扩增GAPDH基因引物:正向引物:5'-GCACCGTCAAGGCTGAGAAC-3',反向引物:5'-TGGTGAAGACGCCAGTGGA-3'。实验重复3次。
1.2.3流式细胞术检测细胞表面HLA-Ⅰ类分子 药物处理同荧光定量PCR。将各组细胞制成细胞悬液,用含1%胎牛血清的PBS漂洗3次。调整每组细胞浓度为1×107个/ml。将每组细胞悬液分2管,每管 25 μl,其中一管加HLA-Ⅰ FITC 单抗1.5 μl。另一管加入同型对照1.5 μl。室温避光反应 40 min。加入1%胎牛血清PBS 400μl/管。采用流式免疫荧光法(FACS)检测样品,每管样品分析5000个细胞。实验重复3次。
1.3统計学分析 所有数据采用SPSS 21.0 统计学软件进行统计,计量资料采用(x±s)表示,行单因素方差分析,组间比较用Tukey检验,P<0.05为差异有统计学意义。
2结果
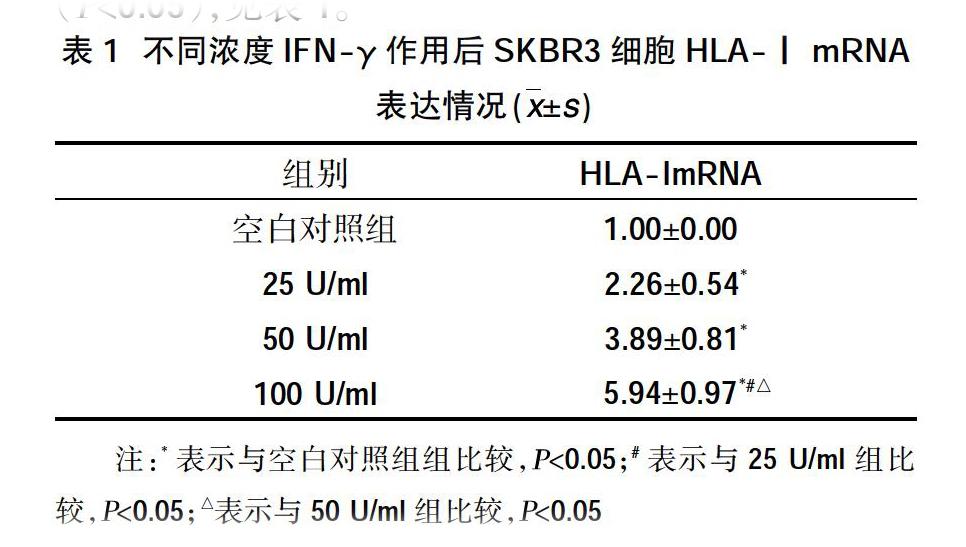
2.1 IFN-γ对SKBR3乳腺癌细胞的HLA-Ⅰ mRNA水平的影响 实时荧光定量PCR结果显示IFN-γ处理组细胞 HLA-Ⅰ mRNA 表达量高于空白对照组(P<0.05),100 U/ml组最高。且HLA-ⅠmRNA 表达量随着IFN-γ浓度的增加而增加,表明这个浓度区间中,IFN-γ有诱导乳腺癌SKBR3细胞HLA-ⅠmRNA的作用,具有浓度依赖性,差异有统计学意义(P<0.05),见表1。
2.2 IFN-γ对SKBR3乳腺癌细胞表面的HLA-Ⅰ蛋白表达的影响 流式细胞免疫荧光检测显示,经25、50、100 U/ml IFN-γ处理的SKBR3细胞表面的HLA-I的表达量高于空白对照组,差异具有统计学意义(P<0.05)。且随着IFN-γ浓度的增高,细胞表面HLA-Ⅰ的表达量增高,具有浓度依赖性,见表2。
3讨论
免疫应答(Immune response)是指机体免疫系统对体内抗原进行识别,继而清除抗原的一系列生物
学效应过程。T细胞是人体细胞免疫的主要细胞之一,在抗肿瘤免疫机制中发挥着主导作用。肿瘤细胞表面免疫抗原的丢失是肿瘤细胞逃避机体免疫的主要原因之一,在肿瘤的发生发展中起着关键作用。提高肿瘤表面的免疫抗原表达可增强肿瘤细胞的免疫源性,同时提高T细胞对肿瘤细胞识别度,达到抗肿瘤的作用。HLA-Ⅰ参与人类免疫细胞识别肿瘤抗原,在多种人类肿瘤细胞中存在着HLA-Ⅰ抗原的缺失。吴明雨等[4]研究发现低分化型口腔鳞状细胞癌(OSCC)组织HLA-B表达较正常组织和高分化OSCC明显下调,可能与低分化型OSCC出现较高的淋巴道转移率相关,提示HLA-B的表达下调可能在OSCC淋巴道转移中有着重要意义。同时,HLA-B可作为一项监测口腔鳞状细胞癌恶性程度与淋巴道转移的指标。纪晓坤等[5]发现在人卵巢癌SKOV3细胞转染Beclin1质粒后HLA-Ⅰ、HLA-Ⅱ表达量增加,使卵巢癌细胞免疫应答增强。Chang C等[6]报道大部分肿瘤中均存在 HLA-Ⅰ表达异常,并在对100多种肿瘤性损伤的研究中发现16%~80%的损伤均出现HLA-Ⅰ的表达缺失或下降。由此可见HLA-Ⅰ分子的表达对肿瘤的发生、发展有关键作用。近些年来兴起的肿瘤免疫疗法较传统治疗方法可显著提高患者的生存质量。目前对乳腺癌的免疫疗法的研究相对较少。IFN-γ作为重要的天然免疫调节剂,可上调多种肿瘤细胞表面免疫分子的表达,从而增强免疫细胞的抗原提呈作用,使Th0细胞向Th1分化[7]。同时,IFN-γ还可刺激APCs细胞,上调IL-12、IL-27和CD86等的表达,促进了Th1细胞的分化和细胞毒性T淋巴细胞(CTL)功能。此外,IFN-γ可干扰Th2,Th17、调节性T细胞(Treg)等在肿瘤细胞免疫逃避过程中起关键作用的细胞的分化[8]。李林卿等[9]在对271例乳腺癌手术患者的癌组织的检测中发现其中有92例患者的乳腺癌组织中HLA-Ⅰ呈强阳性表达,而179 例表达下调;且HLA-Ⅰ的表达量与TNM分期早晚、有无淋巴结转移及血管侵犯均相关。HLA-Ⅰ表达下调者的无病生存率显著低于HLA-Ⅰ表达阳性者。说明HLA-Ⅰ分子的表达与乳腺癌的发生和进展有着重要的相关性。研究表明IFN-γ可抑制多种肿瘤细胞系生长(包括乳腺癌细胞),而且对乳腺癌皮肤复发患者进行病灶内注射IFN-γ可使皮肤损伤部分或完全消退[10]。但是其抗肿瘤作用机制尚未完全清楚。据以往的研究发现[11,12],IFN-γ可上调结肠癌细胞、胃癌细胞表面HLA-Ⅰ分子表达。但对乳腺癌细胞表面HLA-Ⅰ分子表达的作用有待进一步研究。
本研究通过荧光定量PCR实验和流式细胞术检测观察到IFN-γ在体外对乳腺癌细胞株SKBR3的HLA-Ⅰ基因转录与空白对照组比较明显增加、细胞表面HLA-Ⅰ蛋白表达与空白对照组相比也明显增加,且上调强度与干扰素的浓度呈剂量依赖的关系。IFN-γ上调乳腺癌细胞的HLA-Ⅰ表达,可抑制肿瘤细胞的免疫逃避作用,增强免疫系统对肿瘤细胞的识别,从而起到抗乳腺癌的作用。本研究为乳腺癌的免疫治疗提供了一定的研究基础,也为以后IFN-γ联合其他药物治疗乳腺癌提供了实验基础。总之,IFN-γ在乳腺癌治疗中的作用机制值得进一步深入研究。
参考文献:
[1]Stewart B,Wild C.World Cancer Report 2014:International agency for research on cancer[M].Geneva:World Health Organization,2014.
[2]Siege RL,Miller KD,Jemaal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[3]卢伸,苏丹.免疫检查点阻断用于肿瘤治疗的研究进展[J].实用肿瘤杂志,2016,31(1):19-23.
[4]吴明雨,于大海,程立,等.HLA-B在口腔鳞状细胞癌中的表达及意义[J].微生物学免疫学进展,2018,46(4):35-39.
[5]纪晓坤,王学利,王珩,等.Beclin1和HLAⅠ、Ⅱ在人卵巢癌SKOV3细胞中的表达[J].临床与实验病理学杂志,2017,33(9):954-958.
[6]Chang C,Campoli M,Ferrone S.Classical and nonclassical HLA class I antigen and NK cell-activating ligand changes in malignant cells: current challenges and future directions[J].Adv Cancer Res,2005(93):189-234.
[7]Abiko K,Matsumura N,Hamanishi J,et al.IFN-gamma from lymphocytes induces PD-L1 expression and promotes progression of ovarian cancer[J].Br J Cancer,2015,112(9):1501-1509.
[8]Zhang X,Zeng Y,Qu Q,et al.PD-L1 induced by IFN-gamma from tumor-associated macrophages via the JAK/STAT3 and PI3K/AKT signaling pathways promoted progression of lung cancer[J].Int J Clin Oncol,2017,22(6):1026-1033.
[9]李林卿,莊文欣,李鹏程,等.HLA-Ⅰ在乳腺癌组织中的表达及其临床意义[J].中国普外基础与临床杂志,2013,20(10):1132-1136.
[10]Kamali-Sarvestani E,Merat EA,Talei AR.Polymorphism in thegenes of alpha and beta tumor necrosis factors(TNF-alpha and TNF-beta)and gamma interferon(IFN-gamma)among Ira-nianwomen with breast cancer[J].Cancer Lett,2005,223(1):113-119.
[11]刘钢,黄文广,史火喜,等.结直肠癌人类白细胞抗原ABC表达与预后的相关性及干扰素γ的诱导作用研究[J].中华临床医师杂志(电子版),2009,3(7):1126-1134.
[12]Mimura K,Shiraishi K,Mueller A,et al.The MAPK pathway is a predominant regulator of HLA-A expression in esophageal and gastric cancer[J].J Immunol,2013(191):6261-6272.
收稿日期:2018-11-29;修回日期:2018-12-9
编辑/成森

