3D支架搭载间充质干细胞促进造血干细胞体外生产血小板的研究
张丽娜 刘相富 李远 叶艳玲 温力挽 刘家友 赖文辉

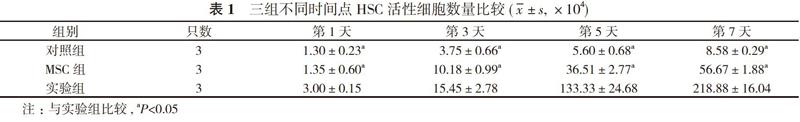

【摘要】 目的 研究3D支架搭載间充质干细胞(MSC)对促进造血干细胞(HSC)体外生产血小板的影响。方法 从本院本部干细胞临床研究中心购买种子细胞HSC及MSC。取适量生物材料, 环氧乙烷消毒后使用伊思柯夫改良培养液(IMDM)浸泡过夜。将一定数量间MSC贴壁培养至生物材料中, 待其长满。设置分组:对照组(24孔板内单独培养HSC)、MSC组(24孔板内单独接种MSC)、实验组(即HSC+3D-MSC+细胞因子), 体外共培养7 d, 分别于1~7 d时观察HSC的形态变化;比较三组不同时间点HSC活性细胞数量;采用细胞计数试剂盒-8(CCK-8)法测定HSC扩增情况。结果 荧光显微镜观察显示:对照组可见HSC细胞呈均一的圆形;MSC组可见MSC呈长梭形;实验组可见圆形细胞和长梭形细胞, 在同一视野进行白光和荧光拍照, 并经PS软件合成处理后, 可见清晰细胞排列。实验组第1、3、5、7天时HSC活性细胞数量分别为(3.00±0.15)、(15.45±2.78)、(133.33±24.68)、(218.88±16.04)×104, 明显高于对照组的(1.30±0.23)、(3.75±0.66)、(5.60±0.68)、(8.58±0.29)×104和MSC组的(1.35±0.60)、(10.18±0.99)、(36.51±2.77)、(56.67±1.88)×104, 差异均有统计学意义(P<0.05)。对各组培养第1、3、5、7天HSC样本进行CCK-8法检测, 从生长曲线可以看出各组HSC数量均随培养时间的延长而增加, 第3天开始进入对数生长期, 与骨髓MSC共培养对HSC增殖有促进作用, 3D支架搭载较对照组和MSC组对HSC增殖的促进作用更明显。结论 3D支架搭载MSC在体外能够有效促进HSC增殖, 显著提高血小板产量。
【关键词】 3D支架;间充质干细胞;造血干细胞;血小板
DOI:10.14163/j.cnki.11-5547/r.2019.24.109
Study on in vitro platelet production by hematopoietic stem cells promoted by mesenchymal stem cells loaded on 3D scaffolds ZHANG Li-na, LIU Xiang-fu, LI Yuan, et al. Department of Blood Transfusion, Third Affiliated Hospital of Sun Yat-Sen University Yuedong Hospital, Meizhou 514700, China
【Abstract】 Objective To study the effect of in vitro platelet production by hematopoietic stem cells (HSC) promoted by mesenchymal stem cells (MSC) on 3D scaffolds. Methods Seed cells HSC and MSC were purchased from our clinical stem cell research center. After disinfection with ethylene oxide, appropriate biomaterials were soaked overnight in Iscoves modified Dubeccos medium (IMDM). A certain number of MSCs are adherently cultured into biological materials until they are overgrown. The grouping was set up: control group (HSC cultured in 24-well plate alone), MSC group (MSC inoculated separately in 24-well plate), experimental group (HSC+3D-MSC+cytokine), co-cultured for 7 d in vitro. The morphological changes of HSC were observed at 1-7 d, and the number of HSC active cells at different time points was compared among the three groups. HSC amplification was detected by cell counting kit-8 (CCK-8). Results Fluorescence microscopy showed that HSC cells were uniform round in the control group, long spindle in the MSC group, and round and long spindle cells in the experimental group. White light and fluorescence photographs were taken in the same field of vision, and clear cell arrangement was observed after PS software synthesis. At 1st, 3rd, 5th and 7th day, the experimental group had obviously higher number of HSC active cells respectively as (1.30±0.23), (3.75±0.66), (5.60±0.68), (8.58±0.29)×104 in the controll group, and (1.35±0.60), (10.18±0.99), (36.51±2.77) and (56.67±1.88)×104 in MSC group. Their difference was statistically significant (P<0.05). CCK-8 method was used to detect HSC samples from the 1st, 3rd, 5th and 7th day of culture in each group. The growth curve showed that the number of HSC in each group increased with the prolongation of culture time. On the 3rd day, HSC began to enter the logarithmic growth phase. Co-culture with bone marrow MSC promoted the proliferation of HSC. Compared with control group and MSC group, the effect of 3D scaffolds loading on HSC proliferation was more obvious. Conclusion MSC loaded on 3D scaffolds can effectively promote HSC proliferation and significantly increase platelet production in vitro.
【Key words】 3D scaffolds; Mesenchymal stem cells; Hematopoietic stem cells; Platelet
临床工作中, 血小板输注是一项最常用, 也是最有效的治疗手段, 目前血小板的主要来源是靠机采和手工制备两种方式, 机器获得的血小板对供体有更高的要求, 而用全血制备的手动血小板需要不止一个人混合, 导致抗原-抗体反应发生率较高[1]。因此, 在体外寻找安全可靠的血小板来源已成为当前研究的一个关键难题。近年来关于间充质干细胞(mesenchymal stem cell, MSC)促进内造血干细胞(hemopoietic stem cell, HSC)增殖的研究已有不少, 但建立稳定高效的干细胞向血小板生产平台一直是临床探讨的热门话题[2]。本研究旨在获得3D支架搭载MSC促进HSC体外生产血小板的可靠证据和实验方法, 以期为研制新型生物反应器, 利用体外培养方法大量生产标准化的血小板, 从而解决输血医学所面临的难题, 并为其提供理论依据及实验基础, 现报告如下。
1 材料与方法
1. 1 材料来源 从本院本部干细胞临床研究中心购买种子细胞HSC及MSC。取适量生物材料, 环氧乙烷消毒后使用IMDM浸泡过夜。将一定数量间MSC贴壁培养至生物材料中, 待其长满。
1. 2 实验方法 设置分组:①对照组:24孔板内单独接种HSC;② MSC组:24孔板内单独接种MSC;③实验组:即HSC+3D-MSC+细胞因子[干细胞因子(SCF)、rh促血小板生成素(rhTPO)、白细胞介素-6(IL-6)和白细胞介素-11(IL-11)]置37℃、5% CO2细胞培养箱中培养, 每3天全量更换培养液及细胞因子。每组3个复孔, 实验重复3次, 以此为观察样本。
1. 2. 1 细胞形态观察 ①在不同时间点收集单个核细胞(MNC), 取适量细胞至1.5 mlEP管中, 用磷酸盐缓冲液(PBS)洗涤2次, 以1800 rpm离心5 min, 加入适量PBS重悬细胞。②标记载玻片, 按照细胞涂片机的说明进行安装, 加入65 μl细胞悬液, 以2000 rpm离心5 min, 小心取出载玻片。③瑞氏-吉姆萨(Wright-Gimsa)染色步骤如下:a.将载玻片置于水平方向, 等待稍微风干, 然后将Wright-Gimsa染色液A加入载玻片中。让其完全覆盖细胞涂片范围, 并保持染色1 min;b.加入Wright-Gimsa染色溶液B溶液以覆盖载玻片的染色溶液A(加入量约为A液总量的2~3倍)。轻轻摇动载玻片, 彻底混合A和B染料, 靜置10 min;c.用水轻轻冲洗剩余的染料溶液, 在室温下静置使其完全干燥, 并加入2滴中性树脂。轻轻放置盖玻片, 让液滴布满整个载玻片, 等待其干燥, 在显微镜下观察并拍照。
1. 2. 2 细胞增殖能力分析 将具有良好生长状态的P5MSC消化并稀释成1×10E4细胞/ml细胞悬浮液。根据100 μl/孔
接种于96孔板中, 并在每组中设置8个重复孔, 总共4个板。24 h后吸出原始培养基并用PBS洗涤2次。根据第一组, 接种100 μl含有2×10个E5 MNC细胞的巨核细胞诱导培养基-X细胞悬浮液。与MSC直接共培养。每天在固定时间向一个孔板中的样品孔中加入10 μl CCK-8液体, 并使其在培养箱中静置2 h。将其置于酶联仪器中, 测量450 nm处的吸光度, 并绘制细胞生长曲线。
1. 3 观察指标 体外共培养7 d, 分别于1~7 d时观察HSC的形态变化;比较三组不同时间点HSC活性细胞数量;采用CCK-8法测定HSC扩增情况。
1. 4 统计学方法 采用SPSS19.0统计学软件对数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 三组镜下HSC形态观察 荧光显微镜观察显示:对照组可见HSC细胞呈均一的圆形;MSC组可见MSC呈长梭形;实验组可见圆形细胞和长梭形细胞, 在同一视野进行白光和荧光拍照, 并经PS软件合成处理后, 可见清晰细胞排列。HSC是绿色荧光蛋白(GFP)细胞, 在荧光显微镜下显示绿色荧光, 用于与MSC接触共培养时区分两种细胞。见图1, 图2, 图3。
2. 2 三组不同时间点HSC活性细胞数量比较 实验组第1、3、5、7天时HSC活性细胞数量明显高于对照组与MSC组, 差异均有统计学意义(P<0.05)。见表1。
2. 3 CCK-8法检测HSC增殖情况 对各组培养第1、3、5、7天HSC样本进行CCK-8法检测, 从生长曲线可以看出各组HSC数量均随培养时间的延长而增加, 第3天开始进入对数生长期, 与骨髓MSC共培养对HSC增殖有促进作用, 3D支架搭载较对照组和MSC组对HSC增殖的促进作用更明显。见图4。
3 讨论
干细胞作为具有自我更新和多向分化潜能的种子细胞, 在体外诱导产生干细胞的血小板已成为解决该问题的重要切入点。如何建立稳定高效的干细胞向血小板生产平台, 可以同时保证血小板的产量和质量, 为血小板相关疾病患者提供有效的治疗保障, 具有很大的社会和经济效益[3]。目前, 许多研究表明[4], 胚胎干细胞、脐带、骨髓、外周血衍生的造血干/祖细胞, 诱导多能干细胞等可用作种子细胞。在适当条件下诱导分化以促进细胞增殖和巨核细胞分化, 并最终产生巨核细胞祖细胞、巨核细胞和血小板, 虽然运用上述方法均能在体外培养出血小板。但是, 在这些培养体系中, 所得血小板量非常低, 不足以用于临床输注[5]。因此, 在血小板体外生成过程中建立完善的培养体系, 提高干细胞的扩增能力以获得数量和质量均可以媲美体内生成的血小板以满足临床需求, 亟待进一步探索和研究。
有学者研究表明[6], 骨髓MSC和细胞外基质组成的造血微环境对HSC自我更新和造血分化具有明显的支持作用, 细胞因子组合TPO+SCF+白细胞介素-3(IL-3)+IL-6可在培养的第7天扩增至巨核细胞数的39倍。因子组合TPO+SCF+IL-3在培养的第7天扩增至36倍。在TPO+SCF培养的第7天, 细胞数量仅增加了29倍。可以看出, 细胞因子的组合在巨核细胞扩增中起重要作用。但是, 短期细胞因子刺激可显著扩增HSC的数量, 可是长期刺激下将会导致细胞分化扩增, 导致造血细胞衰竭。在临床应用中发现, MSC与HSC共同移植, 可显著促进造血重建等, 在基础实验中, MSC可显著维持HSC的干性, 另一方面, 细胞只有在三维空间中处于相对的位置才有助于细胞间物质及信号的传递和表达[7]。因此, 3D培养对提高干细胞体外扩增因子、延长体外培养时间和维持自我更新能力具有显著作用。
由于MSC能维持HSC干性, 并能促进其定向分化, 3D培养能模拟体内细胞生长环境, 显著提高干细胞扩增倍数, 因此本文提出3D支架搭载MSC促进HSC体外生产血小板的研究, 以建立最新血小板体外生产体系, 形成极其类似人体骨髓环境的具有MSC支持的利基(niche)结构, 分析本研究结果得出:共培养7 d, 各组HSC数量均随着培养时间的延长而增加。实验组在第1、3、5、7天时HSC活性数量明显高于对照组与MSC组, 差异有统计学意义(P<0.05)。可见3D支架培养能显著提高干细胞的体外扩增倍数。分析原因:细胞在支架上的生长、移植和内生长率直接依赖于支架的多孔结构、孔隙率、孔的直径和孔的形状, 3D支架培养能很好地模拟HSC微环境的三维组织结构, 为细胞增殖提供良好的生长环境[8]。
综上所述, 在3D支架培养环境下, 加上MSC共培养以维持HSC干性, 能够显著提高HSC向巨核系定向分化效率, 并得到大量稳定的产板巨核细胞及血小板, 有助于为研制新型生物反应器, 利用体外培养方法大量生产标准化的血小板, 从而解决输血医学所面临的难题, 并为其提供理论依据及实验基础, 3D培养是一个产业化生产血小板的重要研究方向。
参考文献
[1] 张彦西, 戴卫, 蒋永平, 等. 原核表达重组人白介素-3及其对脐带血造血干细胞体外增殖的影响. 实用临床医药杂志, 2013, 17(5):8-12.
[2] 陆华. 体外生产血小板的研究进展. 重庆医学, 2011, 40(36):3727-3730.
[3] 杨帆, 孙雪冬, 袁磊, 等. 聚乙二醇化G-CSF与重组人G-CSF促进恶性血液病异基因造血干细胞移植后造血恢复的对比研究. 中华血液学杂志, 2017, 38(10):831-836.
[4] 周燕, 李丽兰, 钟周琳, 等. 造血干细胞移植术后抗-CD36抗体介导的血小板输注无效症和相关病例的实验研究. 中国实验血液学杂志, 2018, 26(2):541-546.
[5] 赵昕亚, 董林. 造血干细胞体外誘导生成血小板研究进展. 医学综述, 2016, 22(20):3977-3980.
[6] 孙春红, 姚建娜, 刘芳, 等. 不同血细胞分离机采集程序对健康供者造血干细胞采集物细胞成分的影响. 中国实验血液学杂志, 2016, 24(6):1869-1872.
[7] 方洪松, 周建林, 彭昊, 等. 不同来源间充质干细胞生物学特性差异. 中国组织工程研究, 2015, 19(32):5243-5248.
[8] 梁雨蒙, 王晓娜, 邓磊, 等. 骨髓间充质干细胞微泡生物学特性及其促进造血干细胞体外扩增作用的研究. 中国实验血液学杂志, 2017, 25(4):1187-1193.

