维生素D缺乏与老年2型糖尿病患者发生骨质疏松、骨骼肌质量减少的相关性研究
张恬 吕珊 殷泉忠 丁国宪*
1.南京医科大学附属江苏省人民医院,江苏 南京 210029 2.东南大学医学院附属江阴医院老年医学科, 江苏 江阴 214400
2型糖尿病 (type 2 diabetes,T2DM) 是老年人常见的慢性疾病之一。25(OH) D是机体内环境中含量最高、最不易分解的维生素D,通常被用于反映血清维生素D水平[1]。相关研究表明,25(OH)D缺乏现象在老年T2DM患者中普遍存在[2];25(OH)D缺乏可通过人体胰岛素的分泌减少、人体炎症反应增加等多种途径加快老年T2DM的发展[3-4]。骨质疏松症 (osteoporosis,OP) 是一种骨量减少、骨微结构破坏的代谢性骨病综合症。25(OH) D 缺乏将引起机体骨转换减少、骨吸收抑制,最终导致骨质疏松[5]。肌少症(sarcopenia)是近年来新发现的一种与血脂代谢及胰岛素抵抗有关的增龄性疾病,主要诊断标准为骨骼肌质量减少、强度减弱、功能下降。相关研究提示,老年T2DM患者中骨质疏松的发生率与健康人相比明显升高,骨骼肌质量与健康人相比明显降低,且四肢骨骼肌质量指数(appendicular skeletal muscle mass index, ASMI)与2型糖尿病患者发生OP的风险呈正相关[6-7]。至于老年T2DM患者血清中25(OH) D与OP、肌少症之间的具体关系如何,目前国内外尚未见相关文献报道,故本研究拟通过观察血清25(OH) D水平在老年T2DM患者或合并骨质疏松或骨骼肌质量减少患者等各组人群之间的差异,探讨它们之间的相互关系,为临床早期联合防治老年T2DM、骨质疏松、骨骼肌质量减少的发生提供新的思路。
1 材料和方法
1.1 临床资料
选取2015年12月至2017年12月在我院内分泌科及老年医学科住院的280例老年T2DM患者作为观察组。其中,男195例、女85例,平均年龄(69.6±7.3)岁,平均身高(164.9±8.5)cm,平均体重(64.41±10.15)kg,体质量指数(body mass index,BMI)(23.71±3.44)kg/m2。同时选取在我院健康体检的135例非糖尿病老年人作为对照组。其中,男98例、女37例,平均年龄(68.5±7.8)岁,平均身高(164.4±8.9)cm,平均体重(62.23±8.93)kg,BMI(23.99±4.36)kg/m2。2组间年龄(t=1.519,P=0.13),性别(χ2=0.206,P=0.71),平均身高(t=0.652,P=0.515),平均体重(t=1.437,P=0.152),BMI(t=-0.83,P=0.407)之间的差异无统计学意义,具有可比性。本研究经本院伦理委员会批准,并取得所有研究对象的知情同意。
1.2 入组排除标准
1.2.1入组标准:观察组入组标准:①有自主活动能力,一般情况良好;②年龄在60~80岁之间;③符合中国2型糖尿病防治指南的诊断标准[9]。对照组入组标准:符合上述①②标准。
1.2.2排除标准:观察组排除标准:①存在甲状腺功能异常、药物性肝炎、慢性病毒性肝炎和其他疾病所致的肝病等的患者;②继发性糖尿病、1型糖尿病、有糖尿病酮症酸中毒、高血糖高渗性综合征、乳酸性酸中毒及低血糖症等急性并发症病史;③合并严重心脏、肝肾功能损害或存在神经系统、免疫系统、肿瘤、严重感染等疾病者;④近期曾行手术或受过严重外伤者;⑤无自主活动能力,合并精神疾病者;⑥服用维生素D、性激素、糖皮质激素、抗癫痫药物、抗凝药物及影响骨代谢的药物者。对照组排除标准:除上述标准外,还需排除2型糖尿病患者。
1.3 BMD测定和骨质疏松的判断标准
采用双能X线骨密度仪(GE Lunar Prodigy)检测受试者腰椎、股骨颈、大转子、髋部的骨密度(bone mineral density,BMD)及骨密度T值。按照中华医学会2011年推荐的诊断标准,如有一个或以上部位骨密度值低于正常同性别峰值2.5个标准差则诊断为骨质疏松[8]。
1.4 四肢骨骼肌质量测定和肌量减少定义及评定
采用生物电阻抗测试法(bio impedance analysis,BIA)测量受试者体表面积、四肢骨骼肌肉量、内脏脂肪面积等各项指标。参照2014年AWSG(亚洲肌少症工作组)诊断标准,将四肢骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI):男性<7.0 kg/m2,女性<5.7 kg/m2定义为肌量减少[9]。
1.5 实验室检查
所有受试者均行血清25(OH) D及血生化指标检测(三酰甘油、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、尿素氮等)测定。
1.6 统计学处理
2 结果
2.1 观察组和对照组的骨质疏松、骨骼肌质量减少发生率的比较
观察组的骨质疏松发生率、骨骼肌质量减少发生率以及骨质疏松合并骨骼肌量减少发生率均明显高于对照组(均P<0.05)。见表1。
表1观察组和对照组骨质疏松及骨骼肌质量减少的发生率比较[n(%)]
Table1Comparison of the osteoporosis and skeletal muscle mass reduction between the observation group and the control group[n(%)]
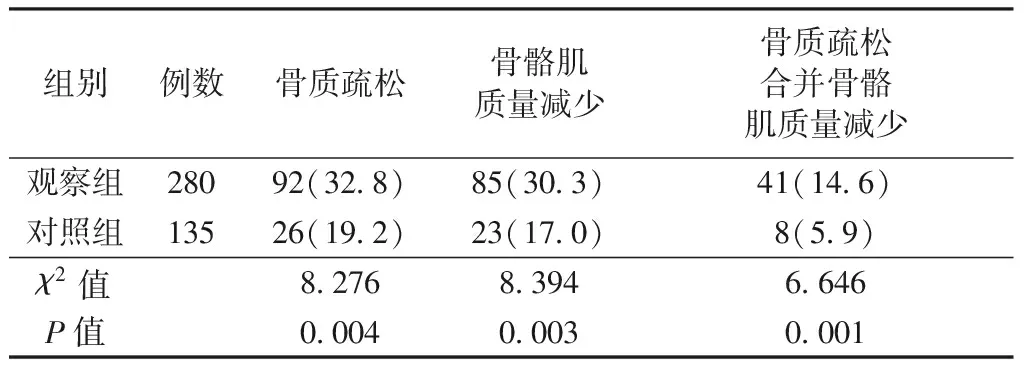
组别例数骨质疏松骨骼肌质量减少骨质疏松合并骨骼肌质量减少观察组28092(32.8)85(30.3)41(14.6)对照组13526(19.2)23(17.0)8(5.9)χ2值8.2768.3946.646P值0.0040.0030.001
2.2 观察组和对照组的骨密度、骨骼肌检测及实验室检查结果的比较
观察组和对照组在腰椎BMD、骨密度T值、ASMI、血清25(OH)D水平以及血生化各项指标方面的差异有统计学意义(均P<0.05)。同时发现,骨密度检测的4个部位中,仅腰椎BMD在两组之间的差异有统计学意义(P<0.05),故选取腰椎BMD作为下文分析的参考指标。见表2。

表2 骨密度、骨骼肌检测及实验室检查结果在两组之间的比较Table 2 Comparison of bone mineral density, skeletal muscle detection, and laboratory examination between the two groups
2.3 老年T2DM患者血清25(OH) D水平差异
进一步比较老年T2DM患者血清中25(OH) D 水平,发现老年T2DM组>老年T2DM+肌少组>老年T2DM+骨松组>老年T2DM +骨松+肌少组。见图1。
2.4 25(OH)D不同程度缺乏的老年糖尿病患者的BMD(腰椎)、ASMI的差异
比较BMD(腰椎)、ASMI在25(OH)D不同程度缺乏的老年糖尿病患者中的差异,发现不同组别中的BMD(腰椎)差异均存在统计学意义(均P<0.05);除了充足组和不足组之间的ASMI的差异无统计学意义(P>0.05),缺乏组和严重缺乏组与各组间的ASMI则差异均有统计学意义(均P<0.05)。见图2。
2.5 相关分析及回归分析
Pearson相关分析发现,老年T2DM患者血清25(OH) D水平与BMD(r=0.703,P<0.05)、ASMI(r=0.536,P<0.05)均呈显著正相关关系,BMD与ASMI (r=0.381,P<0.05)也呈显著正相关关系。见图3。
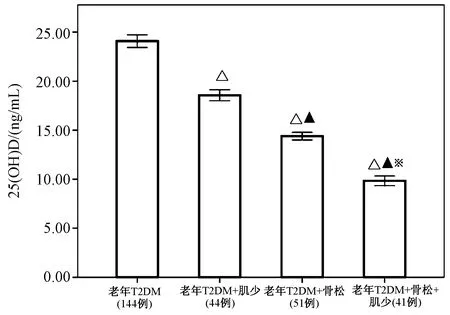
图1 各组老年糖尿病患者的血清25(OH) D 水平的差异注:与老年T2DM组比较,△P<0.05;与老年T2DM+肌少组比较,▲P<0.05;与老年T2DM+骨质疏松组比较,※P<0.05。Fig.1 The differences of serum 25(OH) D between the two groups

图2 25(OH)D不同程度缺乏的老年糖尿病患者的BMD(腰椎)、ASMI的差异注:25(OH)D充足组≥30ng/mL;维生素D不足组≥20且<30 ng/mL;维生素D缺乏组≥10且<20 ng/mL;维生素D严重缺乏组<10 ng/mL。与充足组比较,△P<0.05;与不足组比较,▲P<0.05;与缺乏组比较,※P<0.05。Fig.2 The differences of BMD (lumbar vertebrae) and ASMI among patients with different status of 25(OH) D deficiency
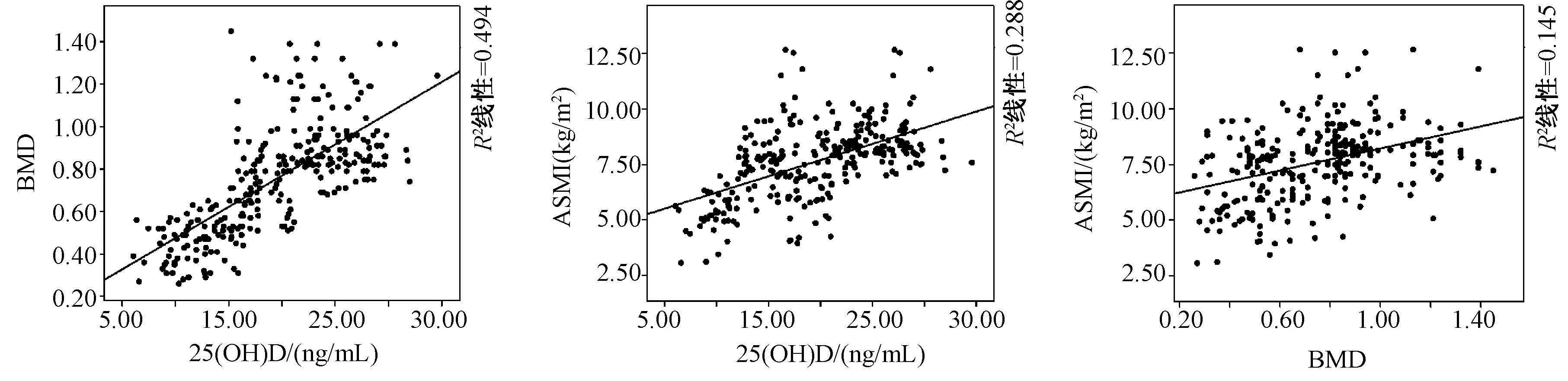
图3 老年T2DM患者的血清25(OH) D水平、BMD、ASMI三者相关性分析Fig.3 Correlation among serum 25(OH) D levels, BMD, and ASMI in elderly patients with T2DM
Logistic回归分析,以所有受试者有无骨质疏松为应变量,自变量为入选的相关因素:有无25(OH)D缺乏、有无糖尿病以及年龄,分析结果发现,患者的血清25(OH) D缺乏(OR=14.47,P=0.005)、糖尿病(OR=8.52,P=0.041)以及年龄因素(OR=1.31,P=0.011)是发生骨质疏松的危险因素;再以所有受试者有无骨骼肌质量减少为应变量,自变量为入选的相关因素:有无25(OH) D缺乏、有无糖尿病以及年龄,分析结果发现,患者的血清25(OH) D缺乏(OR=11.59,P=0.015)和年龄因素(OR=1.268,P=0.025)是发生骨骼肌质量减少的危险因素。
3 讨论
我国在2008年、2013年T2DM患病率调查显示,老年人(≥60 岁)T2DM的患病率均在20%以上[10]。老年糖尿病患者容易发生多种合并症,其中骨质疏松、骨骼肌质量减少较为常见[11]。骨质疏松以腰酸背痛及肌肉疼痛为主要症状,严重者甚至导致骨折,影响患者的生活质量[12]。骨骼肌质量减少常与增龄、内分泌代谢异常、营养摄入不足等有关,易引起肌肉衰减综合征,是老年人死亡的独立危险因素[10]。
糖尿病患者的骨质疏松发病率远高于正常人群,Schwartz等[13]报道T2DM患者骨质疏松发生率可达20%~60%。本研究中,老年T2DM患者骨质疏松的发生率为32.8%,明显高于对照组(19.2%)。既往研究证实,骨骼肌质量和功能随年龄增加而不断衰减,一般50岁以上人群的骨骼肌质量以平均1%~2%的速度逐年减少,60岁以上肌肉慢性丢失量约为30%,80岁以上约丢失50%[14]。近年来,越来越多的研究者发现糖尿病与肌少症存在联系,甚至认为肌少症是糖尿病的一种并发症。国外Kim等[15]研究发现,60岁以上糖尿病患者中,男性肌少症患病率为19%,女性为27%。李亚奥[16]研究亦发现,北京地区55岁以上男性T2DM患者肌少发病率为28.57%,而本研究老年T2DM患者骨骼肌质量减少的发生率为30.3%,与李奥亚的结果基本一致,高于国外研究结果。种族不同、研究对象来源不同、诊断标准不同等可能是患病率差异存在的原因,另一方面或许可以说明我国老年T2DM患者的骨骼肌质量减少情况更为严重。骨质疏松及骨骼肌质量减少在老年2型糖尿病患者中是普遍存在的,发病率远远高于血糖正常人群,这三者之间的影响因素目前尚不明确,本研究发现25(OH) D在其中发挥重要作用。
老年T2DM患者普遍存在25(OH) D缺乏现象,可能与增龄、胰岛素抵抗以及胰岛β细胞功能降低有关;25(OH) D缺乏又会加重胰岛素抵抗,进一步引起血糖升高,有研究表明,低水平25 (OH) D是老年T2DM的独立危险因素[14],25(OH)D水平的变化可以作为预测老年T2DM病变严重程度的指标之一。本研究结果显示,老年T2DM患者25(OH) D 平均水平为(19.36±6.2)ng /mL,显著低于对照组水平(21.85±3.5)ng /mL。
维生素D的基本生理功能是调节钙磷代谢,主要通过以下途径调节钙磷代谢:①促进肠钙的吸收、提高血钙浓度、促进骨骼矿化;②抑制PTH的合成和分泌; ③作用于成骨细胞及破骨细胞,促进骨吸收,同时也促进Ⅰ型胶原和骨钙素的合成。既往多项研究显示维生素D缺乏与中老年人甲状旁腺素水平增高、骨吸收增加、骨量丢失、跌倒和骨折风险升高呈相关性,是发生骨质疏松的危险因素。另一方面,维生素D与肌细胞上的特异性受体相结合,促进肌细胞分化、增殖和相关蛋白质合成,从而増加骨骼肌的质量和改善肌肉功能[5]。在基因学水平上,维生素D可能通过调控某种骨骼肌相关蛋白的表达水平来影响肌肉的质量和功能[17]。大规模前瞻性研究发现,维生素D水平下降与骨骼肌力量及质量下降有关,存在剂量-反应关系[18]。而本研究中通过比较老年2型糖尿病合并骨质疏松、骨骼肌质量减少患者血清中25(OH) D水平,发现老年T2DM组>老年T2DM+骨质疏松组>老年T2DM+肌少组>老年T2DM +骨质疏松+肌少组。25(OH) D在老年T2DM同时合并骨质疏松、骨骼肌质量减少患者中水平最低,提示25(OH) D 的缺乏既增加老年T2DM患者骨质疏松的风险性,又增加骨骼肌质量减少的风险。
通过相关分析发现,老年T2DM患者血清25(OH) D水平与BMD、ASMI呈显著正相关关系,BMD与ASMI也呈显著正相关关系。既往研究表明,骨骼肌质量减少是骨质疏松发生的危险因素[19]。骨肉相连,骨骼肌所产生的机械负荷调节对成骨细胞形成骨结构、增强骨密度起着重要的刺激作用,一旦骨骼肌的质量和力量下降,造成骨吸收增加、骨形成减少,极易导致骨质疏松[18],本研究与此相符合。
通过Logistic多元回归分析发现,患者的血清25(OH) D缺乏和年龄因素是发生肌少症的危险因素;而发生骨质疏松的危险因素除了上述二者,糖尿病亦是其中不可忽视的重要因素。
综上所述,维生素D缺乏、骨质疏松、骨骼肌质量减少在老年T2DM患者中的发病率均高于正常老年人群。维生素D缺乏是老年T2DM患者骨质疏松与骨骼肌质量减少共同的危险因素,维生素D越低,老年T2DM患者骨质疏松、骨骼肌质量减少越严重。因此,对老年T2DM尤其是合并骨质疏松、骨骼肌质量减少的人群应及时进行25(OH)D水平的早期检测、早期筛查以实现早期预防和及时干预。维生素D的补充治疗或许可以改善老年2型糖尿病患者骨质疏松以及骨骼肌质量减少的预后。

