基于Cyclin D1基因敲减探讨健骨颗粒促进成骨细胞增殖的机理
杨娟 贾晓康 张楚天 黄云梅 黄美雅 张志恒 孙攀 吴银生 林燕萍
福建中医药大学,福建 福州 350122
骨质疏松症(osteoporosis,OP)是一种以骨量减少、骨的细微结构发生改变、骨脆性增加并易于发生骨折为特点的全身性骨骼疾病[1]。根据国际骨质疏松症基金会的一项最新研究[2]显示,我国骨质疏松疾病的总患病率为6.6%~19.3%,平均高达13%。据2013年人口普查结果显示,超过60岁的老人约为2.02亿,推测至2050年这一数字可能上升至4亿,其中骨质疏松症或表现出骨密度低下的患者将达到2.12亿[3]。生活中人们常常忽视OP的存在,直到发生骨折才被察觉,因此OP也被形象地称作“无声无息的疾病”。骨质疏松症患者早期无明显症状,且缺少有效的诊治方法,其引起的高骨折率导致了许多患者残疾和早逝,给中老年人特别是绝经后妇女的生活带来了严重困扰。研究发现[4],绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)的发生与诸多因素有关,与女性绝经后雌激素的缺乏关系密切。雌激素的缺乏使成骨细胞和破骨细胞的功能发生改变,骨转换速度加快使得骨吸收大于骨形成,导致骨密度降低,从而形成绝经后骨质疏松症。成骨细胞对骨形成、骨代谢和维持成年骨骼系统的正常状态都发挥着重要作用[5]。因此,探讨成骨细胞增殖是研究绝经后骨质疏松症的重点方向之一。
Cyclin D1是调控细胞周期G1期的关键蛋白,可以推动细胞周期由G1/S检测点进入S期[6-7]。前期研究表明[8-9],成骨细胞中存在Cyclin D1、CDK4等细胞周期调控蛋白的表达,成骨细胞的增殖与Cyclin D1密切相关。而健骨颗粒能调控成骨细胞G1/S期,加快细胞周期总体进程,促进成骨细胞增殖。本研究将以Cyclin D1基因敲减为切入点,观察基因敲减后各项指标的表达情况,探讨健骨颗粒促进成骨细胞增殖的具体作用机制。
1 材料与方法
1.1 实验材料
1.1.1实验药物:健骨颗粒由煅狗骨、淫羊藿、山茱萸、山药、党参等药物组成,原药材购自福建省医药公司,由福建中医药研究院中试车间负责加工制备,每克健骨颗粒含原生药2.9 g。
1.1.2实验动物:3月龄SPF级雄性SD大鼠20只,体重(322±20)g,由上海克莱实验动物有限公司提供,许可证号:SCXK(沪)2012-0002,合格证编号:2007000562039。饲养于福建中医药大学医学实验动物中心,每笼5只,室温、通风良好、自然光照、自由饮食和活动。
1.1.3实验试剂:胎牛血清(美国Gbico公司);DMEM高糖培养基(新西兰Hyclone公司);CCK8试剂盒、β-action抗体、Cyclin D1抗体(武汉三鹰生物技术有限公司);Cyclin D1、 Cyclin E、CDK4、E2F1 PCR引物(上海生物工程技术有限公司);YBR Premix Ex TaqTM PCR Kit(日本TaKaRa公司);sgRNA-EGFP/sgRNA-ERFP/sgRNA-puro慢病毒颗粒、Cas9-puro慢病毒颗粒、普适型阴性对照 sgRNA-EGFP慢病毒颗粒(上海吉凯基因公司)。
1.2 实验方法
1.2.1含药血清的制备:将3月龄SPF级雄性SD大鼠随机分为健骨颗粒组、生理盐水组,每组10只,分别以健骨颗粒2 g (kg·d)、生理盐水2 mL灌胃7 d,于最后一次灌胃1 h后取腹主动脉血制备成含药血清,-20 ℃保存备用。
1.2.2细胞的传代培养:用含10%胎牛血清的DMEM培养液,将成骨样细胞株UMR-106在37 ℃、5% CO2的细胞培养箱中培养。每天换液一次,3 d传代一次。
1.2.3CRISPR/Cas9基因编辑技术敲减成骨样细胞Cyclin D1基因
1.2.3.1感染Cas9慢病毒,构建稳定细胞株:取状态良好处于对数生长的成骨样细胞UMR-106,通过胰酶消化法分离收集,根据公式(病毒量=MOI×细胞数量/病毒滴度)得出Cas9慢病毒体积,将病毒LV-LV-Cas9-Puro(7768-1)加入六孔板中进行培养,对细胞进行筛选以得到稳定表达Cas9的混合克隆细胞株。
1.2.3.2感染sgRNA慢病毒,敲减Cyclin D1基因:通过胰酶消化法分离收集生长状态良好的Cas9混合克隆细胞株,配置成5×104个/mL的细胞悬液,分为阴性对照组和基因敲减组。根据公式算出sgRNA慢病毒和普适型阴性对照sgRNA-EGFP 慢病毒颗粒体积(sgRNA基因序列:CTCGCAGCACCCGGTCGTTG)后将病毒加入六孔板孔中。观察细胞并于培养72 h后在荧光显微镜下观察GFP表达情况,在感染120 h后收集细胞检测或进行下游实验。
1.2.3.3Surveyor法(错配酶法)活性检验:感染慢病毒5~7 d后,收集细胞,抽提细胞混合克隆基因组,以sgRNA感染的细胞群DNA为阴性对照,以感染靶位点sgRNA的细胞群为实验组;靶序列PCR扩增后经过变性,退火,形成错配,从而被错配酶识别并剪切。产物跑电泳,比较切割条带和未切割条带的比例,反映出Cas9/sgRNA的活性。
1.2.3.4Western-bolt验证基因敲减细胞:取生长状态良好的成骨样细胞,用生理盐水含药血清分别干预正常成骨样细胞、病毒载体阴性对照组、基因减除+成骨样细胞48 h,运用Western-bolt验证基因敲减细胞中Cyclin D1是否存在。
1.2.3.5成骨样细胞增殖曲线分析:将生长状态良好的成骨样细胞、基因敲减+成骨样细胞、阴性对照组细胞,接种于96孔板中,分别于培养1、2、3、4、5、6、7、8 d后每组每次取8个孔,加入CCK8溶液,37 ℃恒温培养4 h。用酶标仪检测OD值绘制生长曲线。
1.2.4检测不同浓度健骨颗粒含药血清对成骨样细胞增殖的影响:每组设6个血清浓度,用CCK8法检测并得出促细胞增殖的最佳含药血清浓度。
1.2.5实时荧光定量PCR检测细胞中Cyclin D1、Cyclin E、CDK 2、CDK 4、Rb及E2F-1 mRNA的表达:用Trizol法提取细胞总RNA,当OD 260/OD 280值在1.8~2.0时,说明提取的RNA纯度较好。根据反转录试剂盒提供的实验步骤进行反转录,合成 Cyclin D1、Cyclin E、CDK 2、CDK 4、Rb及E2F-1扩增引物,根据两步法标准采用实时荧光定量SYBR GREEN PCR法检测扩增程序进行扩增,用参照基因GAPDH对所有样品进行校正,通过7500型实时定量PCR仪软件分析,得到RT-PCR扩增曲线和溶解曲线,并比较组间mRNA的相对含量。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.3 统计学处理
2 实验结果
2.1 成骨样细胞Cyclin D1基因敲减的鉴定
2.1.1观察细胞感染效率:感染sgRNA慢病毒72 h后, 成骨样细胞GFP荧光表达率达80%以上(图1)。

图1 荧光显微镜同视野下观察GFP表达情况(A、B均为感染sgRNA慢病毒的Cas9混合克隆细胞)Fig.1 Expression of GFP under the observation of fluorescence microscope in the same field (×100) (A, B are all Cas9 mixed cloned cells infected with sgRNA slow virus)

图4 各组细胞生长曲线Fig.4 Cell growth curves of each group
2.1.2Surveyor法(错配酶法)检测sgRNA活性:由图2可见,与对照组相比,实验组在预期位置出现了切割条带,说明sgRNA具有活性,可以进行后续实验。
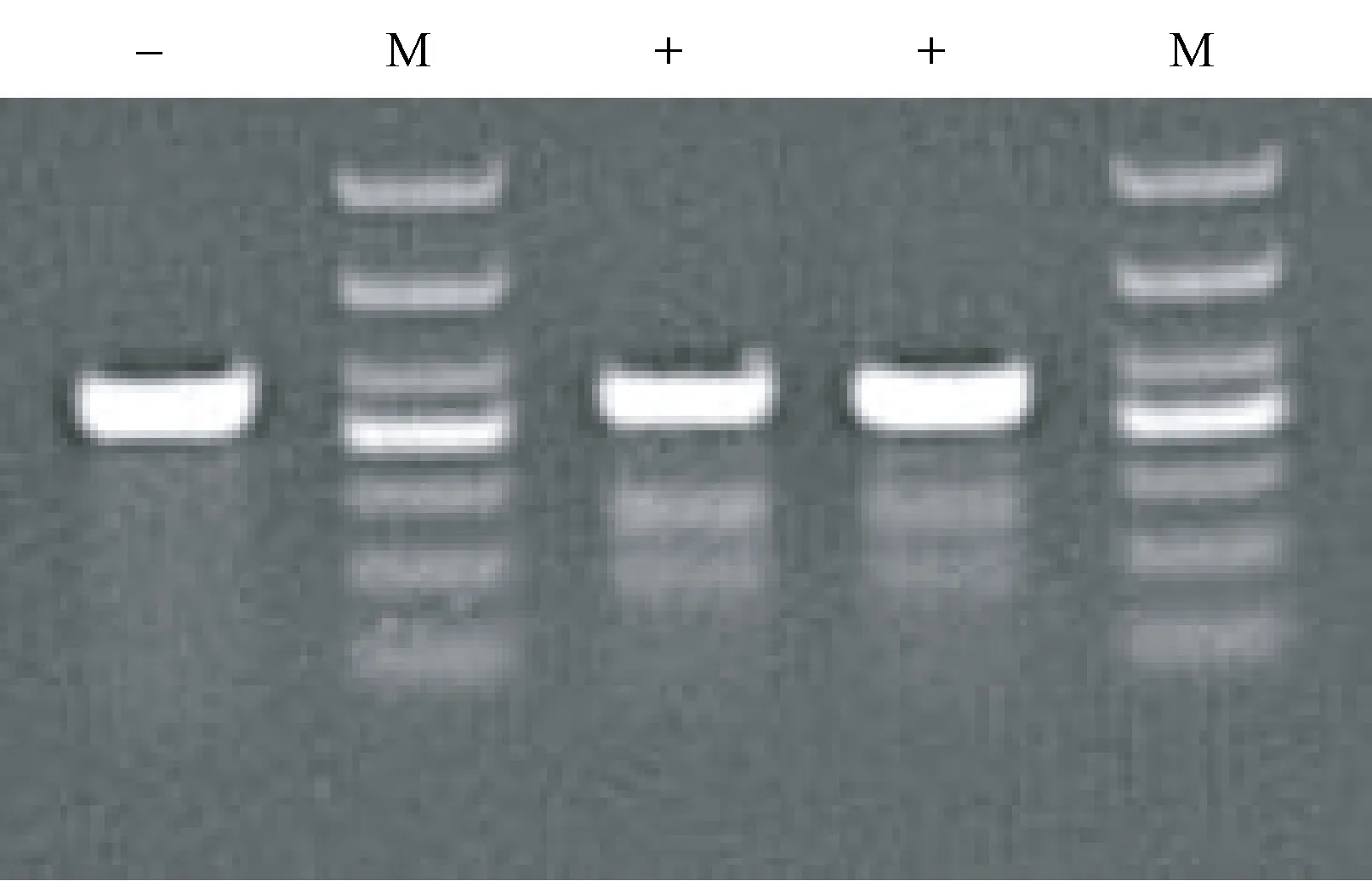
图2 Surveyor法(错配酶法)检测sgRNA活性(-:对照sgRNA感染的细胞群DNA;+:感染靶位点sgRNA的细胞群DNA;M:Marker)Fig.2 Test of sgRNA activity by the Surveyor method (-: control of sgRNA infected cell group DNA; +: cell group DNA infected with Target point sgRNA; M: Marker)
2.1.3Western-bolt验证基因敲减细胞:结果显示,正常细胞和病毒载体阴性对照组Cyclin D1表达明显,而基因敲减细胞表达为明显下降(图3)。

图3 Western-bolt 验证基因敲减细胞(1:正常细胞组;2:病毒载体阴性对照组;3:基因敲减组)Fig.3 Western-bolt verifies gene knock-down cells (1: normal cells; 2: virus empty vector cell group; 3: gene knock-down group)
2.2 成骨样细胞增殖曲线分析
通过CCK8法检测成骨样细胞增殖曲线。结果显示,正常细胞和病毒载体阴性对照组细胞在24 h时增殖较慢,24 h后开始加速进入指数生长期;分别于第3天和第4天达到顶峰后开始缓慢生长,随着培养时间的推移,第7天、第8天开始出现增殖抑制。而基因敲减细胞组较前两组生长缓慢,无明显增殖高峰,培养8 d后出现增殖抑制。见图4。
2.3 不同浓度健骨颗粒含药血清对成骨样细胞增殖的影响
CCK8法检测结果显示:含药血清干预48 h后,与正常细胞生理盐水组相比,正常细胞健骨颗粒组增殖速度变快,病毒载体阴性对照组增殖速度无明显差异,基因敲减+生理盐水组和基因敲减+健骨颗粒组增殖速度减慢;与正常细胞健骨颗粒组相比,基因敲减+健骨颗粒组增殖速度减慢;与基因敲减+生理盐水组相比,基因敲减+健骨颗粒组增殖速度无显著差异。当浓度达到10%时,细胞增殖速度明显加快,随着血清浓度继续增高,增殖速度变慢。见图5。
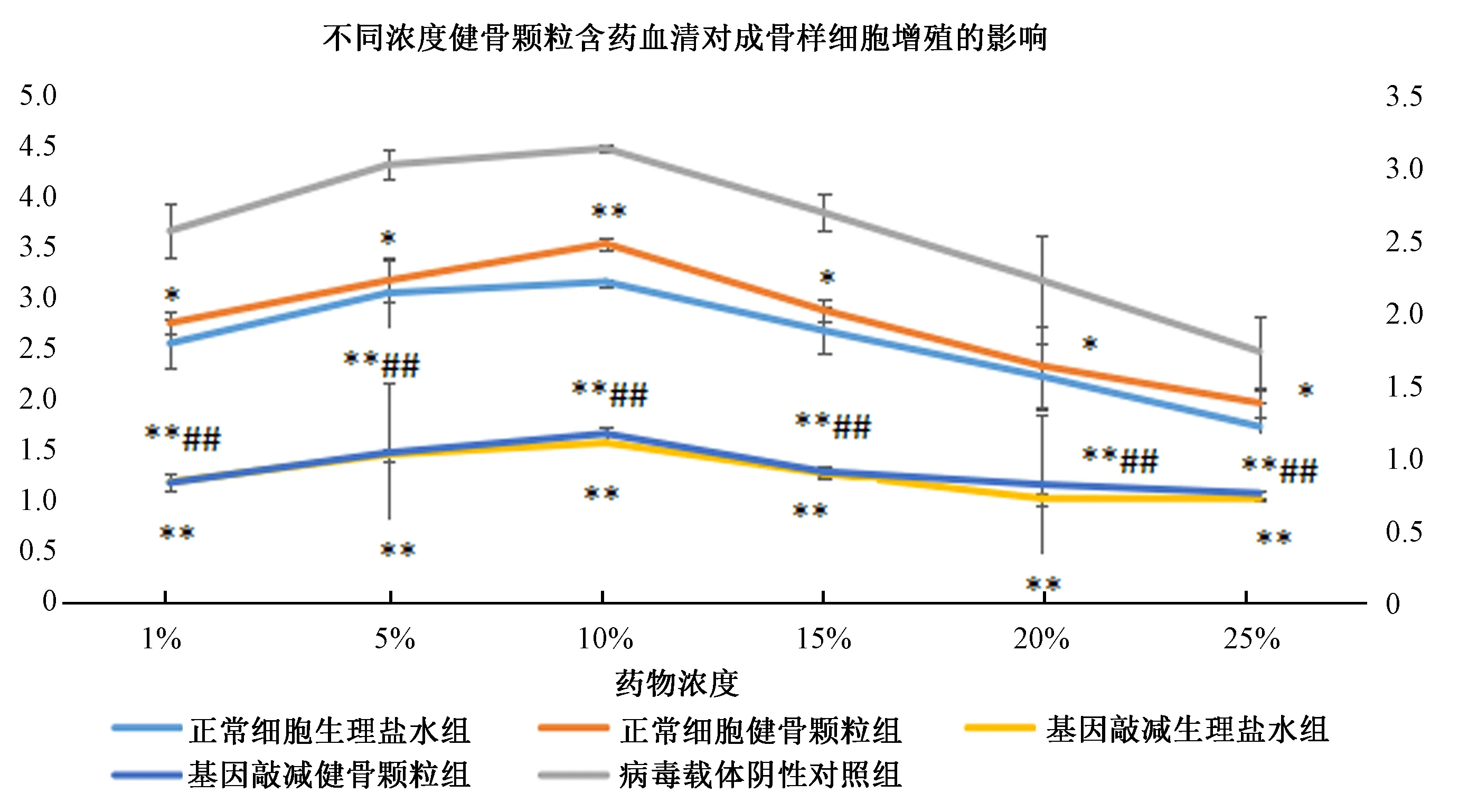
图5 不同浓度健骨颗粒含药血清对成骨样细胞增殖的影响(与正常细胞生理盐水组比较,*P<0.05,**P<0.01;与正常细胞健骨颗粒组比较,#P<0.05,##P<0.01)Fig.5 Effects of serum containing different concentrations of Jiangu granule on osteoblast proliferation (vs normal cells + saline group, *P<0.05,**P<0.01; vs normal cells + Jiangu granule group, #P<0.05,##P<0.01)
2.4 各组成骨样细胞中Cyclin D1、Cyclin E、CDK2、CDK4、Rb及E2F-1 mRNA表达水平的荧光定量RT-PCR分析结果
荧光定量RT-PCR结果显示,含药血清干预24、48、72 h的细胞组Cyclin D1、CDK2、Rb及E2F-1的mRNA呈逐渐增高趋势,随时间同步增长,而各细胞组CDK4、Cyclin E的mRNA表达在48 h时为最高,48 h后开始下降;组间比较显示,各组细胞含药血清干预24、48、72 h后,与正常细胞+生理盐水组相比,正常细胞+健骨颗粒组Cyclin D1、CDK2、CDK4、Cyclin E、Rb及E2F-1 mRNA表达明显增高,病毒载体阴性对照组无统计学意义,基因敲减+生理盐水组和基因敲减+健骨颗粒组Cyclin D1、CDK2、Rb及E2F-1 mRNA表达明显降低;与正常细胞生理盐水组相比,基因敲减+生理盐水组和基因敲减+健骨颗粒组干预48 h的CDK4 mRNA表达和干预24 h的Cyclin E mRNA表达明显降低,其他时间段无统计学意义;与正常细胞健骨颗粒组相比,基因敲减+健骨颗粒组mRNA表达显著降低;与基因敲减+生理盐水组相比,基因敲减+健骨颗粒组mRNA表达无统计学意义。见图6。

图6 荧光定量RT-PCR分析结果(与正常细胞生理盐水组比较,*P<0.05,**P<0.01;与正常细胞健骨颗粒组比较,#P<0.05,##P<0.01)Fig.6 Fluorescence quantitative RT-PCR analysis results (vs normal cells + saline group, *P<0.05,**P<0.01; vs normal cells + Jiangu granule group, #P<0.05,##P<0.01)
3 讨论
Cyclin D1在细胞增殖过程中起着关键作用[10]。在G1期初期,有丝分裂信号刺激Cyclin D蛋白合成,转运CDK4、CDK6进入细胞核,进而完成下游蛋白的调控,使细胞周期进入S期。研究表明[11-13],在G1期和G1/S期监测点存在Cyclin D1、CDK2、CDK4、Cyclin E、Rb及E2F-1等调节蛋白,通过调控这些蛋白,可以调节细胞周期进程,从而影响细胞增殖周期。本研究通过体外培养成骨样细胞UMR-106,利用CRISPR/Cas9技术敲减Cyclin D1基因,在荧光显微镜下观察GFP表达情况。结果显示,荧光率达到80%以上,Surveyor法(错配酶法)活性检验证明sgRNA具有活性,Western Blot法检测Cyclin D1蛋白表达明显下降,因此可确认Cyclin D1基因被成功敲减,可进行后续研究。
CCK8法和RT-PCR检测结果显示,成骨样细胞Cyclin D1基因敲减后,增值速度明显慢于正常成骨样细胞和病毒载体阴性对照组细胞;而细胞周期调节蛋白Cyclin D1、CDK 2、CDK 4、Cyclin E、Rb及E2F-1的mRNA表达水平明显低于正常成骨样细胞,增殖速度减缓。通过结果可以推断,成骨样细胞Cyclin D1基因敲减降低G1期调节蛋白Cyclin D1表达,其下游蛋白CDK 4、Cyclin E及E2F-1随之下降,从而减缓成骨样细胞增殖周期;证实Cyclin D1以及下游信号蛋白的调控是成骨细胞增殖周期的重要环节,Cyclin D1 是成骨样细胞增殖周期的关键点;通过上调Cyclin D1以及下游信号蛋白表达,可以加速细胞周期进程,促进成骨细胞增殖。
祖国医学认为肾亏脾虚是绝经后骨质疏松症的发病基础[14],肾虚为骨质疏松症发生的根本,而脾虚是骨质疏松症产生的重要病机,以补肾健脾、强筋壮骨为治疗之法,可有效防止人体骨量的丢失[15]。根据骨质疏松症的发病机理,近年来运用补肾方药探讨骨质疏松症分子生物学机制成为基础医学研究的热点[16-17]。在临床研究和基础实验中发现复方中药能够促进成骨细胞增殖分化、提高骨密度[18]。林燕萍等[9]针对绝经后骨质疏松症“肾亏脾虚”的病机特点,以“补先后天”的理论为组方原则,选用煅狗骨、淫羊藿、山茱萸、党参、山药等组成补肾健脾中药健骨颗粒。前期研究结果表明[19],补肾中药健骨颗粒可以提高骨组织中成骨细胞的数量及功能,加速骨合成代谢,从而使骨形成大于骨吸收。同时还发现健骨颗粒能上调成骨细胞Cyclin D1和CDK4的mRNA以及蛋白的表达,下调负性因子p21表达,促使成骨细胞细胞周期加速由G1/S检查点进入S期,促进成骨细胞增殖。因此,本课题采用CRISPR/Cas9基因编辑技术敲减成骨样细胞Cyclin D1基因,进一步探讨健骨颗粒是否能够通过Cyclin D1及其下游蛋白组成的信号通路促进成骨细胞增殖。研究结果显示,正常细胞健骨颗粒组的Cyclin D1、CDK2、CDK4、Cyclin E、Rb及E2F-1的mRNA表达高于正常细胞生理盐水组;而Cyclin D1基因敲减后,正常细胞健骨颗粒组mRNA的表达水平明显高于基因敲减+健骨颗粒组,基因敲减+生理盐水组和基因敲减+健骨颗粒组的mRNA没有明显差异。表明健骨颗粒可以提高体外培养成骨样细胞调节蛋白Cyclin D1、CDK2、CDK4、Cyclin E、Rb及E2F-1的表达,推进成骨样细胞细胞周期的进程,促进成骨样细胞增殖。且Cyclin D1在成骨样细胞增殖过程对下游信号蛋白也有着重要调节作用,Cyclin D1基因的敲减直接影响着CDK2、CDK4、Cyclin E、Rb及E2F-1的表达,进而影响成骨样细胞增殖,这也验证了健骨颗粒含药血清可以通过调节Cyclin D1,进而调节下游相关信号蛋白表达来促进成骨样细胞增殖。
本研究结果表明,健骨颗粒能够通过调节Cyclin D1及其下游信号推进细胞周期进程,促进成骨细胞增殖,达到防治骨质疏松症的目的。证明了补肾健脾中药“补先后天”理论的科学性,为健骨颗粒的临床应用提供了实验理论依据。

