罗非鱼鱼皮肽的体外ACE抑制活性、消化性及分子对接对比
陈佳丽,杨胜涛,萧振邦,千忠吉,3
罗非鱼鱼皮肽的体外ACE抑制活性、消化性及分子对接对比
陈佳丽1,杨胜涛1,萧振邦2,千忠吉2,3
(1. 广东海洋大学食品科技学院,广东 湛江 524088;2. 广东海洋大学化学与环境学院,广东 湛江 524088;3. 广东海洋大学深圳研究院,广东 深圳 518108)
【】分析罗非鱼鱼皮多肽LSGYGP的ACE抑制活性、胃肠道消化稳定性以及与降压药卡托普利在分子对接的对比。用HHL法测定多肽的IC50值和抑制模式,测定多肽在模拟胃肠道消化中的稳定性,MTT法检测细胞活力,Western blot法检测诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)、内皮素-1(ET-1)等蛋白表达情况,将多肽、卡托普利分别与ACE进行分子对接对比分析。LSGYGP的半抑制率(IC50)值为2.57 μmol/L,表现为混合非竞争性抑制,4 h内模拟胃肠道消化较为稳定;MTT法验证多肽LSGYGP对HUVEC细胞无毒性作用(> 0.05),且能明显提高Ang II诱导组的HUVEC细胞活力(< 0.01);与对照组相比,随实验组多肽浓度增加,iNOS、COX-2和ET-1的表达明显逐渐减少(< 0.001)。对接结果表明,氢键是LSGYGP与ACE结合结构中的支撑力,而卡托普利通常与ACE的Zn2+离子形成紧密结合的相互作用。消化稳定的罗非鱼鱼皮多肽可明显抑制血管收缩因子和炎症因子的表达,展现了较好ACE抑制活性,LSGYGP与卡托普利的活性差异可能是由于ACE分子对接的作用力不同,这些可作为研发少副作用ACE抑制剂的药理基础。
罗非鱼鱼皮多肽;HUVEC;模拟胃肠道消化;分子对接
高血压作为导致高死亡的心血管疾病之一,它会影响动脉粥样硬化、心肌梗塞以及其他心血管疾病的发病率及发病过程,从而影响患者的行为能力和生活质量[1]。原发性高血压作为病因尚未明确的一类高血压,有研究发现它可能与血管内皮细胞中炎症细胞因子和氧化应激引起的血管内皮功能障碍的机制相关[2],目前一些公认疗效较好的抗高血压药物被发现存在抗氧化和抗炎活性[3]。如今,高血压最常见的治疗方式是ACE抑制剂,它已成为主要靶点[4]。以卡托普利为代表的血管紧张素转换酶抑制剂(ACEI)是市面上常用的降压药,降压效果显著,对血脂和血糖的代谢没有影响,但却有咽痒干咳、心悸、肾损害等不良反应[5],因此从其他来源寻找天然少副作用的药物替代品是现阶段研究的热点。
在我国罗非鱼()产量逐年增加,但在罗非鱼片加工过程中存在大量的废物,鱼骨和皮肤中约有80%的蛋白质未得到充分利用[6]。特别是罗非鱼的鳞片和皮肤中的明胶和胶原蛋白,它可以水解成优良的生物活性肽和营养食物资源。生物活性肽(2~50个氨基酸残基)已逐渐成为重要的食药资源,文献报道罗非鱼鱼骨和皮肤中的2种蛋白质可能是抗高血压肽的前体[7],且罗非鱼肽具有抗氧化[8]、抗高血压[9]、抗光老化[10]等活性。罗非鱼鱼皮明胶多肽Leu-Ser-Gly-Tyr-Gly-Pro(LSGYGP)在之前研究[10]中已被分离纯化,其分子质量为592.26 u,但其降压活性和机理尚未见报道。因此,本研究通过HHL法测定ACE抑制率、Western blot法检测相关血管收缩因子表达情况,分析LSGYGP的ACE抑制活性,并对多肽进行模拟胃肠道消化研究,将多肽与降压药卡托普利进行分子对接对比,以期为新型降压药物的设计、合成与发展提供理论基础,同时为开发高附加值罗非鱼产品开辟新途径。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂与细胞株 人血管紧张素转换酶(ACE,EC 3.4.15.1)、马尿酰-组氨酰-亮氨酸(HHL)、卡托普利、四甲基偶氮唑盐(MTT)购于美国Sigma公司;胃蛋白酶(源于猪胃)、α-胰凝乳蛋白酶(源于猪胰脏)购于上海阿拉丁有限公司。罗非鱼鱼皮多肽LSGYGP由丹港生物科技公司合成,其纯度为98%,保存温度≤-20 ℃。人脐静脉内皮细胞HUVEC购于苏州北纳创联生物技术有限公司;DMEM高糖培养基、胰蛋白酶、青霉素/链霉素购于美国Hyclone公司;胎牛血清FBS购于美国Gibco公司。BCA蛋白试剂盒、预染蛋白marker购于上海Thermo Scientific有限公司;细胞裂解液、PMSF、5X蛋白上样缓冲液等购于上海碧云天生物技术有限公司;一抗鼠源iNOS、COX-2、ET-1、二抗羊抗鼠IgG购于Santa Cruz生物技术公司;0.22 μm硝酸纤维素膜NC膜和ECL化学发光液购于GE Amersham公司。
1.1.2 仪器和设备 二氧化碳培养箱,松下健康医疗器械株式会社;超净工作台,苏洁医疗器械(苏州)有限公司;倒置显微镜,广州吉迪有限公司;酶标仪,Bioteck仪器公司;小型垂直电泳槽、电转槽,Bio-Rad公司;摇床,SCILOGEX公司;金属浴,上海一恒公司;全自动化学发光成像分析系统,上海天能科技有限公司。
1.2 方法
1.2.1 HHL法测定ACE抑制率 ACE抑制率的测定使用修改后的Cushman等[11]方法。将各种浓度的LSGYGP溶液(0.25、0.50、1.00、2.50、5.00 μmol/L,各50 μL)和ACE溶液(25×10-3U/mL,50 μL)在37 ℃下水浴10 min,然后加入150 μL 25 mmol/L HHL底物在37 ℃下水浴反应1 h,加入250 μL 1 mol/L HCl终止反应。用500 μL乙酸乙酯震荡提取生成的马尿酸,以3 000 r/min条件离心10 min,将200 μL上清液置于110 ℃的干燥烘箱中直至溶液完全蒸发。将残余物溶解在1 mL蒸馏水中,并使用酶标仪在228 nm下测量其UV光谱密度。ACE抑制率(%)通过以下等式计算:
ACE抑制率=(C-)/(C-B)×100%,
其中,C是无样品的光密度,是ACE和样品存在时的光密度,B是空白(在HHL之前加入盐酸以提前终止反应)的光密度。
1.2.2 ACE抑制模式的测定 根据Bush等[12]的方法稍作修改,将不同浓度(0.25、0.50、1.00、2.50和5.00 μmol/L)的LSGYGP添加到混合物中测量抑制率,用GraphPad Prism 5.0软件制作Lineweaver-Burk图[13],从而分析LSGYGP的抑制模式。
1.2.3 模拟胃肠道消化 根据前人方法[14],将酶与底物质量比为1∶100的胃蛋白酶加入到含有20 mg/mL的罗非鱼鱼皮多肽的缓冲溶液中(pH 2.00)。混合后在37 ℃下振荡孵育2 h,用饱和NaHCO3溶液将pH值调节至5.30,加入α-胰凝乳蛋白酶(酶与底物质量比1∶100),用1 mol/L NaOH将pH调节至7.00,混合后再次在37 ℃下振荡孵育2 h。最后,将肽消化液在沸水中加热10 min致酶失活。收集肽消化溶液用于进一步测定蛋白质水平,按照BCA蛋白质测定试剂盒的说明进行操作。水解度DH(%)通过以下等式计算:
DH =[1 -(C-)/C]×100%,
其中,C是未加酶的消化液光密度值,是肽和酶存在下消化液的光密度值。
1.2.4 细胞培养与分组 将HUVEC细胞放在体积分数10%FBS、1%青霉素/链霉素的DMEM中于37 ℃、CO2气体百分比为5%的空气环境中培养。对细胞设置空白组(B:细胞+培养基)、对照组(C:细胞+培养基+ 1 μmol/L Ang II)、实验组(细胞+培养基+ 1 μmol/L Ang II+不同浓度LSGYGP)。
1.2.5 MTT法检测样品毒性 通过MTT法测定评估细胞毒性,HUVEC细胞按细胞数1×104/孔接种于96孔板中贴壁后,加入1、2、5、10 μL的1 mmol/L LSGYGP(使其在100 μL培养基中的终浓度为10、20、50、100 μmol/L)孵育24 h。弃去培养基,向每孔加入100 μL 1 mg/mL MTT溶液,放入培养箱中避光培养4 h。小心吸取MTT溶液,然后再向每孔加入100 μL DMSO溶液(纯度 > 99.50%),摇床上避光摇晃10 min以充分溶解生成的甲瓒晶体,使用酶标仪测定(540 nm)。
1.2.6 LSGYGP对Ang II诱导HUVEC的保护作用 通过MTT法测定评估细胞毒性,HUVEC细胞按细胞数1×104/孔接种于96孔板中贴壁后,加入1、2、5、10 μL的1 mmol/L LSGYGP(使其在100 μL培养基中的终浓度为10、20、50、100 μmol/L)预处理1 h,后加入1 μL 1 mmol/L Ang II孵育24 h[15]。弃去培养基,向每孔加入100 μL 1 mg/mL MTT溶液,放入培养箱中避光培养4 h。吸取MTT溶液,向每孔加入100 μL DMSO溶液(纯度 > 99.50%),摇床上避光摇晃10 min以充分溶解生成的甲瓒晶体,使用酶标仪测定(540 nm)。
1.2.7 Western blot法检测相关蛋白表达 调整六孔板中HUVEC细胞密度为5×106个/孔,细胞分组处理同上。24 h后,弃培养液,用50~100 μL RIPA细胞裂解液(内含10 mmol/L苯甲基磺酰氟PMSF)于离心管中裂解刮下来的细胞,充分吹打细胞,移取上清液。检测蛋白浓度后,分别用不同体积分数的SDS-PAGE凝胶分离蛋白(体积分数8%的胶分离130 ku的iNOS;体积分数10%的胶分离72 ku的COX-2、42 ku的β-actin和24 ku的ET-1),根据所测的蛋白浓度调整蛋白上样量为20~40 μg,加入上样缓冲液95 ℃加热10 min使得蛋白变性。上样后调节电压为80 V电泳20 min,后调节电压120 V电泳80 min。采用湿转法电流恒流300 mA,转膜1 h。将NC膜转移至孵育盒,加入质量分数为5%的脱脂奶粉,室温封闭2 h,用TBST溶液洗涤NC膜3次,每次10 min,按照1∶1000比例稀释一抗,过夜孵育。吸弃一抗,再洗3次,按照1∶5000比例稀释二抗。吸弃二抗,用TBST溶液洗膜3次。将ECL化学发光液试剂盒中的A、B液按1:1均匀混合,用Tanon化学发光工作站进行拍照。
1.2.8 分子对接模拟 从蛋白质数据库(http:// www.rcsb.org)下载ACE的天然晶体结构(PDB代码:1O8A)和卡托普利(PDB代码:1UZF)的晶体复合结构。用Discovery Studio 3.5 模块CDOCKER将配体分子与受体活性位点进行对接。首先采用高温动力学方法随机搜索小分子构象,然后通过模拟退火方法优化受体活性位点区域的各构象,使对接结果更加准确;导入多肽模型,并进行相关优化(加氢,加CHAEMm力场和Momany-Rone电荷,并进行结构优化);对受体1O8A进行相关优化(加氢,加CHAEMm力场和Momany-Rone电荷,并进行结构优化),通过软件识别活性中心并进行定义;进行CDOCKER对接研究。
1.3 统计学分析
所有实验平行实验3次。数据处理分析和作图使用Graphpad Grism 5.0、Image J软件,测定结果以平均值 ± SD表示,显著性使用ANOVA及t-test分析。#表示与空白组比较,< 0.001;与对照组比较,*表示< 0.05,**表示< 0.01,***表示< 0.001。
2 结果与分析
2.1 ACE抑制活性及IC50值
图1中由HHL实验可以得知,LSGYGP的ACE抑制率随其浓度的增加呈剂量依赖性趋势,且IC50值经过计算为2.57 μmol/L。
2.2 ACE抑制模式
由图2可以看出,三条直线的交点既不在轴也不在轴上,随着LSGYGP的浓度增加,m(轴截距的倒数)增加而最大反应速率降低。这表示LSGYGP属于混合非竞争性抑制模式,且与Heo等[16]研究一致。
2.3 不同时间下LSGYGP胃肠道消化结果
图3表明在4 h的胃肠道消化过程中,随着时间增加经过胃酶和胰酶处理,样品肽的水解度整体增高但不高于25%。这说明LSGYGP在4 h的胃肠道消化中较为稳定,具有良好的消化稳定性。
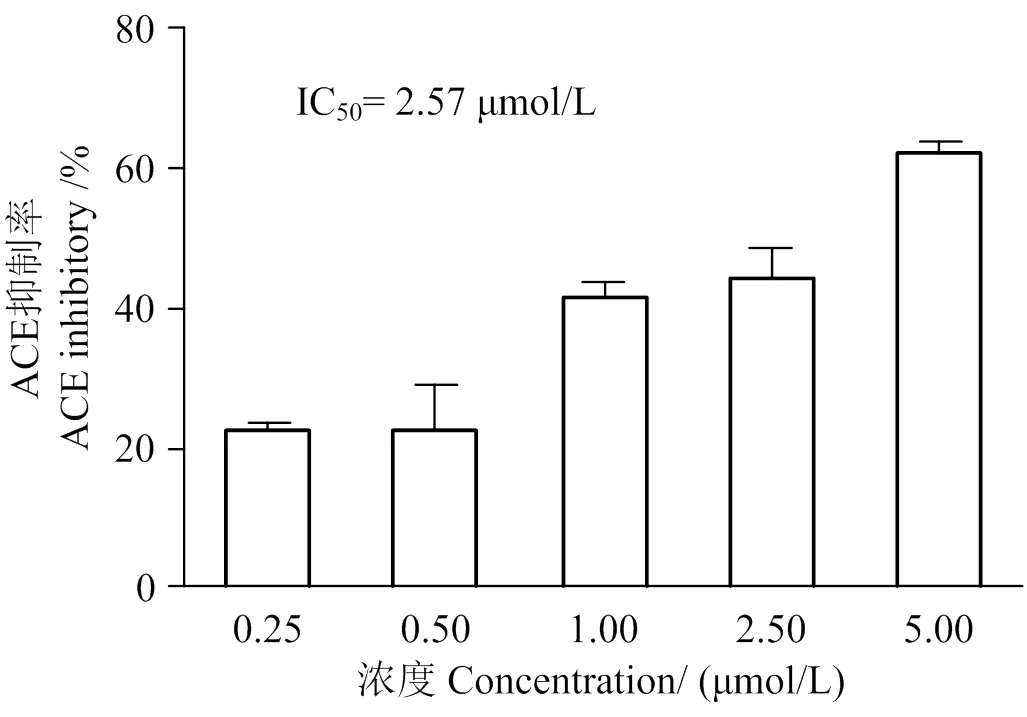
图1 LSGYGP的ACE抑制率及IC50值
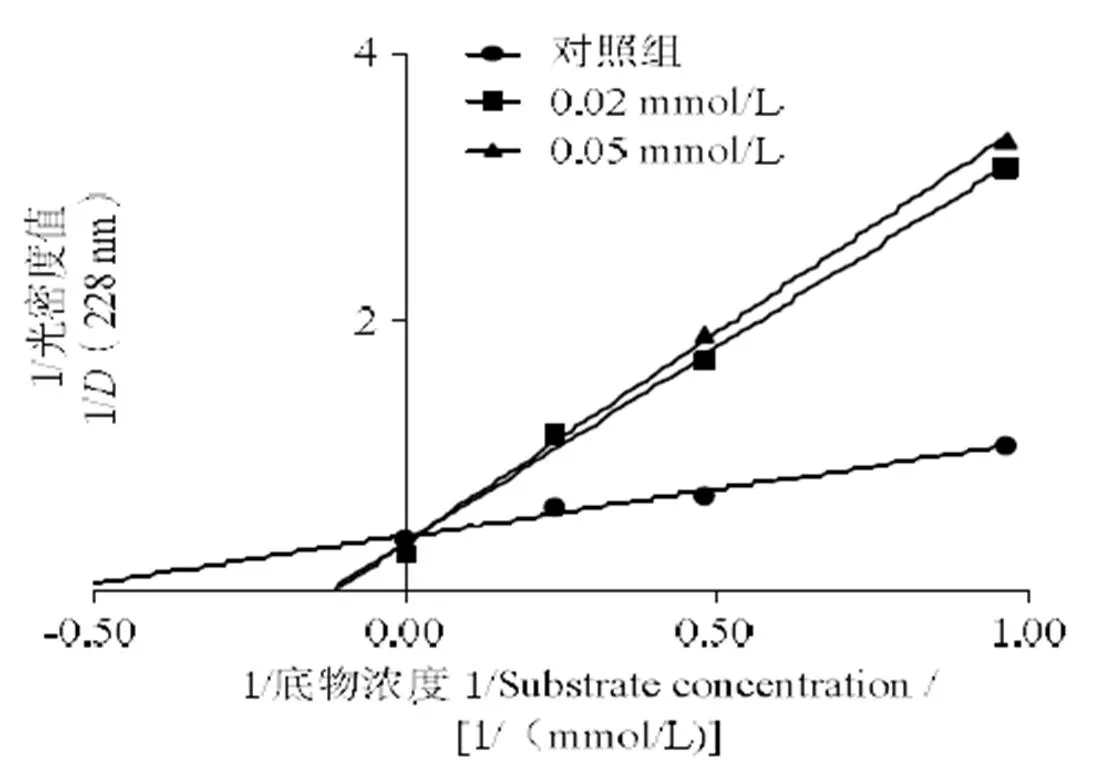
图2 双倒数曲线图分析LSGYGP的ACE抑制模式
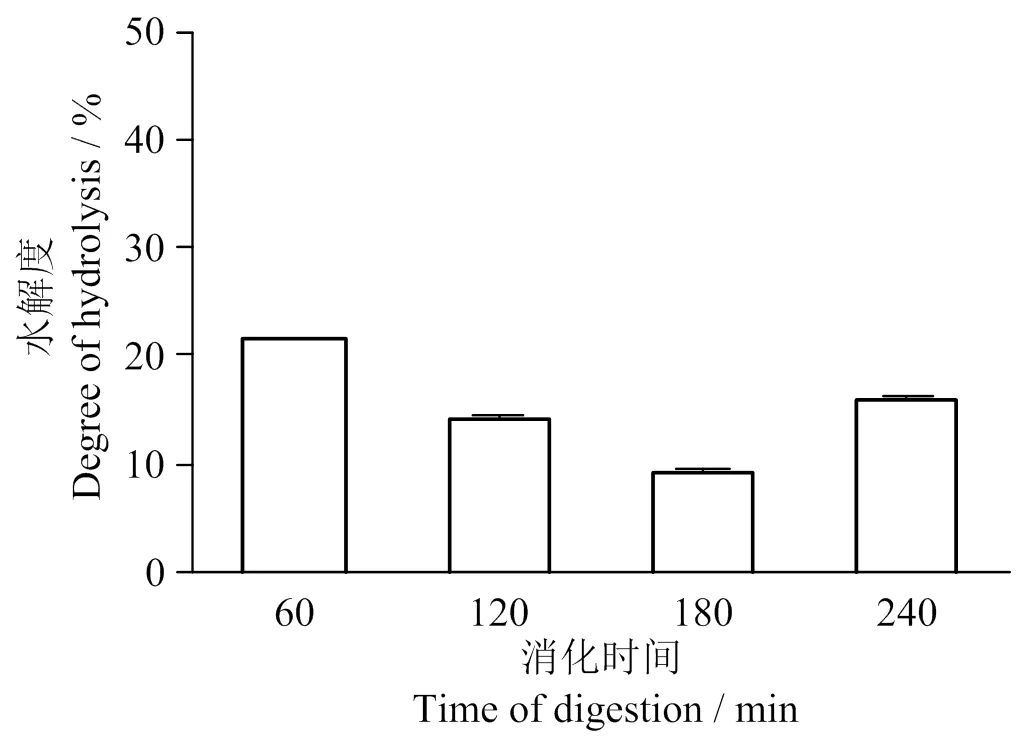
图3 不同时间处理对LSGYGP消化的影响
2.4 细胞毒性实验
如图4所示,不同浓度处理组的LSGYGP对HUVEC细胞活力无明显影响(> 0.05),说明罗非鱼鱼皮多肽LSGYGP在10~100 μmol/L范围内对HUVEC细胞无毒性作用,可选择该范围的浓度用于后续实验。
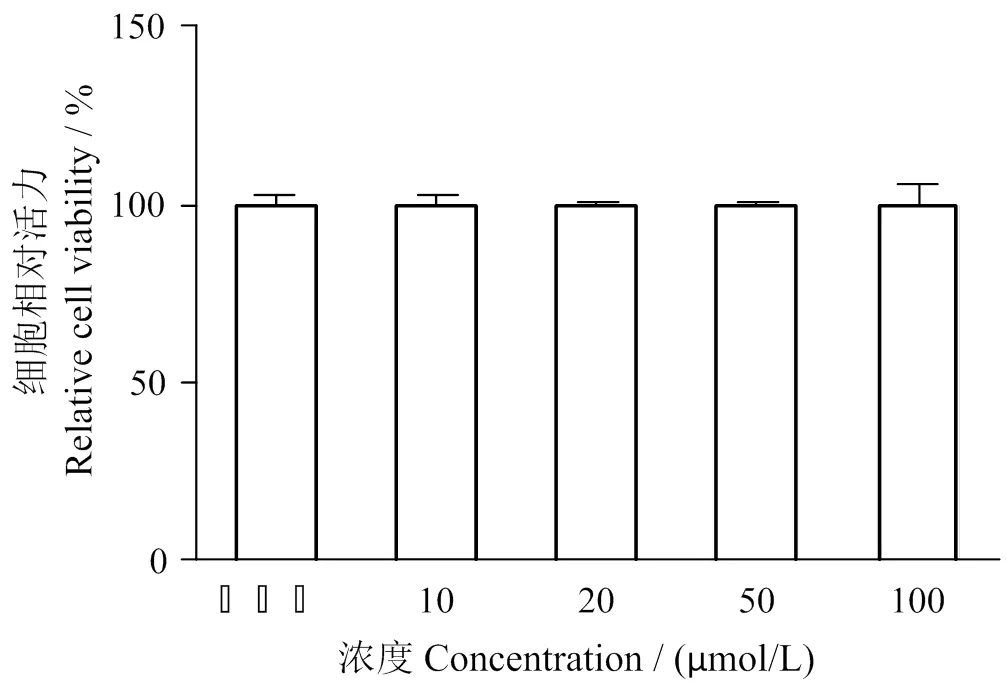
图4 不同浓度LSGYGP对HUVEC细胞相对活力的影响
2.5 LSGYGP对Ang II诱导的HUVEC细胞的保护作用
图5所示,与空白组相比,Ang II的刺激明显降低细胞活力(< 0.001),20 μmol/L LSGYGP的加入可明显提升细胞活力(< 0.05),50 μmol/L以上的LSGYGP可使细胞相对活力显著提高(< 0.01)且呈浓度依赖性。实验结果表明,在10~100 μmol/L浓度范围内,罗非鱼鱼皮多肽对Ang II诱导的HUVEC细胞表现了明显保护作用。
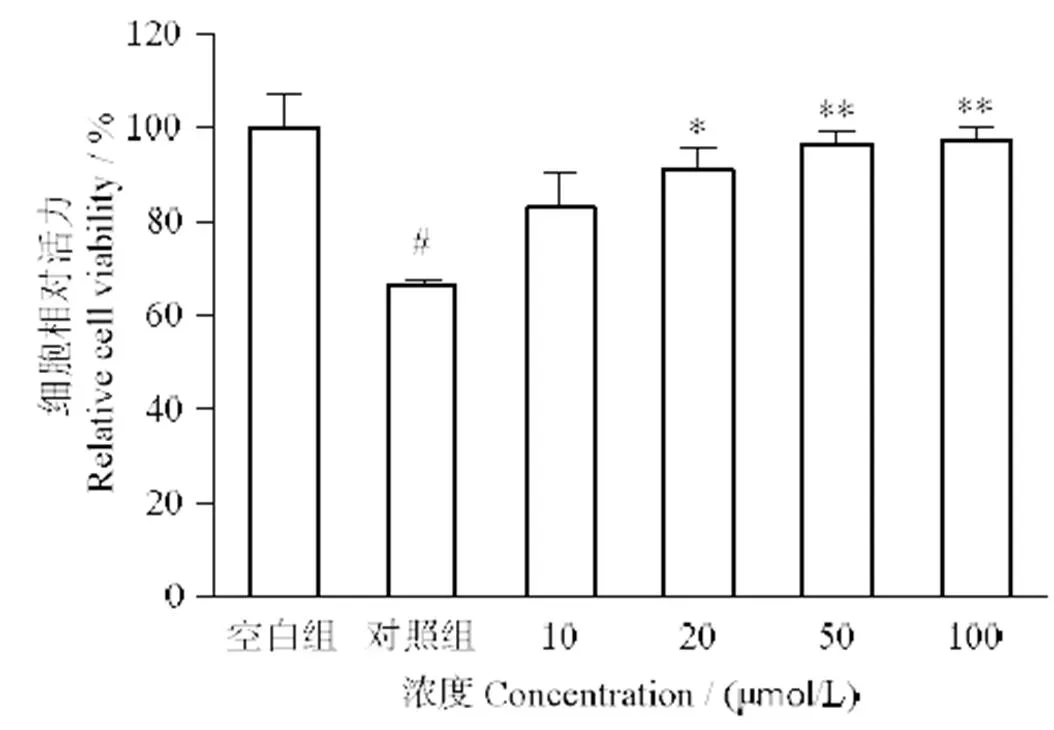
#表示与空白组比较,P < 0.001;与对照组比较,*表示P < 0.05,**表示P < 0.01
2.6 LSGYGP对Ang II诱导后HUVEC细胞血管收缩因子的表达情况
由图6、7可知,分析各组条带灰度,与空白组相比,Ang II的刺激明显增加了iNOS、COX-2和ET-1的表达,随着10、50、100 μmol/L LSGYGP浓度处理,其表达显著性下调(< 0.001)。
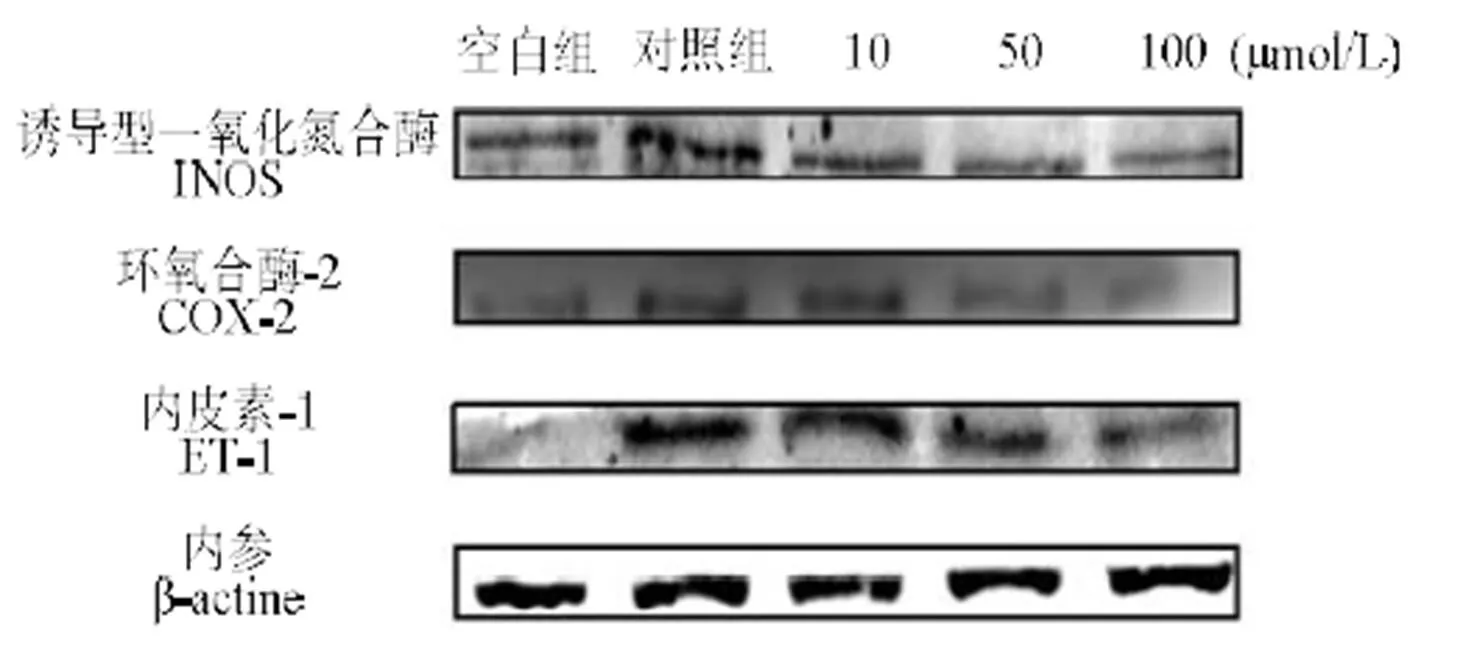
图6 Ang II诱导后HUVEC细胞iNOS、COX-2、ET-1的表达
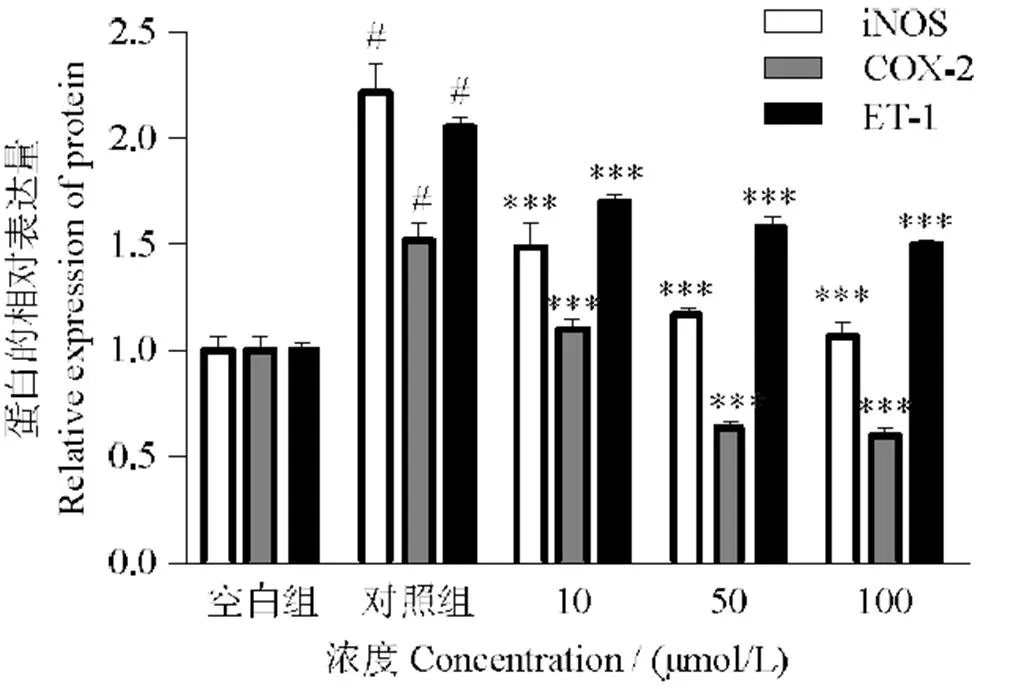
#表示与空白组比较,P < 0.001;与对照组比较,***表示P < 0.001
2.7 LSGYGP卡托普利的分子对接对比
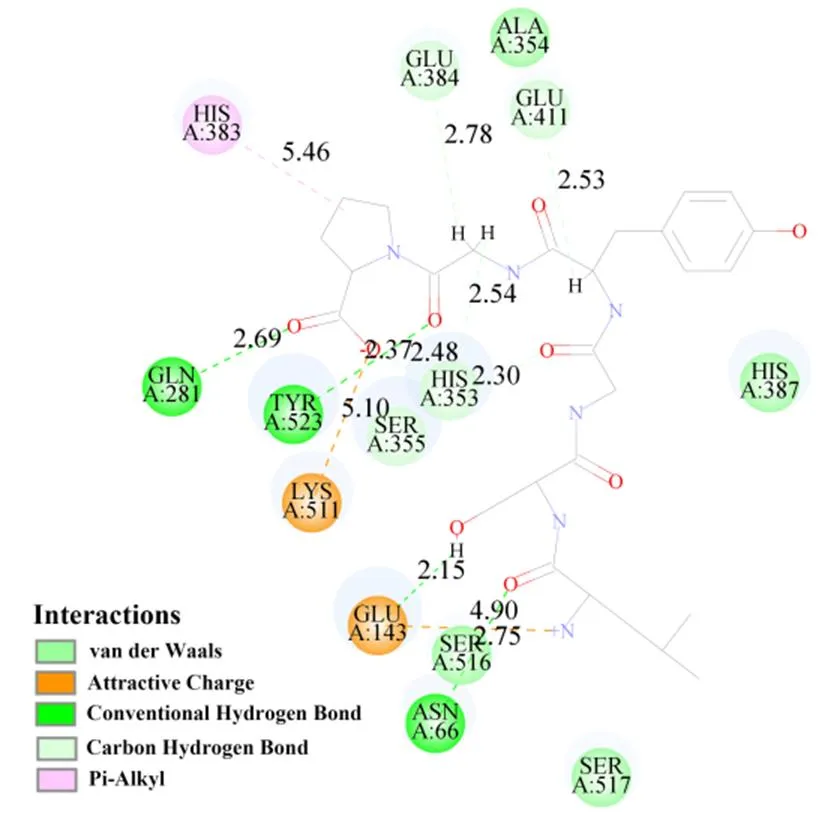
图8(上)所示关于ACE-LSGYGP对接的CDOCKER结果结合能为-90.50 kcal/mol。如图9(上)所示,LSGYGP与Asn66、Glu143、Tyr523和Gln281产生4个氢键,键长为2.75×10-10m、2.15×10-10m、2.37×10-10m和2.69×10-10m。图8(上)中卡托普利与ACE显示出结合能值为-31.09 kcal/mol,如图9(下)所示,卡托普利与Arg522、Arg522和His387产生3个氢键,键长为6.23×10-10m、6.24×10-10m和6.04×10-10m。
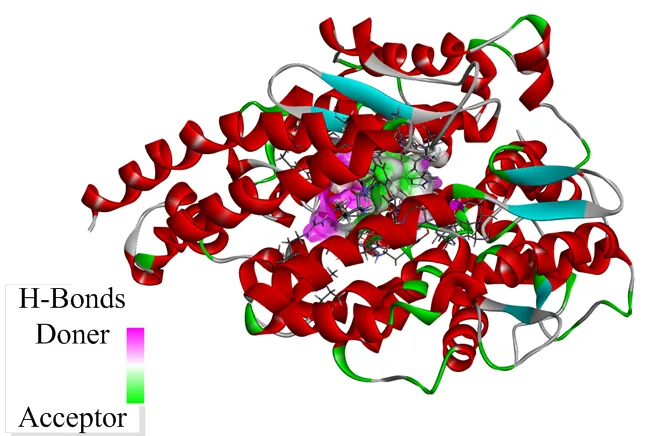
上:LSGYGP,下:卡托普利
Top: LSGYGP; Bottom: Captopril
图8 LSGYGP和卡托普利与ACE对接
Fig. 8 The interaction poses after automated docking with ACE active site
上:LSGYGP,下:卡托普利
Top: LSGYGP; Bottom: Captopril.
图9 配体与ACE作用的2维图
Fig. 9 Bi-dimensional(2D)diagrams between ligand and ACE amino acid residues
3 讨论
血管紧张素I转换酶(ACE)作为心血管系统中的一种重要转换酶,可通过去除血管紧张素I羧基末端二肽His-Leu分解为血管紧张素II(Ang II),以控制强血管收缩因子Ang II的生成[17]。而Ang II作为肾素-血管紧张素系统(RAS)中的关键活性肽,可导致血管外周阻力增加,同时使具有血管舒张作用的缓激肽失活,使血管压力升高,导致内皮损伤[18]。本研究发现罗非鱼鱼皮肽LSGYGP(IC50= 2.57 μmol/L)显示出较好的ACE抑制作用,且Lineweaver-Burk图中发现其属于混合非竞争性抑制。Mantaka等[19]在罗非鱼鱼皮水解物中发现IC50为760 μmol/L的ACE肽,Tidarat等[20]在罗非鱼鱼皮水解物中发现IC50为0.12 μmol/L的ACE肽(MILLLFR),Zhang等[21]在罗非鱼鱼皮明胶中发现IC50分别为4.61 μg/mL、6.45 μg/mL的ACE肽Glu-Gly-Leu(317.33 u)、Tyr-Gly-Asp-Glu-Tyr(645.21 u)。有文献总结海洋鱼类中的ACE 抑制肽N 端大多含有疏水性氨基酸(如缬氨酸、亮氨酸、异亮氨酸)或碱性氨基酸(如精氨酸、赖氨酸、组氨酸)[22],研究对比发现低分子量且含有疏水性氨基酸的肽显现了较好ACE活性,而竞争性抑制剂卡托普利的IC50为9.48 nmol/L[23],这可能与化学结构和测量方法的不同有关,更有必要探讨ACE抑制肽构效关系。
Ang II可以通过血管内皮细胞iNOS的表达来诱导NO产生,并且诱导产生另一种与Ang II类似的血管收缩因子ET-1,导致内皮功能障碍[24]。而这些因子又可以促进对血管内皮细胞的氧化应激,进而导致血管内皮炎症损伤、高血压和动脉粥样硬化[25]。本研究结果中iNOS、COX-2、ET-1经过LSGYGP处理后降低了由Ang II诱导的高表达,证实了这一点。体内药代动力学参数中卡托普利的半衰期为2~3 h[26],胃肠道消化实验发现LSGYGP在4 h模拟胃肠道消化中较为稳定,这进一步表明LSGYGP与卡托普利一样可经历至少2 h以上的人体消化。
研究发现具有疏水性氨基酸的ACEIP比亲水性更具有活性优势[27]。LSGYGP通过多个氢键与ACE较为稳定地对接,其疏水性氨基酸(Leu和Pro)可能是表现ACE抑制活性的原因,这与Kobayashi之前的研究理论一致[28]。S1、S2和S1′是ACE中的主要活性位点[29],它们具有不同的残基:S1口袋(Ala354、Glu384和Tyr523残基),S2口袋(Gln281、His353、Lys511、His513和Tyr520残基),S1′(Glu162)[30]。ACE活性位点的四个残基(S1口袋的Asn66、Glu143、Tyr523和S2口袋中的Glu281)[31]极大地促进了ACE与LSGYGP的相互作用。而卡托普利的硫醇基团在酶的活性位点与催化Zn2+离子形成Pi-硫相互作用,从而呈现出ACE抑制作用。LSGYGP表现出有效的ACE抑制作用,其疏水性氨基酸(Leu和Pro)与ACE产生的氢键与卡托普利通过Zn2+形成Pi-硫相互作用来抑制ACE略有不同,可能是两者活性和抑制模式差异的原因,同时这也是未来研发该ACE抑制肽同时避免传统降压药干咳等副作用的关键点。
4 结论
本研究证明鱼皮明胶多肽LSGYGP以混合非竞争性抑制展示较好的ACE抑制作用,体外实验中LSGYGP可降低血管收缩因子和相关炎症因子的表达,分子对接表明氢键是LSGYGP与ACE结合的结构中的支撑力,而卡托普利通常与催化的Zn2+离子形成紧密结合的相互作用。在罗非鱼高值化利用背景下,这些结果有助于结合或设计新靶向的ACE抑制剂,可被用于新一代的抗高血压药物。
[1] 国家卫生计生委合理用药专家委员会. 高血压合理用药指南(第2版)[J]. 中国医学前沿杂志: 电子版, 2017, 9(7): 28-126.
[2] MONTEZANO A C, AURELIE N D C, RIOS F J, et al. Angiotensin II and Vascular Injury[J]. Current Hypertension Reports, 2014, 16(6): 431.
[3] SITI H N, KAMISAH Y, KAMSIAH J. The role of oxidative stress, antioxidants and vascular inflammation in cardiovascular disease (a review)[J]. Vascular Pharmacology, 2015, 71: 40-56.
[4] FRAGASSO G, MARANTA F, MONTANARO C, et al. Pathophysiologic therapeutic targets in hypertension: a cardiological point of view[J]. Expert Opinion on Therapeutic Targets, 2012, 16(2): 179-193.
[5] FITZGERALD R J, MURRAY B A, WALSH D J. Hypotensive peptides from milk proteins[J]. Journal of Nutrition, 2004, 34(4): 980S.
[6] HUANG B B, LIN H C, CHANG Y W. Analysis of proteins and potential bioactive peptides from tilapia (spp.) processing co-products using proteomic techniques coupled with BIOPEP database[J]. Journal of Functional Foods, 2015, 19: 629-640.
[7] ZHUANG Y L, HOU H, ZHAO X, et al. Effects of collagen and collagen hydrolysate from jellyfish () on mice skin photoaging induced by UV irradiation[J]. Journal of Food Science, 2010, 74(6): H183-H188.
[8] CHAROENPHUM N, YOURAVONG W, CHEIRSILP B. Determination of reaction kinetics of hydrolysis of tilapia ()protein for manipulating production of bioactive peptides with antioxidant activity, angiotensin-I-converting enzyme inhibitory activity and Ca-binding properties[J]. International Journal of Food Science & Technology, 2013, 48(2): 419-428.
[9] LEE J K, JEON J K, BYUN H G. Antihypertensive effect of novel angiotensin I converting enzyme inhibitory peptide from chum salmon () skin in spontaneously hypertensive rats[J]. Journal of Functional Foods, 2014, 7: 381-389.
[10] SUN L, ZHANG Y, ZHUANG Y L. Antiphotoaging effect and purification of an antioxidant peptide from tilapia () gelatin peptides[J]. Journal of Functional Foods, 2013, 5(1): 154-162.
[11] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting engyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[12] BUSH K, HENRY P R, SLUSARCHYK D S. Muraceins-muramyl peptides produced by Nocardia orientalis as angiotensin-converting enzyme inhibitors. I. Taxonomy, fermentation and biological properties[J]. Journal of Antibiotics, 1984, 37(4): 330-335.
[13] 李丽, 施展, 钱春香. 酶动力学模块软件求解米氏常数和最大反应速率的实验研究[J]. 洛阳理工学院学报(自然科学版), 2009, 19(4): 1-3.
[14] SAMARANAYAKA A G P, KITTS D D, LI-CHAN E C Y. Antioxidative and angiotensin-I-converting enzyme inhibitory potential of a pacific hake () fish protein hydrolysate subjected to simulated gastrointestinal digestion and Caco-2 cell permeation[J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 1535-1542.
[15] 刘国艳, 孙贝贝, 张洁, 等. AngⅡ诱导人脐静脉内皮细胞建立高血压损伤模型[J]. 食品科学, 2017, 38(13): 174-181.
[16] HEO S Y, KO S C, KIM C, et al. A heptameric peptide purified fromsp. gastrointestinal hydrolysate inhibits angiotensin I-converting enzyme and angiotensin II-induced vascular dysfunction in human endothelial cells[J]. International Journal of Molecular Medicine, 2017, 39(3): 1072-1082.
[17] 李锐, 邹茜, 孙玉林, 等. 克氏原螯虾虾头模拟胃肠道消化产物中ACE抑制肽的分离纯化与鉴定[J]. 食品与发酵工业, 2018, 45(6): 139-146.
[18] MEHTA P K, GRIENDLING K K. Angiotensin II cell signaling: physiological and pathological effects in the cardiovascular system[J]. American Journal of Physiology-cell Physiology, 2007, 292(1): C82-C97.
[19] THUANTHONG M, DE G C, SIRINUPONG N, et al. Purification and characterization of angiotensin-converting enzyme-inhibitory peptides from Nile tilapia () skin gelatine produced by an enzymatic membrane reactor[J]. Journal of Functional Foods, 2017, 36: 243-254.
[20] TOOPCHAM T, ROYTRAKUL S, YONGSAWA- TDIGUL J. Characterization and identification of angiotensin I-converting enzyme (ACE) inhibitory peptides derived from tilapia using Virgibacillus halodenitrificans SK1-3-7 proteinases[J]. Journal of Functional Foods, 2015, 14: 435-444.
[21] ZHANG Y, DUAN X, ZHUANG Y. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia () skin gelatin[J]. Peptides, 2012, 38(1): 13-21.
[22] 操德群, 何艳丽, 余虹, 等. 海洋生物ACE抑制肽研究进展[J]. 核农学报, 2017,31(5): 927-937.
[23] CHEN J, WANG Y, YE R, et al. Comparison of analytical methods to assay inhibitors of angiotensin I-converting enzyme[J]. Food Chemistry, 2013, 141(4):3329-3334.
[24] ITO H Y, HIRATA Y, ADACHI S, et al. Endothelin1 is an autocrine/paracrine factor in the mechanism of angiotensin II-induced hypertrophy in cultured rat cardiomyocytes[J]. Journal of Clinical Investigation, 1993, 92(1): 398-403.
[25] GRAGASIN, F. S. Estrogen reduces angiotensin ii-induced nitric oxide synthase and NAD(P)H oxidase expression in endothelial cells[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2003, 23(1): 38-44.
[26] POPOVICI RF, ALEXA IF, NOVAC O, et al. Pharmacokinetics study on mesoporous silica-captopril[J]. Digest Journal of Nanomaterials and Biostructures, 2011, 6(4): 1619-1630.
[27] MOSKOWITZ DW. Is ‘somatic’ angiotensin i-converting enzyme a mechanosensor?[J]. Diabetes Technology & Therapeutics, 2002, 4: 841-858.
[28] KOBAYASHI Y, YAMAUCHI T, KATSUDA T, et al. Angiotensin-I converting enzyme (ACE) inhibitory mechanism of tripeptides containing aromatic residues[J]. Journal of Bioscience and Bioengineering, 2008, 106(3): 310-312.
[29] WANG X, CHEN H, FU X, et al. A novel antioxidant and ACE inhibitory peptide from rice bran protein: Biochemical characterization and molecular docking study[J]. LWT-Food Science and Technology, 2017, 75: 93-99.
[30] ROHIT A C R, SATHISHA K S, APARNA H S. A variant peptide of buffalo colostrum b-lactoglobulin inhibits angiotensin I-converting enzyme activity[J]. European Journal of Medicinal Chemistry, 2012, 53: 211-219.
[31] WU Q, JIA J, YAN H, et al. A novel angiotensin-І converting enzyme (ACE) inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa (Bombyx mori) protein: Biochemical characterization and molecular docking study[J]. Peptides, 2015, 68: 17-24.
Study on in Vitro ACE Inhibitory Activity, Digestibility and Molecular Docking Comparison of Tilapia Fish Skin Peptide
CHEN Jia-li1, YANG Sheng-tao1, XIAO Zhen-bang2, QIAN Zhong-ji2,3
(1.,,524088; 2.,,524088; 3.,518108)
【】The ACE inhibitory activity of tilapia skin peptide LSGYGP, gastrointestinal digestive stability and molecular docking comparison with antihypertensive drug captopril were analyzed. 【】The IC50value and inhibition mode of peptide were determined by HHL stability, Stability of peptide in the simulated gastrointestinal digestion was measured. Cell viability was detected by MTT method, protein expression of inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2) and endothelin-1 (ET-1) were detected by western blot. Comparison of peptide and captopril with ACE in molecular docking was analyzed. 【】The IC50of LSGYGP was 2.57 μmol/L, which showed mixed non-competitive inhibition; Simulated gastrointestinal digestion was stable within 4 h; MTT assay indicated that the peptide LSGYGP had no toxic effect on HUVEC cells (> 0.05), and viability of HUVEC in Ang II-induced group was significantly increased (< 0.01). Compared with the control group, LSGYGP treatment could decreased the expression of iNOS, COX-2 and ET-1 in a dose-dependent manner (< 0.001). Docking results indicated that hydrogen bond is the supporting force in the binding structure of LSGYGP and ACE, while captopril usually forms a tight binding interaction with the Zn2+ion of ACE. 【】The digestive-stabilized tilapia fish skin peptide LSGYGP significantly inhibited the expression of vasoconstrictor and inflammatory factors, and exhibited a good ACE inhibitory activity. The difference in activity between LSGYGP and captopril might be due to the different forces of ACE molecular docking, which might provide the pharmacological basis to develop ACE inhibitors with fewer side effects.
Tilapia fish skin peptide; HUVEC; Gastrointestinal digestion; Captopril; Molecular docking
Q291; R544.1
A
1673-9159(2019)05-0107-08
10.3969/j.issn.1673-9159.2019.05.015
2019-06-03
广东省“扬帆起航”紧缺人才引进项目(201433009);广东海洋大学“创新强校”科研启动基金项目(2013050204)
陈佳丽(1995-),女,硕士研究生,研究方向为水产品高值化加工与利用,E-mail:jiali1745@163.com
千忠吉(1978-),男,博士,副教授,研究方向为南海生物活性物质的研究与利用,E-mail:zjqian78@163.com
陈佳丽,杨胜涛,萧振邦,等. 罗非鱼鱼皮肽的体外ACE抑制活性、消化性及分子对接对比[J]. 广东海洋大学学报,2019,39(5):107-114.
(责任编辑:刘朏)

