退化高寒草甸优势植物根际与非根际土壤养分及微生物量的分布特征
马 源, 李林芝, 张德罡, 杨 洁, 姚玉娇, 陈建纲
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
祁连山区位于青藏高原、蒙古高原和黄土高原交界处,面积近265万km2,是我国生态功能区的重要组成部分[1]。近几十年来,由于人为干扰等外部压力的影响,如过度放牧、资源的过度开垦等,使草地退化面积不断扩大,导致土壤养分发生转化、草地优势物种退化,以及植物群落的多样性受到影响[2-3]。高寒草甸区的退化现象已引起了全世界生态学家们的广泛关注[4],诸多学者从不同角度分析了高寒草甸的退化机制,如:气候因素的改变对草地退化的影响,植物群落生产力和物种多样性的非线性响应机制,退化草地对草地群落特征的影响,以及土壤种子库与土壤退化的相关性等[5-8]。但从根际角度出发探讨草地退化的研究相对较少,尤其是草地退化过程中土壤的有效养分和微生物量在植物根际存在富集和活化现象。根际作为土壤-植物-微生物三者相互作用的微环境,参与各种物质循环和能量流动,是草地生态系统中物质交换的活跃区域[9]。特别是作为介导土壤中各种化学调控的根际微生物,是土壤中碳,氮,磷等养分的循环和转化的驱动者,对于草地生态系统中养分的循环具有重要作用[10]。有研究指出,高寒草甸的退化是土壤中碳元素的释放和氮元素的流失所产生的[11],因此本研究对于丰富草地退化过程中C,N循环理论具有重要意义。
草原植物根际的研究比农作物根际的研究更加复杂,这是因为草原地区植物种类多,群落结构复杂,其根系组成也相对应的复杂多变,研究者们难以从单一植物的角度开展研究[10]。因此,从整体角度探讨不同退化程度高寒草甸优势物种的根际过程具有重要的研究意义。退化程度不同的高寒草甸其优势物种的根系所分泌的物质、微生物的活性以及养分状况均有较大差异,有研究指出,高寒草甸退化过程中优势物种根际土壤的表征可能与适应高寒脆弱生境、对养分的有效吸收效率和对土壤养分的转化等存在直接的相关性[12],但这一问题尚未得到充分认识。因此研究高寒草甸退化区不同优势植物根际与非根际养分的富集效应,微生物的分布特性和养分状况,能够进一步明确高寒草甸退化过程中植物根际微环境(植物-土壤-微生物)的互作机理,以及高寒地区植物根际过程对土壤养分的转化和吸收作用,为将来在合理利用和保护草地资源等方面做出一定的贡献。因此,本研究选择高寒草甸区4个不同退化梯度的样地,调查样地植被种类和数量,采集不同退化样地中优势植物的根际土壤和非根际土壤,分析其中的养分等理化性状和微生物量等指标,探讨其与高寒草甸退化程度之间的相关性,以期揭示高寒草甸退化区植物-根际养分-微生物系统对脆弱环境的适应机理。
1 材料与方法
1.1 样地概况
研究地位于甘肃省祁连山东缘天祝藏族自治县抓喜秀龙乡境内(102°44′11″~102°46′17″ E,37°11′42″~37°13′5″ N),草地类型为高寒草甸草原,土壤类型为亚高山草甸土,pH 6.94~8.17,海拔2 869.8~3 008.3 m,年均气温-0.1 ℃,全年≥0℃的积温为1360 ℃左右,年均降水量446 mm,主要集中在7-9月,年均蒸发量在1 483~1 614 mm之间,气候寒冷潮湿,年日照时长2 600 h。优势植物包括:珠芽蓼(Polygonumviviparum)、早熟禾(Poaannua)、垂穗披碱草(Elymusnutans)、线叶嵩草(Kobresiacapillifolia)、矮生嵩草(Kobresiahumilus)、甘肃棘豆(Oxytropiskansuensis)、唐松草(Thalictrumspp)、萎陵菜(Potentillaspp.)、凤毛菊(Saussurreaspp.)、扁蓿豆(Melissilusruthenicus)、乳白香青(Anaphalislactea)、狼毒(Stellerachamaejasme)等。
1.2 样地设置与土壤样品采集
根据草地退化相关分级标准[13],在研究区选取4个样地(均为200 m×200 m),分别为未退化草地(Non-degraded grassland,ND),轻度退化草地(Light degraded grassland,LD),中度退化草地(Moderate degraded grassland,MD)以及重度退化草地(Severely degraded grassland,SD)(表1)。每个样地内按棋盘格式设5个样方(共计5个重复),样方规格为1 m×1 m,用方格法测定每个小样方中植物高度,植被盖度,植物种类以及植物数量,同时在小样方内选取1个50 cm ×50 cm的样方用于采集地上生物量,去除草地表面凋落物层后每个小样方分别挖取1个0.15 m × 0.15 m × 0.2 m(土壤深度)的土块做好标记,用保鲜膜封装后放入干冰箱中带回实验室进行下一步土壤样品的处理。4个退化梯度共计20个采样位点。
将带回实验室的土块分为根际土壤(Rhizosphere soil,RS)(0~2 mm)和非根际土壤(Bulk Soil,BS)(0~10 cm)。优势植物根际土壤样品的采集参考Chaudhary的抖落法[14],将所挖取的完整土体进行分离(根系分布范围内),先轻柔抖落大块不含根系的土壤,并用通过手工取下附着在根系周围的土壤,抖落之后仍粘在植物根系上的土壤(0~2 mm)为根际土壤,用细毛刷收集装入无菌自封袋中。将每个退化样地中RS和BS的5个土壤样本均匀混合为1个复合土壤样本,每个退化样地8份土壤样本,共计32份土壤样本。每份土壤样品分为两部分,一部分为新鲜土壤(在4 ℃条件下储存),用于土壤铵态氮(Ammonium nitrogen,AMN)、硝态氮(Nitrate nitrogen,NIN),以及土壤微生物生物量碳(Microbial biomass C,MBC)、微生物生物量氮(Microbial biomass N,MBN)、微生物生物量磷(Microbial biomass P,MBP)和土壤荧光素二醋酸盐(Fluorescein diacetate hydrolysis,FDA)的测定;另一部分阴干后在实验室测定土壤有机碳(Soil organ carbon,SOC)、土壤全氮(Total nitrogen,TN)、土壤全磷(Total phosphorus,TP)等土壤理化性质。

表1 样地概况Table 1 Basic condition of plots
1.3 土壤理化性质测定
土壤有机碳,土壤全氮,土壤全磷的测定依照《土壤分析技术规范》的方法[15];土壤速效磷参考张德罡[16]高锰酸钾氧化-葡萄糖还原法的测定方法;铵态氮,硝态氮参照鲍士旦[17]《土壤农化分析(第三版)》的方法;土壤pH用去CO2蒸馏水(1:2.5土水比浸提液) 浸提后用pH计测定[15]。
1.4 土壤微生物量碳、氮、磷及微生物活性测定
土壤微生物量碳,氮,磷的含量采用氯仿熏蒸法[18]。将每个新鲜样品过筛(2 mm)后,称取2.5 g分别装入50 mL烧杯并放入干燥器后,将干燥器密封保存于室温下熏蒸24 h。熏蒸后用于微生物生物量碳、氮和磷的测定。MBC采用高锰酸钾硫酸外加热法;MBN采用凯氏定氮法;土壤微MBP采用碳酸钠浸提-钼锑抗比色法,其含量计算用熏蒸土壤减去未熏蒸土壤之间差除以校正系数KC=0.38,KN=0.54,KP=0.4,公式为:
土壤微生物量碳(mg·kg-1)=(EC- EC0)/0.38
土壤微生物量氮(mg·kg-1)=(EN- EN0)/0.54
土壤微生物量磷(mg·kg-1)=(EP- EP0)/0.4
式中:EC、EN和EP分别为熏蒸土样浸提液中碳、氮和磷的量:EC0、EN0和EP0分别为未熏蒸土样浸提液中碳、氮和磷的量;校正系数分别是KC=0.38,KN=0.54,KP=0.4。
为描述根际和非根际土壤中微生物活性,参考Adam[19]的方法测定土壤中荧光素二醋酸盐的含量。
1.5 数据统计分析
采用Excel 2016和SPSS 19.0软件对数据进行统计分析。采用单因素(one-way ANOVA)和Duncan法进行方差分析和多重比较(α=0.05);R(3.5.1)语言中corrplot包做相关分析讨论微生物量与土壤因子之间的相关性。根际富集率(Enrichment rate,E)反映土壤中养分含量富集程度,E值表示土壤性状值在植物根际的富集程度,与植物根际效应的强弱有关[20],公式如下
2 结果与分析
2.1 草地退化对根际与非根际土壤养分的影响
不同退化程度根际土壤与非根际土壤养分含量随退化程度加剧呈现不同的变化趋势(表2)。其中根际和非根际土壤SOC,TN,TP的含量随退化程度的加剧呈逐渐降低的趋势,AP,AMN含量呈先降低后升高的趋势,NIN含量则呈先上升后下降的趋势。根际土壤中SOC,TN,TP,AP,AMN和NIN的含量变化范围分别为61.5~95.7 g·kg-1,2.57~4.84 g·kg-1,0.38~1.14 g·kg-1,14.23~28.67 mg·kg-1,6.20~7.02 mg·kg-1,42.49~80.70 mg·kg-1,非根际土壤中SOC,TN,TP,AP,AMN,NIN的含量分别为51.1~89.1 g·kg-1,1.17~4.20 g·kg-1,0.25~0.82 g·kg-1,9.81~22.83 mg·kg-1,6.02~6.86 mg·kg-1,39.23~66.86 mg·kg-1。并且同一退化程度下,根际土壤含量均高于非根际土壤(P<0.05)。
根际土壤和非根际土壤pH值随退化程度的加剧呈逐渐降低的趋势,根际土壤中pH值的变化范围从8.00降低至7.53,非根际土壤中pH值从7.62降低至7.31。土壤pH值在不同退化程度上差异显著,并且在同一退化程度下pH值为根际土壤低于非根际土壤,且差异性显著(P<0.05)。

表2 不同退化程度根际与非根际土壤养分含量Table 2 Contents of soil nutrient in rhizosphere and non-rhizosphere soil of different degrees of degradation
注:不同小写字母表示不同退化程度间差异性显著(P<0.05);ND:未退化;LD:轻度退化;MD:中度退化;SD:重度退化。下同
Note:Different lowercase letters within the same column indicate significant difference at the 0.05 level;ND:Non-degradation;LD,Light degradation;MD:Moderate degradation;SD:Severely degradation. The same as below
2.2 草地退化对根际与非根际土壤微生物量和微生物活性的影响
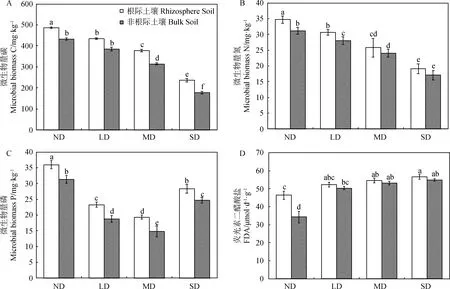
随草地退化程度加剧,根际与非根际土壤中MBC和MBN含量逐渐降低,为ND>LD>MD>SD(图1A,B),ND区域根际与非根际土壤NBC含量分别达486.32 mg·kg-1和432.41 mg·kg-1,是SD区域的2.05和2.44倍;MBN分别达34.72 mg·kg-1和31.06 mg·kg-1,是SD区域的1.82和1.79倍;同一退化程度下,根际土壤MBC含量均高于非根际土壤(P<0.05);除SD区域外,根际土壤MBN含量均高于非根际土壤(P<0.05)。
根际与非根际土壤MBP含量先下降后上升(图1C),为ND>SD> LD>MD,ND区域根际土壤与非根际土壤MBP含量分别达30.95 mg·kg-1和27.21 mg·kg-1,是SD区域的1.60和1.84倍;同一退化程度下,根际土壤MBP含量均高于非根际土壤(P<0.05)。
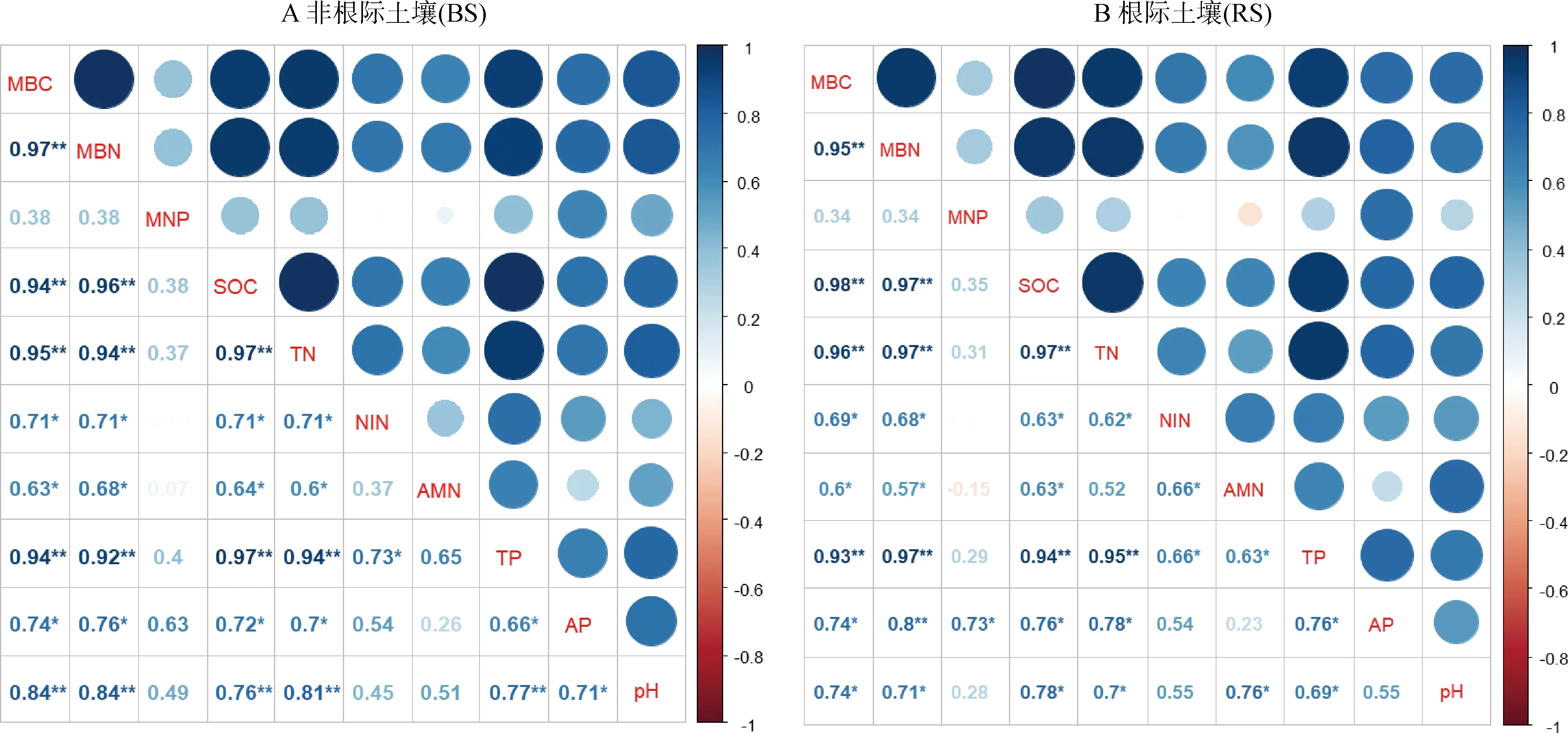
根际土壤与非根际土壤FDA活性逐渐升高(图1D),为ND< LD 随着退化程度不断加剧,相对于非根际土壤,根际土壤MBC、MBN、MBP、SOC和TN的养分富集率不断提高(表3),并且在SD区达到最高,分别为34%,17%,31%,20%和45%;TP和AP的根际养分富集率在LD草地最低分别为19%和11%,MD草地最高分别为55%和45%;AMN和TN的根际养分富集率变化趋势一致,前者在SD区达到最高为12%;NIN的根际养分富集率有较大幅度变化,在LD草地无根际富集效应,而在SD草地富集效率达到最高为37%,AMN和NIN在根际的富集效率低于TN;相对于根际土壤,非根际土壤pH值较高,这是因为植物对阴阳离子吸收的不平衡导致植物根际的pH值发生变化,这将会直接影响根际养分的有效性,因此pH值的降低,能够促进养分有效性的转化和活化。 图1 高寒草甸根际与非根际土壤微生物生物量和微生物活性Fig.1 Microbial biomass and microbial activity in rhizosphere and non-rhizosphere soils of alpine meadow 表3 不同退化程度根际土壤养分富集率Table 3 Contents of nutrients enrichment rate in rhizosphere soil of different degrees of degradation 项目Item退化程度Degradation grade未退化ND轻度退化LD中度退化MD重度退化SD根际/非根际R/S富集率enrichment rate/%根际/非根际R/S富集率enrichment rate/%根际/非根际R/S富集率enrichment rate/%根际/非根际R/S富集率enrichment rate/%微生物生物量碳MBC/mg·kg-11.11 ↑11%1.13↑13%1.20↑20%1.34↑34%微生物生物量氮MBN/mg·kg-11.07 ↑7%1.11↑11%1.12↑12%1.17↑17%微生物生物量磷MBP/mg·kg-11.14 ↑14%1.24↑24%1.29↑29%1.31 ↑31%有机碳SOC/g·kg-11.08↑8%1.11 ↑11%1.13 ↑13%1.20 ↑20%全氮TN/g·kg-11.15↑15%1.18↑18%1.23 ↑23%1.45 ↑45%全磷TP/g·kg-11.40↑40%1.19↑19%1.36 ↑36%1.55↑55%速效磷AP/mg·kg-11.26 ↑26%1.11 ↑11%1.29↑29%1.34↑34%铵态氮AMN/mg·kg-11.02↑2%1.04↑4%1.07↑7%1.12↑12%硝态氮NIN/mg·kg-11.02↑2%0.96↓-4%1.37↑37%1.06↑6%pH值pH value0.95 ↓-5%0.99 ↓-1%0.98 ↓-2%0.97 ↓-3% 由矩阵可视化相关性分析可知(图2A),非根际土壤MBC与MBN,SOC,TN,TP和pH之间存在极显著相关性(P<0.01);MBN与SOC,TN,TP和pH之间存在极显著相关性(P<0.01);MNP与其他指标均无显著相关性(P>0.05),SOC与TN,TP和pH之间存在极显著相关性(P<0.01);TN与TP和pH相关性极显著性(P<0.01);TP与pH呈极显著正相关(P<0.01);AMN和NIN均与MBC,MBN,SOC,TN有显著性差异(P<0.05);以上结果显示非根际土壤SOC,TN和TP相互制约,相互影响。 由图2B可知,根际土壤MBC与MBN,SOC,TN和TP相关性极显著性且为正相关(P<0.01);MBN与SOC,TN,TP和AP相关性极显著性(P<0.01);MNP与AP相关性显著性(P<0.05),MNP与NIN和AMN呈负相关;SOC与TN和TP相关性极显著性(P<0.01);TN与TP相关性极显著性(P<0.01);NIN和AMN与MBC,MBN,TN和TP相关性显著(P<0.05);TP与AP和pH相关性显著(P<0.05);根际pH除了与MBP和AP相关性不显著性,与其他均具有显著相关性(P<0.05)。以上结果均表达出根际和非根际土壤中微生物量以及养分因子变化规律相关性。 图2 不同退化程度高寒草甸根际土壤与非根际土壤养分影响因子相关性的分析Fig.2 Correlation Analysis of Nutrient Influencing Factors between Rhizosphere Soil and Non-Rhizosphere Soil of DifferentDegraded Alpine Meadows注:不同指标之间的相关矩阵。n=10。注:*:P<0.05;**:P<0.01;蓝色代表正相关和红色代表负相关,通过颜色深浅来显示相关程度,其中圆形的大小表示行惯性的大小。MBC:微生物量碳;MBN:微生物量氮;MNP:微生物量磷;SOC:土壤有机碳;TN:土壤全氮;NIN:硝态氮;AMN:铵态氮;TP:总磷;pH:pH值Note:The correlation matrix between different indicators. n=10. Note:* and** indicate significant difference at the 0.05 and 0.01 level;blue for positive correlation and red for negative correlation,showing the degree of correlation by color depth,where the size of the circle represents the magnitude of the line inertia. MBC:microbial biomass carbon;MBN:microbial biomass nitrogen;MNP:microbial biomass phosphorus;SOC:soil organic carbon;TN:soil total nitrogen;NIN:nitrate nitrogen;AMN:ammonium nitrogen;TP:total phosphorus;pH:pH value 稳定的环境下植物能够通过对土壤养分的吸收和根系分泌物的释放来调节土壤中养分含量的分布,但不能在可变的环境中控制养分元素的稳定性[21],也就是说,植物通过利用自身潜在限制营养元素的这个生理策略,如植物总生物量对养分投入和分配,植物自身对营养元素的摄取等,最终可诱导植物对C、N、P等元素的相关转化[22],因此,植物群落的差异首先会改变土壤中根际养分的含量和分布;其次,根际养分与微生物的互作最终反馈到非根际土壤中,进而改变土壤养分的分布。本研究发现,不同退化程度高寒草甸其优势物种发生了一定的改变,说明草地退化导致土壤养分的分布和有效性产生显著变化,从而影响了草地地上植被的生长。这与陈宁[6]和杨元武[23]等人在研究青藏高原的高寒草甸退化区时发现优势物种的不同能够使土壤养分含量和分布发生显著变化结论一致。本研究发现,退化草地中根际土壤的pH值低于非根际土壤的pH,这些变化的发生与植物根系分泌物有关,包括低分子有机酸,植物对阴阳离子吸收的不平衡以及酸性磷酸酶的释放等[24],他们使土壤中pH值降低,改变土壤中养分的溶解度,使养分从难溶状态变为可溶状态,从而促进养分含量的吸收。通过对根际土壤和非根际土壤中土壤养分的相关分析可知,土壤pH与土壤SOC,TN,TP和AP间具有显著正相关关系,这进一步说明植物根际分泌的有机酸能够参与土壤中养分的转化作用。有研究指出,草原区植物根系比森林区植物根系能分泌更多的酸性物质[25],本研究发现,重度退化草地的土壤pH显著低于其他样地,表明植物根系分泌了更多的酸性物质,这有利于提高土壤中P元素的溶解度,进而提高植物对P的吸收效率,即根系分泌物能够改善土壤中养分的流动性和可利用性,从而增加了植物对其吸收的能力[26]。因此,当高寒草甸地区植物群落结构和优势物种发生改变时,对应的植物根际的养分组成和供给能力也将相应改变,从而使根际养分环境发生变化,这些变化将会反馈给根系来调节植物根系的分泌能力,进而使养分的生物有效性和根际微生物发生改变,最终改变植物-土壤-微生物的养分循环能力。 Haichar等[27]研究指出,植物与土壤接触的局部微环境间具有养分相互转化的作用。本研究发现,根际土壤相比于非根际土壤具有较强的微生物活性,这说明土壤中微生物生物量的变化强弱能够表明土壤微生物的活跃性的高低,这与Garcia[28]的研究结果相似。另有研究指出,土壤微生物活跃性的提高与植物分泌的物质有关,例如激素,脱落的细胞,有机酸酸和碳源物质,这些底物能够为土壤微生物提供营养物质[29],通过对根际土壤和非根际土壤中土壤微生物生物量的相关分析可知,根际和非根际土壤中MBC和MBN与土壤中SOC,TN和TP间具有显著正相关关系,这也进一步说明土壤养分能够为土壤微生物的生长提供底物。本研究发现,草地退化程度越剧烈,土壤中微生物生物量越低,这种现象的发生应该是由于微生物总数量的减少所引起的,而不是微生物活性降低而导致的,为了有效解释这一现象的发生,本研究通过测定土壤中FDA的活性发现,随草地退化程度的加剧,FDA表现出活性逐渐升高的现象,而FDA已被用作表征土壤微生物生物能量状态的重要指标参数[30]。Guo等[31]研究指出,微生物生物量应随着给定区域内的植物生产力而增加,而本研究发现,随着草地退化程度的加剧,草地植物的种类和数量不呈不断下降的趋势,这必然会导致植物群落生产力的下降,从而使草地微生物的生物量呈降低趋势。因此,在高寒草地退化区,植物物种的多少和植物群落生产力的高低,能够有助于我们观察微生物生物量的响应情况。在高寒草甸生境脆弱的环境下,植物只能通过增强对养分的竞争维持种群繁衍,在微生物生物量减少的情况下,那些能够使根际微生物活性增强的物种,可将土壤中难溶态的养分经过根际过程(植物分泌的特定物质和根际微生物的共同作用)活化并被其吸收,使其在竞争中占据优势地位。这也可能是草地退化过程中出现微生物的总数量下降、微生物的活性增强的原因之一。 植物通过根系从外界摄取营养物质的过程中,根际微环境产生剧烈变化[9],有研究发现,植物种类与植物根际吸收养分的速率有关,受根际吸收的影响,最终表现为土壤养分的富集或亏缺[10]。本研究发现,随草地退化程度的加剧,土壤中养分含量和微生物量的富集率呈逐渐增加的趋势,这在重度退化草地中表现最为明显,这一现象可能是由以下两个因素共同导致:一、植物根系不断从外界环境中摄取养分物质,从而产生富集现象;二、植物根际过程的发生使得根际微域养分的存在形态和分布特征产生了一系列复杂变化,促使微生物活性不断增强,进而提高土壤养分的转化效率,因此引起了明显的根际效应的发生[32]。对比土壤中养分元素和微生物量的根际富集率发现,随退化程度的加剧,MBC、MBP和TN、TP以及AP的富集作用明显,这表明根际对土壤养分表现出明显的富集和截留效应。有研究指出,氮富集可以刺激磷酸酶活性,从而增加土壤中的无机磷[33],氮富集可以诱导土壤酸化,增加可扩散的无机磷酸根离子的浓度,通过相关分析发现,pH值的变化与AP和TP呈正相关关系(P<0.05),这说明植物根系分泌的物质对难溶性的P产生了活化效应[34],从而在脆弱生境条件下为植物提供养分。通过相关分析可知,在根际和非根际土壤中,土壤微生物生物量与土壤全氮和速效氮之间具有显著相关性,这说明土壤中微生物量和氮素具有协同作用,能够作为高寒草甸土壤养分状态以及养分转化和周转效率的生物学指标[35];同样,Zhan等[36]研究发现,根际微生物量的活性与土壤养分循环具有直接关系,并且对环境非常敏感。这就解释了土壤的有效养分和微生物量在植物根际存在富集和活化的现象。 本研究结果表明:高寒草甸区根际与非根际的土壤养分状况及微生物量生物量存在富集和活化的现象;根际土壤为根际微生物提供丰富的能源物质,并且土壤微生物的养分库是植物养分吸收的直接来源;草地退化过程中优势物种的不同使根际过程越发活跃,对根际养分的调控和转化产生重要影响。2.3 草地退化对根际养分富集率的影响

2.4 土壤微生物量与土壤养分的关系
3 讨论
3.1 退化高寒草甸根际与非根际土壤养分特征
3.2 根际与非根际土壤微生物量的比较
3.3 根际与非根际土壤养分的富集效应
4 结论

