核壳结构TiO2/C@Fe3O4催化剂的制备及其光催化活性研究
郑 飞,代 祥,万兴智
(1.西昌学院 理学院,四川 西昌 615013;2.西昌市环境监测站,四川 西昌 615013; 3.德阳市产品质量监督检验所,四川 德阳 618000)
光催化氧化是环境污水处理非常有效的技术,特别是对污水中的持久性有机污染物(POPs)的处理具有显著的效果[1]。纳米TiO2作为一种半导体光催化剂,因其具有氧化能力强、催化活性高、物理化学性质稳定、廉价、无毒、环境友好、可重复使用等优点,被认为是污水处理领域最具前景的绿色环保型光催化剂[2]。纳米TiO2有三种晶型,锐钛矿型(A-TiO2)、金红石型和板钛矿型,其中A-TiO2的光催化活性最高[3]。但是A-TiO2的能带间隙较宽(Eg=3.2eV),只有受到能量高于或等于A-TiO2的能带间隙宽度的光照时,才能发挥其光催化效果,因而造成其只能利用太阳光中5%的紫外光[4]。为提高TiO2的光催化效率,研究者们提出众多的改进策略,如金属[5-6]或非金属的掺杂[7-8]、半导体复合[9-10]、光敏材料敏化[11-12]和TiO2表面有机修饰[13]等。这些方法通过掺杂或表面改性等将杂离子引入TiO2晶格,引起晶格畸变,在纳米TiO2晶体内部或表面形成晶格缺陷或氧空缺作为电子捕获陷阱,从而抑制电子与空穴的复合,从根本上提高TiO2对光的利用率,提高TiO2的光催化效率。但上述策略不仅制备成本高、制备条件苛刻,所得到的的改性TiO2的稳定性也会受到影响,且制备过程中会使用到很多有毒药品。因此寻找一种经济、简单、无毒的制备高催化活性的TiO2的方法是当前的研究热点之一。
研究表明,以C作为载体可以有效的改善TiO2的光催化活性,其主要表现在:(1)C与TiO2复合后可以提高TiO2的光吸收能力和电子传递能力[14];(2)C可以有效的吸附目标有机物,特别是TiO2吸附效果较差的疏水性污染物,从而为TiO2提供高浓度的反应环境[15];(3)污染物通过C的吸附-迁移- TiO2光降解过程比TiO2单独降解污染物的过程要快,从而提高了TiO2的光催化活性[16]。
此外,实践证明,纳米TiO2在使用过程中易团聚、易流失、难回收是限制TiO2光催化技术应用的主要因素之一。因而采用磁性物质负载TiO2制备出能磁回收的光催化剂是扩大TiO2应用范围的一个重要途径。Fe3O4因其固有的超顺磁性、低毒、生物相容性好等优点被公认为理想的TiO2磁性载体[17-19]。然而,直接将TiO2负载到Fe3O4上,会造成TiO2部分被包裹,而且由于Fe3O4的稳定性较差,易于在空气中被氧化为γ-Fe2O3,从而使TiO2/γ-Fe2O3团聚,导致制备出来的TiO2/Fe3O4颗粒分散性差,此外,Fe3O4与TiO2的直接接触在一定程度上会影响TiO2的光催化活性[20-21]。因此,如何兼顾TiO2的光催化活性及回收利用是一项很有挑战性的工作。
本文以葡萄糖为C源,通过水热反应法制备得到以Fe3O4为核,C为壳的核壳型磁性复合材料(C@Fe3O4),并以此为载体,通过戊二醛的交联作用将纳米TiO2负载到C@Fe3O4上,得到磁性光催化剂TiO2/C@Fe3O4。该催化剂集合了C、Fe3O4和TiO2在光催化中的优点,并且通过C层将TiO2与Fe3O4隔开,可以避免Fe3O4对TiO2光催化活性的影响和Fe3O4氧化造成的催化剂团聚,以及Fe3O4对TiO2的包裹。而通过戊二醛的交联作用将小粒径的纳米TiO2牢固的固定在C上,可以有效的防止TiO2的团聚。将上述所制备的磁性光催化剂TiO2/C@Fe3O4用于亚甲基蓝光降解,研究其光催化性能及循环使用性能。
1 实验部分
1.1 TiO2的制备
TiO2的制备采用溶胶凝胶法制备:按照物质的量之比钛酸四丁酯∶水∶冰乙酸∶无水乙醇=1∶4∶7∶14为配方。先将6 mL乙酸、12 mL乙醇和2.1 mL水充分混合,配置为A溶液待用;在将6 mL乙酸、12 mL乙醇和10 mL Ti(OBu)4充分混合,配成 B 液;在磁力搅拌下,将A溶液逐滴加入到B溶液中,待滴加完毕后,将混合液在室温下陈化一天得到固体凝胶。将上述固体放在玻璃表面皿中自然干燥后,在用恒温干燥箱100℃干燥5 h,得固体干凝胶。将该固体干凝胶研磨得初始TiO2粉体;再将该粉体置于马弗炉中550℃煅烧1 h即得到纳米TiO2粉体。
1.2 水热法制备C@Fe3O4
将8 g葡萄糖粉末和1.0 mol的FeCl3·6H2O溶于35 mL的去离子水中,磁力搅拌15 min,再加入16.0 g NaAc,将形成的酒红色溶液超声分散15 min后,然后加入到100 mL不锈钢高压水热反应釜的聚四氟乙烯内衬里中,通入氮气排除溶液中的O2,避免反应生成的Fe3O4被氧化成Fe2O3,然后密封,180℃条件下水热反应6 h,自然冷却至室温。磁性分离,并用去离子水和乙醇分别清洗数次直到上清液澄清。将洗涤后的产物在60℃下真空干燥6 h,得黑色粉末状产物,即为核壳型磁性碳材料,将其命名为C@Fe3O4。
1.3 TiO2/C@Fe3O4的制备
称取1.0 g C@Fe3O4加入到200 mL1.5%的戊二醛水溶液中,在分别加入5.0 g纳米TiO2和20 mL HCl,超声分散15 min后,将混合液置于摇床上室温反应24 h,磁性分离,去离子水洗三次,真空60℃干燥6 h,产品即为TiO2/C@Fe3O4。
1.4 材料的表征
C@Fe3O4热重分析:样品在升温过程中重量的变化情况通过热失重分析仪进行测定,通过热失重曲线可以计算样品中各组分的相对比例。仪器型号:DTG-60。空气气氛下空气流速为30 mL/min,升温速率 10℃/min,测试温度 150~850℃。
粒度分布检测:通过粒度分析仪对样品进行粒度分析。仪器型号:GSL-101BI,振动频率:600。
SEM分析:取适量催化剂粉末置于导电胶上,通过扫描电镜(SEM,JSM-6700F,JEOL,日本)观察其形貌。
XRD分析:分别取一定质量的TiO2、C@Fe3O4和TiO2/C@Fe3O4于XRD分析仪上进行物质晶性分析。仪器型号:DX-2700,设置参数起始角度:10o,终止角度:80o,扫描步径:0.05o/s,测量方式:连续扫描,转动方式:θs-θd,管电压:40 kV,管电流:25 mV。
磁响应分析:用光学相机分别拍摄C@Fe3O4和TiO2/C@Fe3O4超声分散前及放置在磁铁边1 min后的图片。
1.5 光催化性能测试
分别移取100.0 mL 25 mg/L的亚甲基蓝溶液于3个250 mL锥形瓶中,分别加入0.1 g的TiO2、C@Fe3O4和TiO2/C@Fe3O4,在30 W紫外光条件下,持续搅拌,每隔10 min取10 mL混合溶液,磁分离取上清液,用可见光分光光度计测定亚甲基蓝的浓度(最大吸收波长为660 nm),计算降解率。同样条件下,空白及避光条件下TiO2/C@Fe3O4最为对照。
光催化剂TiO2/C@Fe3O4循环性能测试,其它条件同上,不同之处在于每次催化试验结束后,将使用过的TiO2/C@Fe3O4超声蒸馏水清洗后,60℃真空干燥,再进行下一次光催化循环试验,共循环10次。
亚甲基蓝的单位催化降解效率qt计算公式:
qt=(Ci-Ct)V/m
式中,Ci:是亚甲基蓝溶液的初始浓度,mg/L; Ct:是吸附平衡时亚甲基蓝溶液的浓度,mg/L;V:是溶液的体积,L;m:是磁性催化复合材料质量,g。
2 实验结果与分析
2.1 催化剂的表征
2.1.1 TiO2/C@Fe3O4的制备原理
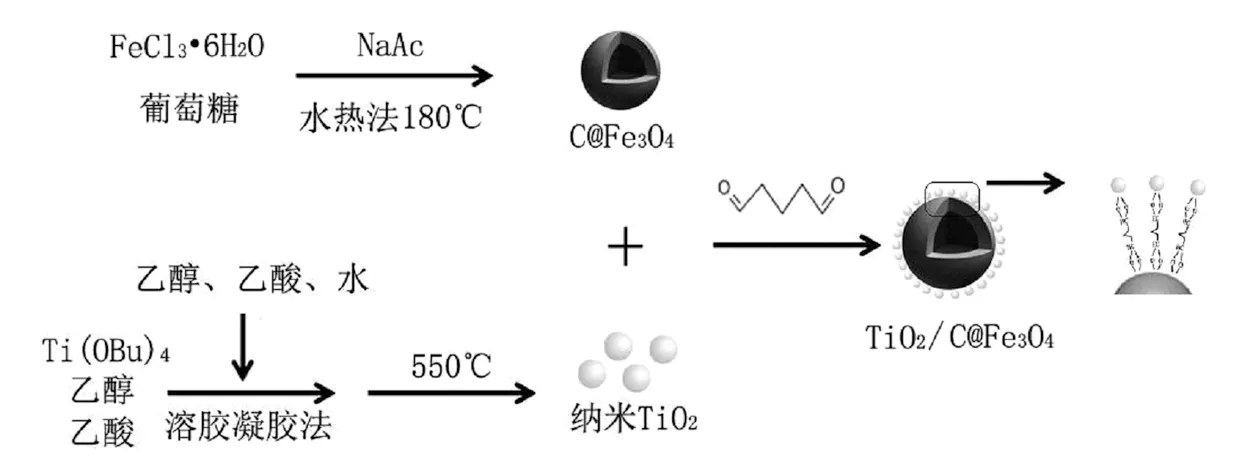
图1 TiO2/C@Fe3O4的制备
Fig.1 Schematic diagram for preparation of TiO2/C@Fe3O4nano-composites
首先,该研究通过水热反应一步制备核壳型C@Fe3O4,在同一反应体系内实现Fe3O4的成核及碳层的包裹。之所以可以一步合成C@Fe3O4,是因为反应体系采用了与经典共沉淀法制备Fe3O4不相同的碱源。经典的共沉淀法以强碱NaOH为碱源,而葡萄糖在初始pH值较高的条件下将无法实现碳化,因此若采用NaOH为碱源,在反应结束后不会出现固相碳化产物。本研究以弱碱NaAc为碱源,它在水溶液中先电离在水解,在反应体系中始终保持动态平衡,它不同于NaOH在反应体系中直接提供OH-,而是随着反应进行通过水解陆续提供,一方面可以控制Fe3+与OH-结合形成沉淀的反应速率,从而有效的控制晶体的成核数量和晶体的生长情况,这也是最终产物C@Fe3O4晶体尺寸较大、结晶较好的原因;另一方面,使用弱碱NaAc为碱源,可以有效的避免水热反应体系中的pH值过高导致葡萄糖无法碳化的现象,在较低的pH值下实现葡萄糖碳化对Fe3O4的包裹。
其次,纳米TiO2之所以可均匀的负载在C@Fe3O4的表面的主要原因是:在水溶液中,C@Fe3O4表面的碳层和TiO2都富含丰富的羟基,因此,在交联剂戊二醛的存在下,C@Fe3O4表面的一个羟基和TiO2表面的一个羟基分别与一分子的戊二醛发生羟醛缩合反应,使纳米TiO2牢固的负载到C@Fe3O4的表面;另外,超声分散可以使纳米TiO2均匀的分散在C@Fe3O4周围,由于纳米TiO2的粒度较小的,其表面能很高,也可以使其在与Fe3O4碰撞的时候通过物理吸附负载在Fe3O4的表面。
2.1.2 C@Fe3O4热重分析
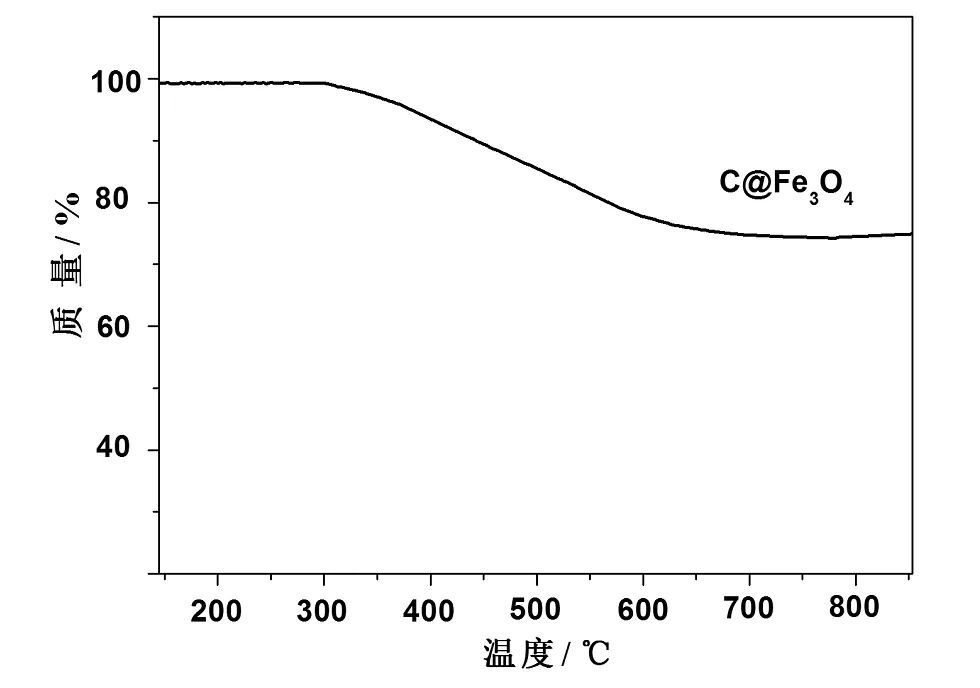
图2 C@Fe3O4热重分析Fig.2 Thermal gravimertric analysis of C@Fe3O4 under N2 atmosphere
为了确定C@Fe3O4中Fe3O4与其表层碳的比重,利用TGA对C@Fe3O4进行了热重分析,图2即为C@Fe3O4的热重分析图谱。从图中可以发现,C@Fe3O4的失重大致可以分为两个阶段,第一阶段为0~300℃,该过程失重较小,低于5%,该阶段主要为C@Fe3O4表层吸附水及部分羟基的失去;随着温度的升高进入第二个阶段,该阶段为300~700℃,
该阶段Fe3O4表面葡萄糖聚合形成的无定型碳开始分解,因此存在一个较明显的失重。随着温度的上升,由于Fe3O4表面碳的完全燃烧,失重曲线趋于稳定。由于失重测试是在O2条件进行的,可以预见,随着温度的上升,由于表层碳的损失,Fe3O4将会逐渐被氧化为Fe2O3,失重曲线也将略有上升。总之,从该热重曲线可以证明C@Fe3O4为Fe3O4和碳的符合材料,并且从两个阶段的失重曲线还可计算出C@Fe3O4中含有72%的Fe3O4。
2.1.3 SEM及粒度分析
图3a为TiO2/C@Fe3O4的SEM图谱,扫描电镜显示,通过水热反应及戊二醛交联作用制备所得复合物TiO2/C@Fe3O4颗粒分散性较好,颗粒比较规整,形貌近似球形,粒径约为4~5 μm。为进一步研究样品的形貌尺寸,对样品进行粒度分析。图3b、c、d分别为TiO2、C@Fe3O4和TiO2/C@Fe3O4粒经分布图。从图中可以发现,三种样品的平均粒径分别为15.03 nm、4.01 μm及4.58 μm,且三种样品的粒径分布都呈现尖锐的单峰,说明三种样品分散性好,粒径均匀。此外,从图中还可以发现,rTiO2/C@Fe3O4约等于rC@Fe3O4与2rTiO2之和,说明TiO2成功负载到C@Fe3O4的表面。
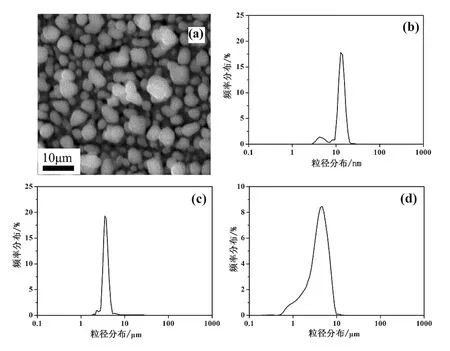
图3 TiO2/C@Fe3O4(a)的SEM及TiO2(b)、C@Fe3O4(c)和TiO2/C@Fe3O4(d)粒经分布图
Fig.3 SEM image of TiO2/C@Fe3O4and the partice size distribution of TiO2(b),C@Fe3O4(c)and TiO2/C@Fe3O4(d)
2.1.4 XRD分析
为了确定样品的晶相组成,对粉末样品TiO2、C@Fe3O4和TiO2/ C@Fe3O4进行了XRD分析,如图4。图4c为C@Fe3O4的XRD衍射图谱,从图中可以明显的看出有6个特征吸收峰分别出现在30.50°,35.85°,43.51°,53.87°,57.75°和 62.81°,它们分别对应Fe3O4的(220),(311),(400),(422),(511) 和 (440)6个晶面,它与标准Fe3O4的XRD卡片进行比较发现,这6个峰与具有超顺磁性的尖晶石型Fe3O4结构完全符合,证明实验制备的Fe3O4具备超顺磁性。此外,碳层为无定型结构,因此在图中无明显的吸收峰。图4a为TiO2的XRD衍射图谱,从图中可以明显的看出有7个特征吸收峰分别出现在25.37°,37.85°,48.10°,53.91,55.12°,62.70°和68.78°,它们分别对应TiO2的(101),(004),(200),(105),(211),(204)和(116)7个晶面,它与标准TiO2的XRD卡片进行比较发现,这7个峰与锐钛型TiO2结构完全符合,证明实验制备的纳米TiO2为对有机染料就有高效催化效果的锐钛型纳米材料。图4b为TiO2/C@Fe3O4的XRD衍射图谱,从图中发现上述尖晶石型Fe3O4和锐钛型TiO2的特征峰,说明纳米TiO2成功负载到核壳型磁性碳材料的表面,并且在制备过程中保持了Fe3O4的超顺磁性和TiO2的优良光催化活性。
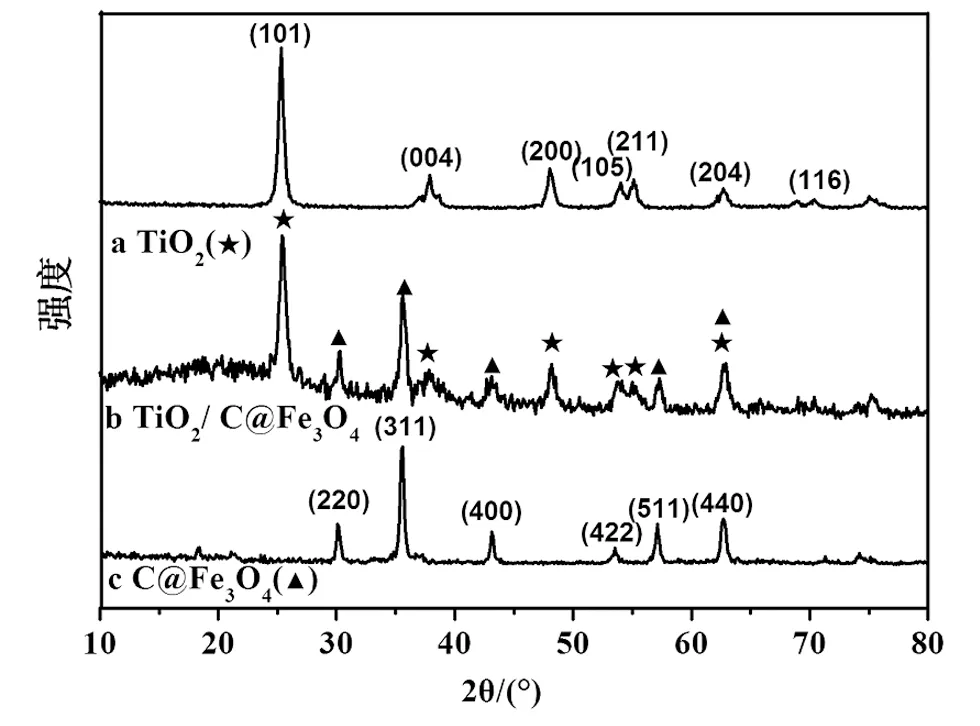
图4 TiO2、C@Fe3O4和TiO2/ C@Fe3O4的XRD图谱Fig.4 XRD patterns of TiO2,C@Fe3O4 and TiO2/C@Fe3O4
2.2 光催化性能测试
2.2.1 对比催化降解实验
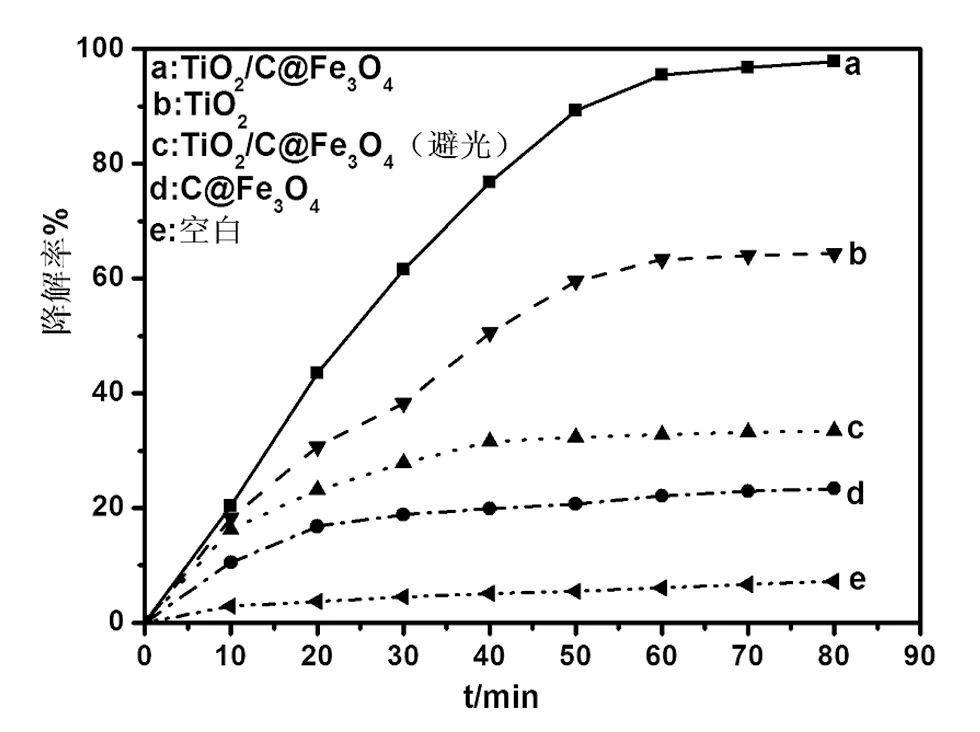
图5 对比催化降解实验Fig. 5 The photocatalysis of different catalysts
图5为不同条件下,不同催化剂对亚甲基蓝的光催化情况。曲线e为无催化剂的空白对照实验,结果说明,在紫外光条件下亚甲基蓝的降解率极低。曲线d为C@Fe3O4在紫外光下对亚甲基蓝的去除率,从图中发现C@Fe3O4对亚甲基蓝的吸附在30 min左右到达饱和,说明C@Fe3O4对亚甲基蓝具有一定的物理吸附,其吸附率为22.1%。曲线c为TiO2/C@Fe3O4在避光条件下对亚甲基蓝的去除率,其趋势与曲线d相类似,在30 min左右达到吸附平衡,去除率为32.8%,比C@Fe3O4对亚甲基蓝的去除率高10.7%,说明TiO2在避光条件下对亚甲基蓝有一定的吸附降解作用。曲线b为纳米TiO2颗粒在紫外光条件下对亚甲基蓝的降解率,从图中发现TiO2对亚甲基蓝的光降解在60 min左右到达平衡,其吸附率为63.3%,与曲线c和d相比可以发现,紫外光照可以大大提高纳米TiO2颗粒对亚甲基蓝的降解率,但其降解效率仍然不高。曲线a为TiO2/C@Fe3O4在紫外光条件下对亚甲基蓝的降解率,从图中发现TiO2/C@Fe3O4对亚甲基蓝的降解速率随着时间延长急速提高,在60 min时达到97.5%, 其对亚甲基蓝的降解率远远大于TiO2颗粒对亚甲基蓝的降解率,这可能是因为C@Fe3O4与TiO2的复合可以提高TiO2对亚甲基蓝的吸附作用,并且亚甲基蓝通过C的吸附-迁移- TiO2光降解过程比TiO2单独降解亚甲基蓝的过程要快,此外,C与TiO2的复合可以提高TiO2的光吸收与电子传递能力也是TiO2/C@Fe3O4具有优异催化效果的原因之一。
2.2.2 TiO2/C@Fe3O4循环紫外光催化降解实验
众所周知,纳米TiO2在使用过程中易团聚、易流失和难回收是限制其广泛应用的主要阻碍之一。因此,光催化剂TiO2/C@Fe3O4的循环使用性能是考察其能否广泛使用的重要指标。图6a为在紫外条件下光催化剂TiO2/C@Fe3O4循环使用10次对亚甲基蓝(浓度为25mg/L)溶液的降解率。从图中可以观察到,随着循环次数的增加,光催化剂TiO2/C@Fe3O4的催化效率有所下降,第一次使用其60 min最大光催化降解效率为97.5%,当循环使用10次后,其60 min最大降解率依然维持在教高的水平,只比第一次降低了5.9%。说明光催化剂TiO2/C@Fe3O4具有优异的循环使用性能。图6b为光催化剂TiO2/C@Fe3O4第10次循环使用降解亚甲基蓝磁分离前后的光学照片。从图中可以观察到,即使使用10次后,光催化剂TiO2/C@Fe3O4仍然具有显著的磁分离效果,光催化降解后磁分离溶液近乎透明,一方面再次说明光催化剂TiO2/C@Fe3O4的催化效果优异;另一方面说明TiO2牢固的负载在C@Fe3O4上,有效减小了TiO2的流失。
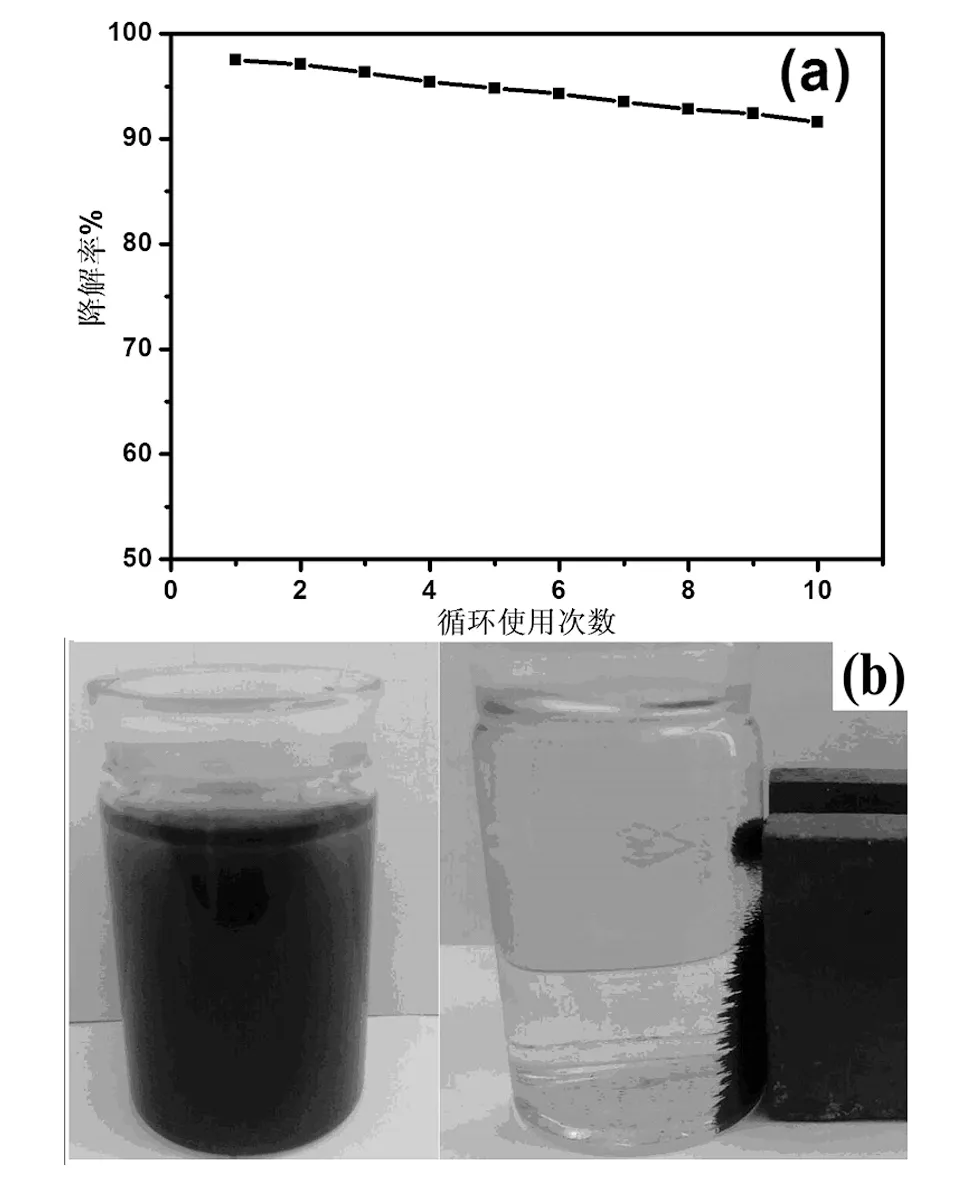
图6 TiO2/C@Fe3O4的循环使用效率及其磁响应性Fig.6 Recovery yield and magnetic response of the TiO2/C@Fe3O4 photocatalyst
3 结论
(1)以葡萄糖和氯化铁为原料,通过水热反应法以及戊二醛的交联作用制备得到核壳型磁性光催化剂TiO2/C@Fe3O4,TiO2/C@Fe3O4为单分散微球,平均粒径为4.58 μm,TiO2的平均粒径为15.03 nm,并且均匀的负载在C@Fe3O4表面。TiO2/C@Fe3O4催化剂中TiO2为光催化活性最高的锐钛矿型晶体,Fe3O4为具有超顺磁性的尖晶石型晶体;
(2)TiO2/C@Fe3O4通过C层将TiO2与Fe3O4隔开,避免了Fe3O4对TiO2光催化活性的影响和Fe3O4氧化造成的催化剂团聚,以及Fe3O4对TiO2的包裹。而通过戊二醛的交联作用将纳米TiO2牢固的固定在C上,防止了TiO2的团聚和流失。
(3)在紫外光条件下,磁性光催化剂TiO2/C@Fe3O4对亚甲基蓝的最大降解率为97.5%,循环使用10次后最大降解率相对第一次仅降低了5.9%。
因此, TiO2/C@Fe3O4磁性光催化剂不仅具有良好的光催化活性和循环使用性能,且利于收集,可以广泛应用于污水处理。

