晚期非小细胞肺癌患者肿瘤突变负荷与靶向治疗疗效相关性
童 琳,丁 宁,李佳旻,徐晓波,张 勇,叶茂松,李 春,张 新,洪群英,周 建,白春学,胡 洁
复旦大学附属中山医院呼吸科,上海市呼吸病研究所,上海 200032
肿瘤突变负荷(tumor mutational burden, TMB)是免疫检查点(如PD-1/PD-L1)抑制剂治疗晚期肺癌疗效的预测生物标志物之一[1-4]。多项临床研究[5-8]采用二代测序技术(next-generation sequencing, NGS)检测肿瘤组织的TMB,发现实体瘤患者免疫治疗的生存获益与高TMB相关。有研究[9]发现,在表皮生长因子受体(epidermal growth factor receptor, EGFR)突变患者中,EGFR-酪氨酸激酶抑制剂(TKIs)治疗的疗效和预后与TMB密切相关,但与免疫治疗的情况相反,即高TMB患者经EGFR-TKI治疗后的总生存期和至治疗停止时间(TTD)均较中低TMB患者缩短。
约20%的非小细胞肺癌(NSCLC)患者具有EGFR敏感突变,包括常见的19外显子缺失、L858R,以及罕见的L861Q、G719S等。EGFR-TKIs靶向治疗能改善晚期肺癌患者的预后,提高中位无进展生存期(PFS)至12个月,客观缓解率达70%[10]。在具有间变性淋巴瘤激酶(ALK)融合基因(约5%NSCLC患者)、活性氧簇-1(ROS-1)融合基因(约1%NSCLC患者)、Met 14外显子跳跃式突变(约4%NSCLC患者)等驱动突变的晚期肺癌患者中,克唑替尼治疗的客观缓解率可达60%,中位无进展生存期(PFS)为7~19个月[11-15]。然而,不同患者间TKIs治疗的缓解持续时间存在较大差异,目前尚缺乏提示其疗效的预测标志物。因此,本研究采用靶向富集目标基因NGS技术,对晚期肺癌患者的肿瘤组织标本进行包含416个肿瘤相关基因的检测,分析肿瘤组织TMB水平与TKIs靶向治疗疗效的相关性。
1 资料与方法
1.1 一般资料 纳入2016年1月~2018年1月在复旦大学附属中山医院接受一线TKIs靶向治疗,存在敏感驱动突变的51例亚裔晚期NSCLC患者。主要入选标准:(1)年龄>18岁;(2)经支气管镜或经皮肺穿刺原发灶活检,确诊为原发性非小细胞肺癌;(3)经全身影像学检查,根据国际肺癌研究协会(IASLC)第8版肺癌TNM分期评估为ⅢB~Ⅳ期肺癌;(4)予一线 TKIs靶向治疗,包括一代或二代EGFR-TKIs和克唑替尼;(5)能够提供足够的肿瘤组织标本进行NGS。主要排除标准:(1)患有除原发性肺癌外的其他恶性肿瘤;(2)怀孕。本研究经复旦大学附属中山医院伦理委员会审核批准(B2016-154R),所有患者均签署知情同意书。
最终本研究共纳入51例晚期肺癌患者,中位年龄为61岁(28~71岁),其中27例(53%)为女性,41例(80%)无吸烟史。病理诊断:腺癌44例(86%),腺鳞癌3例(6%),鳞癌3例(6%),病理类型不确定的非小细胞肺癌(NSCLC-NOS)1例(2%)。中位随访时间为18个月。患者一般情况见表1。
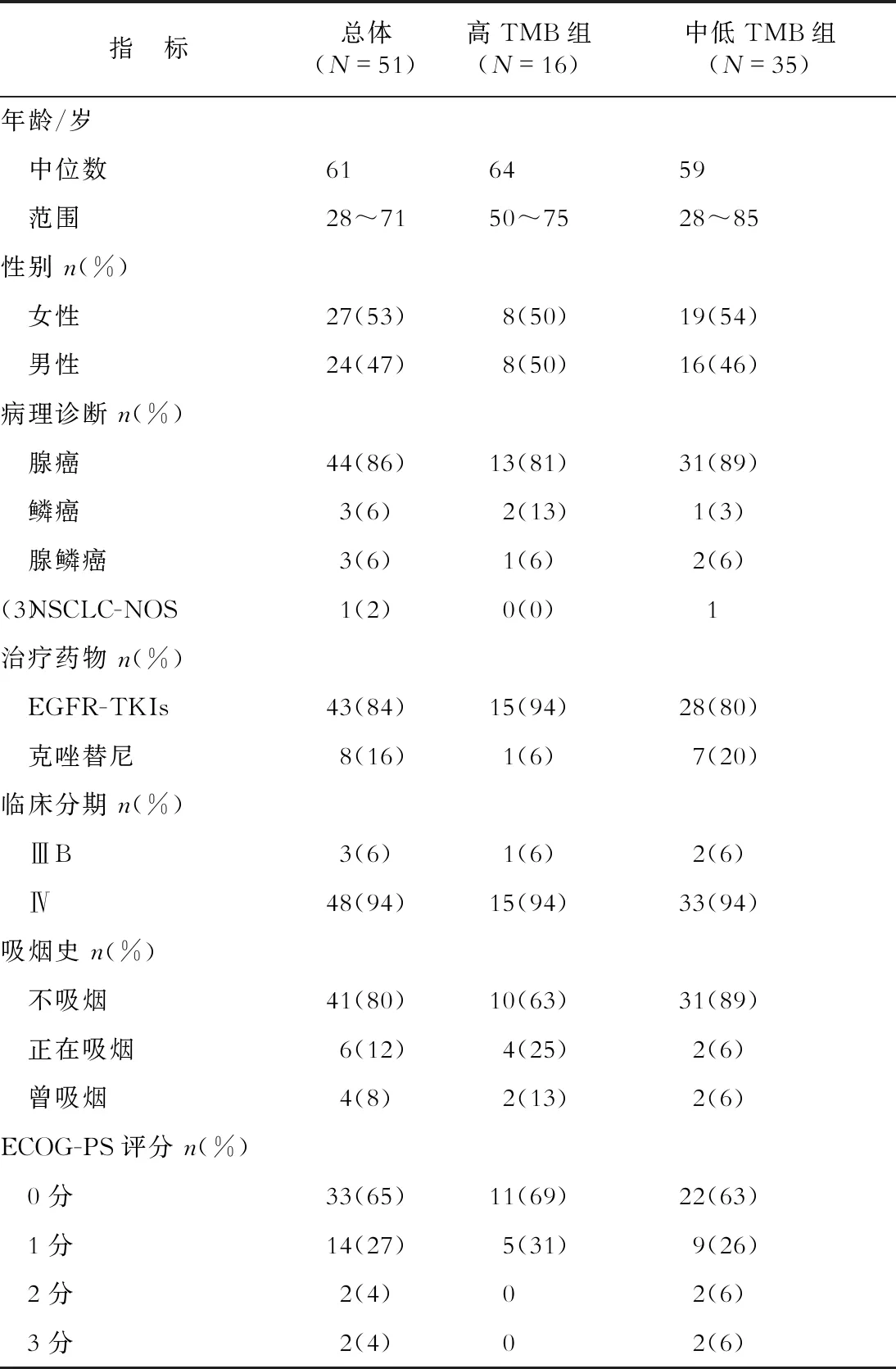
表1 患者一般情况
NSCLC-NOS:病理类型不确定的非小细胞肺癌;EGFR-TKIs:表皮生长因子受体-酪氨酸激酶抑制剂;ECOG-PS:美国东岸癌症临床研究合作组织-体力状况评分
1.2 基因检测 收集51例患者的支气管镜或经皮肺穿刺活检肿瘤组织标本,送南京世和基因生物技术有限公司进行NGS检测。同时采集静脉血用于阴性对照,以判断种系突变。
1.2.1 样本处理 肿瘤标本:取经甲醛固定和石蜡包埋(FFPE)的肿瘤组织6~10 μm(n≥5),用苏木精-伊红(H-E)染色后,由病理专家判断其中肿瘤细胞含量;采用肿瘤细胞含量大于10%的组织。血浆样本:用EDTA抗凝管收集8~10 mL外周血,于2 h内分离血浆(1 800 ×g,离心10 min),白细胞沉淀用于阴性对照。
1.2.2 DNA提取和文库准备 采用Qiagen公司试剂盒提取组织和白细胞DNA。测序文库使用KAPA Hyper Prep试剂盒(KAPA Biosystems)进行制备。PCR扩增和文库纯化后进行目标基因富集。
1.2.3 目标基因富集和测序 DNA文库加标签后,将多个样本混合,得到总量为2 μg的DNA混合文库。用定制的生物素型DNA探针(GeneseeqOneTM),对文库中416个癌症相关基因的编码区域和16个基因的内含子进行杂交、捕获。用Illumina p5、p7引物和KAPA HiFi HotStart ReadyMix (KAPA Biosystems)对文库DNA进行扩增,富集得到的文库在HiSeq4000(Illumina)平台上用2×150 bp测序试剂盒(Illumina)进行测序。
1.3 测序数据处理 用Trimmomatic 25软件对测序数据进行过滤,去除低质量碱基或N碱基,并通过BWA(Burrows-Wheeler Aligner)将过滤后的数据与参考序列hg19基因组(Human Genome version 19)对比。采用GATK(Genome Analysis Toolkit)分析单核苷酸变异(SNV)和插入缺失突变(indel);经单核苷酸多态性数据库(dbSNP)和国际千人基因组计划分析后去除常见变异。
1.4 TMB计算及分组 TMB定义为编码区1 Mb碱基中所含有的肿瘤特有突变的个数。将肿瘤样本与白细胞数据进行比对,分析体细胞突变,去除种系突变。TMB包括编码区域SNV(含错义突变和同义突变)和插入缺失突变,而去除原发性肺癌中驱动基因突变和常见抑癌基因的截短突变和移码突变。根据Offin等[9]研究,采用三分法将51例患者分为高TMB组(TMB≥8)和中低TMB组(TMB<8)。
2 结 果
2.1 两组患者的基本资料及基因突变情况比较 51例患者的中位TMB水平为6.2个突变/Mb。高TMB组患者的中位TMB为10.6个突变/Mb,中低TMB组患者的中位TMB为3.7个突变/Mb。两组患者的一般情况差异无统计学意义(表1)。两组患者的基因突变情况见表2。
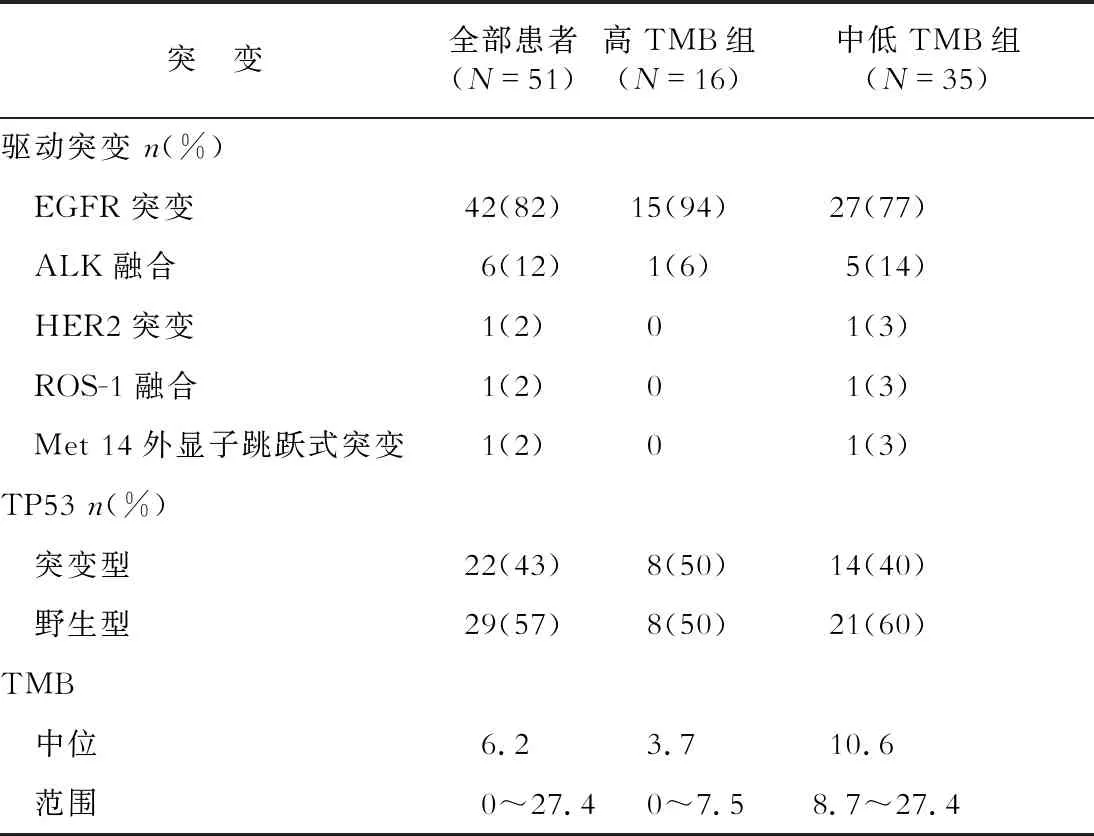
表2 患者的基因突变信息
EGFR:表皮生长因子受体;ALK:间变性淋巴瘤激酶;HER2:人表皮生长因子受体-2;TMB:肿瘤突变负荷
2.2 TP53基因突变对TMB的影响 高TMB组患者合并TP53突变的频率(50%)较中低TMB组(40%)高(表2)。TP53突变患者的TMB与野生型差异无统计学意义(图1)。
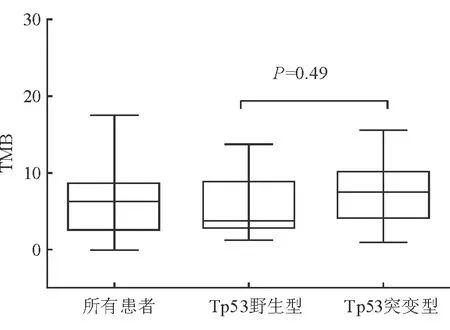
图1 TP53突变对肿瘤组织TMB的影响
2.3 吸烟对TMB的影响 高TMB组患者中有吸烟史的患者占比高于(37%)中低TMB组(11%,表1)。有吸烟史患者的TMB高于无吸烟史患者(P=0.046,图2)。
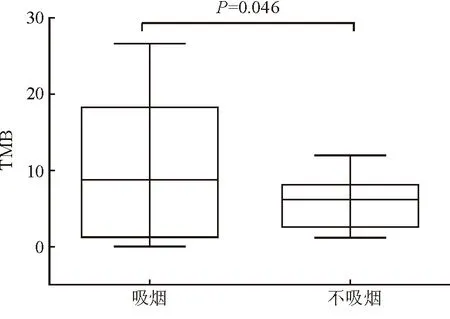
图2 吸烟对组织TMB的影响
2.4 TMB与TKIs靶向治疗疗效的关系 Log-rank分析(图3A)显示:中低TMB组患者的中位PFS显著长于高TMB组患者(410 dvs217 d,HR=0.331,95% CI 0.165~0.665,P=0.001 2)。亚组分析(图3B)显示:在男女性、有无吸烟史、合并TP53基因突变与否患者中,中低TMB组患者的中位PFS均长于高TMB组患者(P<0.05);在腺癌、EGFR突变、EGFR 19外显子缺失、EGFR L858R患者中,中低TMB组患者的中位PFS均长于高TMB组患者(P<0.05);在非腺癌患者中,中低TMB组患者的中位PFS有长于高TMB组患者的趋势(HR=0.286,95%CI 0.05~1.77,P=0.15)。Log-rank分析(图3C)显示:在EGFR突变患者中,经EGFR-TKIs治疗后,中低TMB组患者的中位PFS长于高TMB组患者(410 dvs189 d,HR=0.256,95% CI 0.108~0.608,P=0.002)。
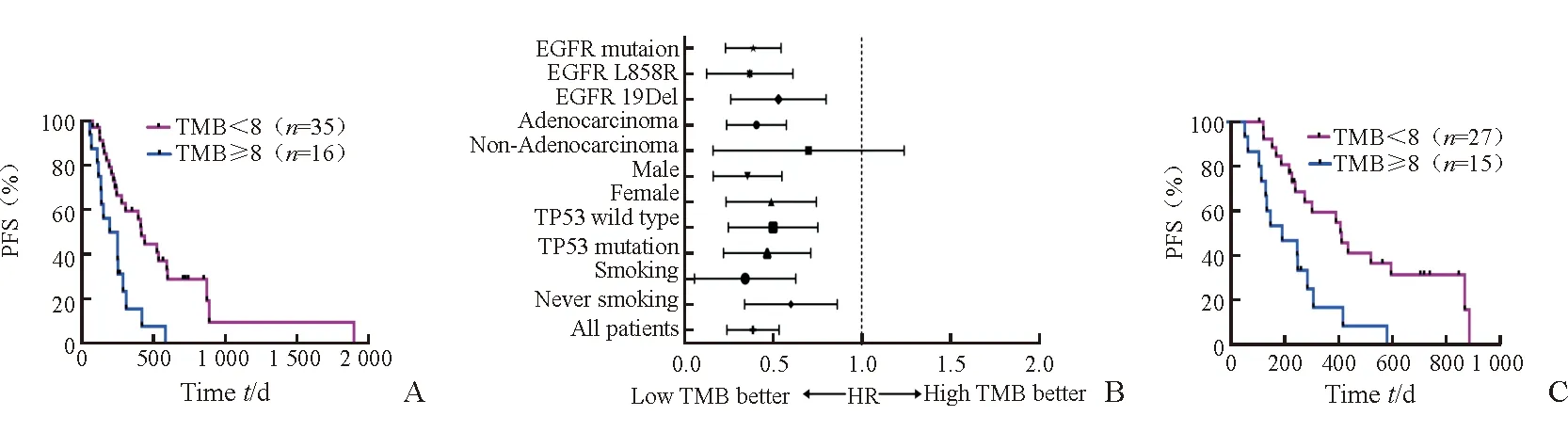
图3 TMB与患者PFS的相关性
3 讨 论
目前认为在免疫治疗中,高TMB与治疗反应的关系是基于增加的肿瘤特异性新生抗原负荷。而在靶向治疗中,高TMB水平可能与耐药通路增加或肿瘤亚克隆导致临床耐药相关。Offin等研究[9]发现,EGFR突变患者中,EGFR-TKIs的疗效、患者预后与TMB密切相关,与免疫治疗情况相反。然而,这项研究中仅纳入了EGFR 19外显子缺失和L858R突变的Ⅳ期肺癌患者,且其中92%的患者接受了厄洛替尼治疗,因此该结论可外推的范围有限。此外,该研究的疗效衡量指标采用TTD,而由于多数采用靶向治疗的患者在疾病缓慢进展时仍继续使用TKIs,因此TTD与PFS在靶向治疗的疗效评估中存在一定差异。本研究采用PFS作为靶向治疗疗效的评估指标,且包括ⅢB~Ⅳ期患者,同时纳入了EGFR突变(包括非常见EGFR突变)及 ALK融合、ROS-1融合等相对少见突变类型的患者,治疗药物包括一代及二代EGFR-TKIs(吉非替尼、厄洛替尼、埃克替尼、阿法替尼)和克唑替尼。因此本研究更贴近真实世界情况,结论的可外推范围更广。
Offin等[9]发现,TP53突变与疾病至进展时间短有关,高TMB组患者中TP53突变者的比例高于中低TMB组,但多因素分析中校正TP53突变状态后仍显示高TMB水平与患者预后差相关。本研究结果与该研究相一致,提示合并TP53突变对TMB预测TKIs在晚期肺癌患者中的疗效无明显影响。
本研究结果提示,在具有敏感驱动突变的晚期肺癌患者中,中低TMB组患者靶向治疗PFS较高TMB组患者明显延长,且在亚组分析中得出了相似结论,提示TKIs靶向治疗对中低TMB组患者的疗效优于高TMB组患者。然而,本研究尚存在一定缺陷,包括:缺乏总生存期数据,无法分析TMB与预后的关系;非前瞻性研究;样本量较少等。今后需进一步设计前瞻性临床研究,并扩大研究队列的样本量,以进一步验证本研究结论。

