伴有胼胝体压部可逆性病变的临床症状轻微的脑炎/脑病一例
袁俊亮 胡文立
1 病例报告患者女,26岁。主因“反复发热12 d”于2017-03-31入院。入院前12 d不明原因出现发热,最高体温39.4℃,伴畏寒、寒战,伴尿频、尿急、尿痛,无咳嗽咳痰,无肢体乏力,间断发热,自行口服布洛芬后体温降至正常;入院前8 d再次发热,就诊于作者医院发热门诊,行胸X片检查示双下肺纹理增重,血常规检查显示白细胞增高,尿常规白细胞(+),降钙素原<0.05 ng/mL,考虑“上呼吸道感染”,给予退热等对症治疗。入院前4 d再次发热,体温39.3℃,予以“赖氨匹林、更昔洛韦” 等退热以及抗病毒治疗1 d,仍间断发热,以“发热待查”收入作者医院。发病以来,精神状态可,食欲可,睡眠欠佳,二便正常,体重无变化。入院查体:体温38.7℃,血压 114/74 mmHg(1 mmHg=0.133 kPa)。意识清楚,言语流利,反应迟钝,高级皮层功能检查大致正常。双侧瞳孔等大等圆,直径3 mm,对光反射灵敏,双眼球活动充分,无眼震。双侧额纹、鼻唇沟对称。伸舌居中。四肢肌力V级。指鼻、跟-膝-胫试验稳准,闭目难立征阴性。四肢深、浅感觉大致正常。四肢腱反射稍活跃,双病理征阴性。颈软,脑膜刺激征(-)。实验室检查:血白细胞10.2×109/L,中性粒细胞比例 66.1%;血钠132.1 mmol/l(135~145 mmol/l);肝肾功能、甲状腺功能、病毒病原学、降钙素原、红细胞沉降率、C反应蛋白、血培养、铁蛋白、乙肝、丙肝、梅毒、艾滋、肿瘤标志物十一项、自身抗体十一项、抗中性粒细胞抗体、抗核抗体、抗双链脱氧核糖核酸抗体、体液免疫、风湿类风湿、体液免疫等均未见异常。脑脊液(cerebrospinal fluid,CSF)检查:外观无色透明,压力320 mmH2O(1 mmH2O=9.8×10-3kPa),潘氏实验(+),白细胞数105/μL,单核细胞比例85%,多核细胞比例14%,氯118.2 mmol/L,糖2.64 mmol/L,微量总蛋白880 mg/L。CSF细菌培养、真菌培养、细菌涂片、真菌涂片、抗酸染色、墨汁染色均(-)。CSF和血神经节苷脂谱抗体(-),CSF寡克隆区带(+),血-脑脊液屏障通透性=10.71×103(<5×103),IgG指数=1.37(<0.85),CSF的IgG鞘内合成率=16.73 mg/24 h(<7 mg/24 h),血髓鞘碱性蛋白=8.81 μg/L(<2.5 μg/L)。余CSF髓鞘碱性蛋白,血、CSF髓鞘碱性蛋白自身抗体,血、CSF抗髓鞘少突胶质细胞糖蛋白抗体均未见异常。头磁共振检查(2017-04-04)结果显示胼胝体压部异常信号(图1),复查(2017-04-20)结果显示胼胝体压部异常信号改变,较前减弱。肌电图检查:双正中神经F波出现率均减少;左正中神经、右尺神经神经源性损害。视觉诱发电位检查:双目棋盘格刺激条件下,P100波峰潜伏期均延长,波幅降低,波形分化均不佳。颈椎磁共振、肺高分辨CT、腹部超声、心脏超声、心电图检查结果均未见异常。诊断:伴有胼胝体压部可逆性病灶的临床症状轻微的脑炎/脑病(clinically mild encephalitis/encephalopathy with a reversible splenial lesion,MERS)。给予以抗病毒、糖皮质激素冲击后改为口服治疗,甘露醇脱水降颅内压等对症治疗4周,患者发热、反应迟钝等症状完全缓解出院。3个月后随访,预后良好,未遗留神经系统症状,复查头磁共振增强扫描(2017-05-12)检查显示胼胝体压部异常信号消失,未见强化(图2)。
2 讨论
MERS最早是由日本学者于2004年提出的一个概念[1]。有学者认为MERS类似于可逆性胼胝体压部病变综合征(reversible splenial lesion syndrome,RESLES),亦有学者把MERS认为是RESLES的一部分[2-3]。目前研究认为MERS是一种新的累及胼胝体的临床、影像综合征,以胼胝体压部有可逆性的DWI高信号病灶为特点,灶边界清楚,多数无明显水肿及占位效应,增强无强化。临床主要表现为脑炎或脑病症状,可出现谵妄等精神症状,良性病程,一般于1周内消失,1个月痊愈,预后良好[4]。本例患者为青年女性,急性起病,主要表现为反复发热12 d,病变主要累及大脑皮层、视神经、周围神经、神经根等部位,脑脊液检查压力增高,白细胞和蛋白升高,糖和氯化物正常;脑MRI检查显示胼胝体压部有异常病变,复查MRI后胼胝体压部病变消失,MERS诊断明确。
MERS的发病与多种因素有关。最常见的病因为感染、抗癫痫药物的使用/撤药、严重代谢紊乱(尤其是低钠血症[5- 6])等。感染因素中,病毒感染最为常见[4],约40%的患者未能找到病原体,在明确病原体感染中流感病毒最为常见[7]。MERS患者中约58.3%者存在轻度低钠血症,平均血清钠为(131.0±4.1)mmol/L,脑脊液中钠异常率约为16.8%[5]。低钠血症可能是MERS的病因之一,可能与低钠引起的脑渗透压改变进而导致髓鞘水肿有关,但病灶为何仅仅局限于胼胝体压部的机制尚不清楚[5-6]。本例患者表现为低钠血症,但未能寻找到明确的病原体。

注:A:轴位T1WI序列;B:轴位T2WI序列;C:轴位DWI序列;D:矢状位FLAIR序列 图1 患者头磁共振检查(2017-04-04)结果显示胼胝体压部呈T1WI低信号,T2WI、DWI和FLAIR像高信号改变
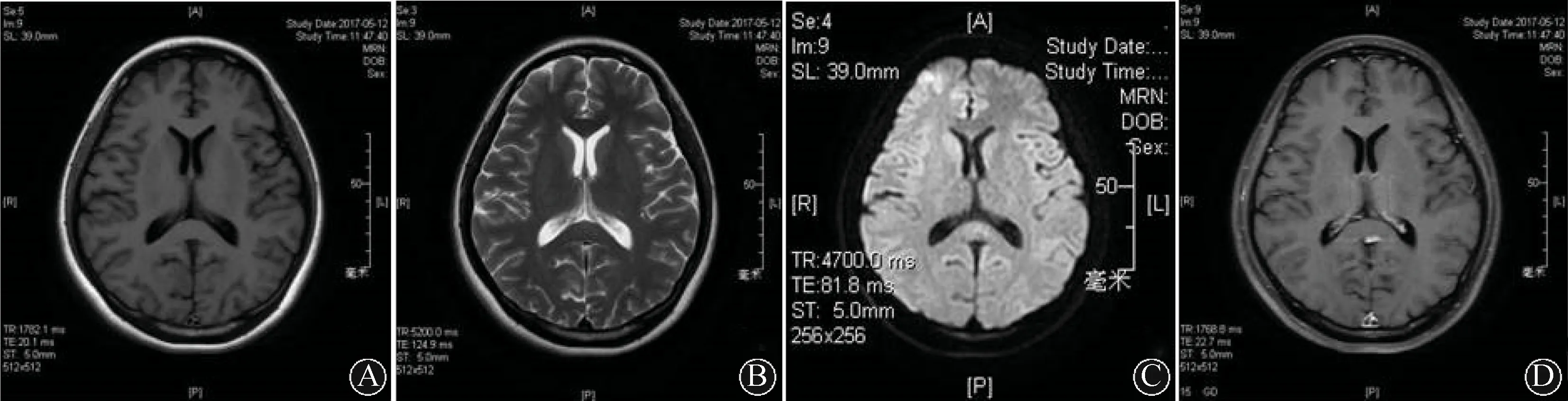
注:A:轴位T1WI序列;B:轴位T2WI序列;C:轴位DWI序列;D:轴位T1WI增强序列 图2 患者头颅磁共振复查(2017-05-12)结果显示胼胝体压部异常信号消失,增强未见强化
目前有关MERS的发病机制尚不清楚[1],可能与髓鞘内及髓鞘间隙水肿、水电解质失衡(低钠血症)、炎性反应、轴索损伤[3]、细胞因子的增加引起的氧化应激反应[8]以及遗传[9]等有关。2006年首次提出MERS谱系的概念,分MERS-Ⅰ型(仅累及胼胝体压部)和MERS-Ⅱ型(延伸到白质和/或整个胼胝体受累)两型[10-11]。本患者符合MERS -I型。
MERS应该与急性播散性脑脊髓炎、原发性胼胝体变性、可逆性后部脑病综合征、脑血管病、多发性硬化、遗传性白质脑病、遗传代谢性疾病、肿瘤、胼胝体挫伤、电解质紊乱引起的脑桥外髓鞘溶解、自身免疫性脑炎等疾病相鉴别。MERS的治疗主要包括病因和对症治疗[12],包括积极抗感染、控制脑水肿、营养神经、维持水电解质平衡以及控制惊厥发作。糖皮质激素冲击及静脉注射用免疫球蛋白常被用于MERS治疗,然而其疗效尚缺乏确切证据[4,6]。

