脑外伤后并发吉兰-巴雷综合征一例并文献复习
曹湘玉 袁梅 汤永红
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)又名急性炎症性脱髓鞘性多发性神经根神经病(acute inflammatory demyelinating polyneuropathy,AIDP)或急性炎性脱髓鞘性多发性神经根神经炎,是一种体液免疫和细胞免疫共同介导的自身免疫性周围神经病,主要损害脊神经根和周围神经,常累及脑神经。目前针对GBS的病因尚不明确,大多数GBS患者发病前1~3周有呼吸道或胃肠道前驱感染史,有注射神经节苷脂及外科手术后并发GBS的报道,但脑外伤后患者并发GBS的报道极少。现报道作者医院诊治的1例脑外伤后并发GBS患者的临床资料,并进行文献复习。
1 对象和方法
1.1 对象
1.1.1病例报告:患者男,60岁。因“摔伤后头痛伴间断呕吐5 h余”于2018-11-15入院。既往体健。入院查体:急性痛苦病容,意识模糊,呼唤能睁眼,问答不切题,言语较混乱,格拉斯哥昏迷评分(GCS)为12分(E3V4M5),左侧顶枕部头皮挫伤肿胀,双侧瞳孔等大等圆,直径2.5 mm,对光反射灵敏,颈抵抗(+),深浅反射存在,无亢进,四肢刺痛能定位,右侧肢体肌力3级,左侧肢体约4级,四肢肌张力不高,双侧巴宾斯基征阴性。头颅CT(2018-11-15)检查结果显示,左侧颞叶多发脑挫裂伤血肿形成;左侧额颞顶部硬膜下血肿,出血量约15 mL;蛛网膜下腔出血。头颈部CT血管造影(CTA)检查未见明显异常。予以镇静镇痛、止血、脱水降颅压、控制血压、营养支持及对症治疗,未使用神经节苷脂药物。第2、3天复查头颅CT显示蛛网膜下腔出血较前稍减少,余较前无明显变化。治疗7 d后患者意识清楚,自主睁眼,言语清楚,问答切题,四肢肌力4级,肌张力正常,复查头颅CT(2018-11-23)显示左侧颞叶多发脑挫裂伤血肿较前吸收;左侧额颞顶部硬膜下血肿较前稍缩小;蛛网膜下腔出血较前吸收。治疗第14天出现右侧肢体乏力,并逐渐发展为四肢乏力,由下向上呈进行性加重,以双下肢乏力明显,不能站立,无呼吸困难、肢体麻木,大小便正常。查体:意识清楚,脑神经检查正常,双上肢肌力2~3级,双下肢肌力0~1级,四肢肌张力减低,双侧腹壁反射正常,双侧肱二头肌反射、肱三头肌反射、膝腱反射、踝反射未引出,无髌阵挛及踝阵挛,四肢及躯干痛触觉深感觉正常,共济运动检查不合作,病理征(-)。立即复查头颅CT(2018-11-30)及头部MRI检查示未见新发病灶,余表现较前明显好转;弥散张量成像(DTI)检查提示左侧颞枕束后部、颞叶沟回束、视辐射较对侧纤维束明显减少。颈胸腰椎MRI检查示颈胸腰椎退行性变,未见脊髓损伤。肌电图(2018-12-3)检查示上下肢神经源性损害,累及运动纤维,轴索损害为主。治疗第18天行腰穿脑脊液(CSF)常规+生化检查显示,蛋白413.8 mg/L,白细胞计数1.0×106/L,Gram’s染色、抗酸染色、墨汁负染阴性,TSH受体抗体、GAD抗体、EB病毒抗体检测未见异常;6 d后复查CSF显示,蛋白595.43 mg/L,白细胞计数10×106/L,自身免疫性周围神经病抗体谱示血清抗GD1a抗体IgG(+),脑脊液抗Sulfatide抗体IgG(+)。诊断考虑脑外伤后并发GBS急性运动轴索性神经病(acute motor axonal neuropathy,AMAN),予以免疫球蛋白、B族维生素、康复及对症治疗后肌力逐渐好转。查体:意识清楚,双上肢肌力近端4级,远端2级,双下肢肌力近端2级,远端3级,四肢肌张力低。出院后继续康复治疗,1个月后随访,四肢肌力较前进一步恢复,可辅助行走。
1.1.2文献复习:以“GBS”“吉兰-巴雷综合征”“格林-巴利综合征”“Miller-Fisher综合征”“Bickerstaff脑干脑炎”“脑外伤”为检索词检索中国知网、万方数据库,以“traumatic brain injury”“Guillain-Barré syndrome(GBS)/acute multiple peripheral neuropathy”“acute inflammatory demyelinative polyradiculoneuropathy”“acute motor axonal neuropathy”为关键词检索PubMed数据库,检索时间为2014-01-01—2019-01-01。入组标准:(1)脑外伤后并发GBS的病例报道文献,患者均符合中国GBS诊治指南[1]标准;(2)患者基本资料较详细,诊治较完善,可获取全文;(3)排除头部外伤后未提供头CT/MRI结果及结果未见异常者,除外脑外伤后有明确手术史及其他周围神经病者。
1.2 方法分析本文以及文献报道的脑外伤并发GBS患者的临床资料特点。
2 结果
最终入选9篇文献共报道11例脑外伤并发GBS患者[2-10],结合本文报道的1例共12例患者。
2.1 一般资料12例患者中男11例,女1例,发病年龄为25~71岁,平均53.5岁,发病年龄多集中于45~65岁,脑外伤至GBS发病时间间隔为6~24 d,中位数为12 d,多集中于7~14 d。使用神经节苷脂药物者3例,未使用者7例,2例未提及。有前驱感染/疫苗接种者2例,无前驱感染/疫苗接种者8例,另2例未提及。12例中,AMAN 6例,AIDP 5例,AMSAN 1例。结果见表1。
2.2 主要临床表现以运动障碍为主,主要为四肢无力,呈对称性,合并呼吸困难2例,合并感觉障碍1例。结果见表1。
2.3 实验室检查(1)脑脊液蛋白-细胞分离:9例出现脑脊液蛋白-细胞分离现象,另3例未提供资料。(2)肌电图检查:一般发病后2~4周内完善肌电图检查(部分文献未提及检查时间),11例患者行肌电图检查结果均有异常,表现为波幅或传导速度改变。(3)抗体检测:4例进行血清自身免疫抗体谱检测,其中3例阳性,1例阴性。本例脑脊液抗Sulfatide阳性。结果见表2。
2.4 影像学检查脑外伤类型主要脑挫裂伤6例,脑挫裂伤及出血部位累及额叶6例,颞叶3例,枕叶1例,弥漫性轴索损伤1例,合并创伤性蛛网膜下腔出血6例,硬膜下血肿6例。结果见表2。
2.5 治疗及预后6例患者单用静脉注射人免疫球蛋白(IVIGs)治疗,IVIGs联合糖皮质激素治疗3例,IVIGs联合PE治疗1例,另2例未提供资料。随访10例患者,随访时间1个月~1年,1例无自主呼吸,3例卧床及生活不能自理,2例需辅助行走,4例恢复至可独立行走及生活自理状态。结果见表2。
3 讨论
目前脑外伤后GBS的病因和发病机制尚不完全明确,一般认为与自身免疫相关。国外于1987年由Duncan等[11]首次报道创伤后并发GBS的确诊病例,而国内最早于1994年由王惠娟等[12]报道。近期有关脑外伤并发GBS的病例报道有增多趋势,病情较一般的GBS危重,发病早期不易识别,如未及时诊治预后差。
3.1 病因及发病机制结合本例及11例文献报道,GBS主要与外伤、感染、疫苗接种及使用神经节苷脂药物等相关。研究显示[5]可能引起GBS的因素还可包括手术、神经创伤、营养代谢异常及遗传等。目前已知脑外伤并发GBS的主要可能机制包括:(1)血-脑屏障的破坏是脑外伤并发GBS可能的机制之一。脑外伤后可引起血-脑屏障破坏,引起T淋巴细胞和巨噬细胞聚集,诱导神经胶质细胞发挥递呈抗原作用,激活小胶质细胞充当清道夫细胞,其在清除创伤后神经组织碎片,可能出现某些神经元细胞成分作为抗原而受到免疫攻击。(2)脑外伤作为应激源,引起机体免疫系统破坏[13],使体内的免疫耐受被活化或潜伏感染被激活,从而对自身某些成分产生免疫攻击或通过分子模拟产生交叉抗体而致病[14]。(3)其他机制:CJ感染及使用神经节苷脂药物等也可发生GBS。
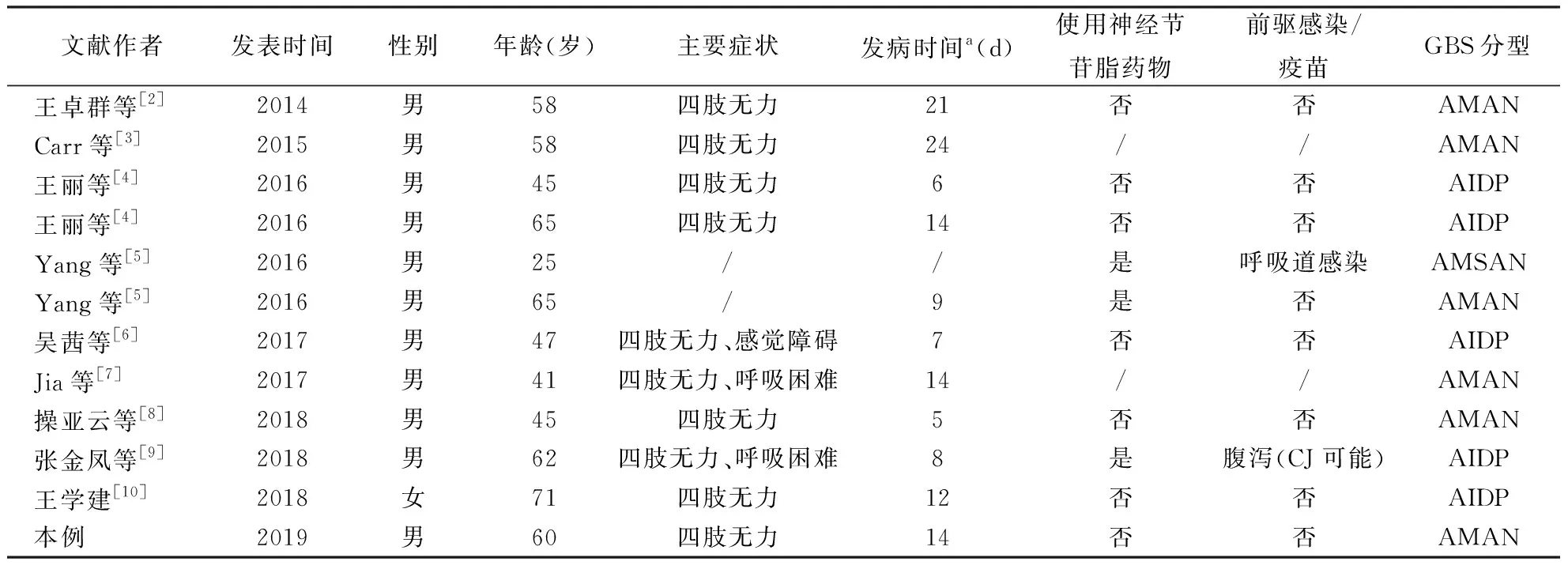
表1 12例脑外伤并发GBS患者临床特点分析
注:GBS:吉兰-巴雷综合征,表2同;AIDP:急性炎症性脱髓鞘性多发性神经根神经病;AMAN:急性运动性轴索神经病;AMSAN:急性运动感觉轴索型;CJ:空肠弯曲菌;/表示文献未提供数据;a表示自脑外伤后至GBS发病的时间间隔
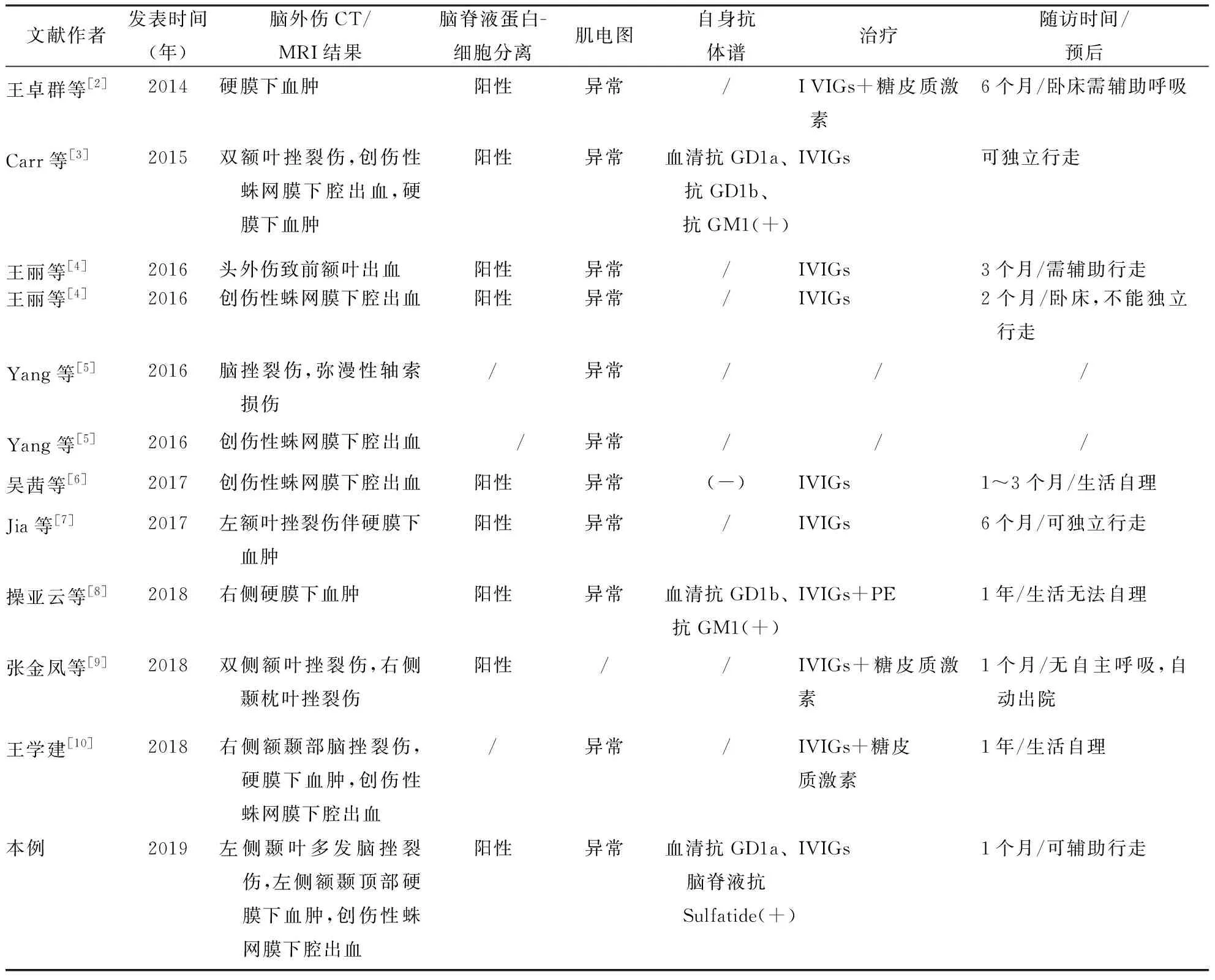
表2 12例脑外伤并发GBS患者实验室、影像学检查以及治疗预后情况
注:IVIGs:静脉注射人免疫球蛋白;PE:血浆置换
3.2 诊断及鉴别诊断本组患者脑外伤后GBS主要首发表现为新发四肢无力,多呈对称性,可伴感觉障碍,年龄多集中于45~65岁,发病时间间隔多在脑外伤后1~2周,单相病程。其诊断主要基于以上临床特点,伴脑脊液蛋白-细胞分离现象[15],肌电图[1]表现为波幅或传导速度异常,血清或CSF自身免疫抗体阳性,结合头颅MRI排除中枢神经系统病变。本例患者在脑外伤后逐渐出现四肢乏力,肌力下降,腱反射消失,行头颅CT及头颈胸腰MRI检查排除存在新发出血或脊髓压迫损伤等情况,且患者无明显感染、手术及使用神经节苷脂药物等诱因,结合CSF、肌电图及自身抗体谱等检查结果,支持脑外伤后并发GBS的诊断。本例患者血清抗GD1a抗体阳性,结合其临床表现及肌电图结果支持AMAN诊断。一般认为抗Sulfatide抗体介导的周围神经病以感觉障碍为主,其可能的原因是抗Sulfatide抗体能与背根神经节结合。也有研究[16]报道抗Sulfatide抗体在其他周围神经病、其他神经系统疾病或健康人中可呈阳性。本例患者CSF抗Sulfatide抗体阳性,无感觉障碍,考虑为假阳性或个体差异可能。
脑外伤并发GBS所致的瘫痪应主要与危重病多发性神经病(CIP)或危重病肌病(CIM)等进行鉴别。在危重病状态下CIM和CIP大多数为伴随发生,统称为危重病相关性多发性神经病和肌病(CIPNM)。CIPNM需与GBS相鉴别,两者共同点为均有四肢瘫痪、肌张力降低、腱反射降低及肌电图改变,但在GBS中CSF蛋白-细胞分离更可能发生,血清及CSF自身免疫抗体检测常呈阳性;而CIPNM发病与危重病本身及治疗密切相关,危重程度与发病率有一定的相关性,是一种获得性疾病,尤其与重症监护病房危重患者出现脓毒症、急性呼吸窘迫综合征或多器官功能衰竭有关。
脑外伤后GBS多数进展速度快,易出现严重的并发症,往往掩盖患者的体征,不能及时做出诊断。常见误诊漏诊原因包括:(1)对创伤相关的GBS认识不足;(2)忽视创伤后新发肢体无力症状;(3)起病隐蔽,病情缓慢进展。
3.3 治疗及预后脑外伤后GBS治疗主要包括血浆置换(PE)、IVIGs、辅助呼吸、康复训练及对症治疗。本文10例使用IVIGs,其中1例联合PE治疗,3例联合糖皮质激素治疗,预后尚可,这与国内外文献报道一致[9,17]。GBS外周神经束膜水肿可引起神经纤维缺血及损伤,而减轻水肿可能成为一种治疗方法[18]。糖皮质激素治疗并不能减轻水肿及缓解GBS症状,目前对该治疗存在争议。脑外伤后GBS预后可通过Hughes功能分级量表、Rankin量表及ODSS评分(the overall disability sum score)来评价临床症状严重程度。
综上所述,脑外伤后并发GBS较为少见,病情危重,当患者出现不能由创伤本身解释的新发肢体无力症状时,应该警惕并发GBS的可能并进行相关检查,尽早明确诊断。

