穴注加贴敷对哮喘大鼠血清IL-10、IL-17和肺组织ICAM-1表达的影响*
耿立梅,闫红倩,于向艳,马璇雯,牛晓艳
(1. 河北省中医院呼吸一科, 石家庄 050011; 2. 石家庄市中医院呼吸科,石家庄 050000;3. 郑州市管城中医院内科,郑州 450000)
哮喘是一种呼吸道慢性炎症性疾病,具有复杂的发病机制。研究证实,ICAM-1、IL-10以及IL-17在哮喘发生发展中发挥了重要作用。ICAM-1参与呼吸道炎症形成的早期阶段,可介导白细胞在呼吸道黏膜的黏附和转移;IL-10在炎症早期可抑制促炎因子、 趋化因子的合成,阻断炎症细胞释放促炎性细胞因子;IL-17是T 细胞诱导的炎症反应的启动因素,对炎症细胞有强大的化学趋化作用。 Treg/Th17细胞及其相关细胞因子IL-10/IL-17比例失衡是哮喘发病的重要基础。中医的贴敷及穴注治疗哮喘的疗效也被研究所证实。本研究旨在探讨穴注加贴敷对哮喘大鼠血清IL-10、IL-17和肺组织ICAM-1表达的影响。
1 材料与方法
1.1 动物与分组
雄性Wistar SPF级大鼠60只,体质量(120±20) g,由河北医科大学实验室提供。将动物按随机数字表法分为正常组(A)、模型组(B)、贴敷组(C)、穴位注射组(D)和贴敷组+穴位注射组(E)各12只。
1.2 主要试剂和仪器
鸡卵蛋白(Sigma),氢氧化铝(分析纯,成都科龙化工试剂厂),IL-10定量酶检测试剂盒(北京普尔伟业生物科技有限公司), IL-17定量酶分析试剂盒(上海森雄科技实业有限公司),免疫组化试剂盒:一抗:兔抗小鼠ICAM-1(北京博安生物科技有限公司),二抗:山羊抗兔 IgG抗体-HRP多聚体(北京中山金桥生物技术),显微图像分析系统HMIAS-2000(武汉同济医科大学),数码显微镜 DP73(Olympus公司),草分枝杆菌 FU36 注射液1.72 μgml(成都金星健康药业有限公司),贴敷(河北省中医院呼吸科)。
1.3 造模方法
在第1天和第8天给予腹腔注射OVA和氢氧化铝悬浮液1 mL[1-2],并给予正常组注射相同量的生理盐水。 在第15天将大鼠置于独立的密封雾化箱中进行雾化,并用2%OVA溶液进行超声雾化。 每天1次用生理盐水替换正常组,每次30 min。 各组大鼠的行为发生了变化。 在雾化组中,有呼吸短促、咳嗽、烦躁、点头,甚至四肢柔软易发,尿失禁和大小便失禁。 挑战持续7 d,然后每周2次。
1.4 实验方法
在成功建模后的第22天开始干预。 穴位大椎、双顶川、双肺、脾、双肾服用。 剃须后,食欲组大鼠剃毛, 发表于6 h; 穴位注射组注射穴位结核,5组穴位轮流取穴,每穴5 μl; 在应用组中应用穴位,然后应用中药6 h,模型组用相同的治疗组治疗。 更换相同量的生理盐水和空贴纸,每隔1 d操作1次,每次治疗3次,共4个疗程。
1.5 标本采集
在实验结束时,将大鼠用10%水合氯醛(0.3 ml / 100 mg)麻醉,以仰卧位固定,并将动脉血从右侧腹股沟取出至血液收集管。 将管放置30 min,以3000 r/min离心并分配血清,收集放入冷冻管中,在-20℃冷冻备用; 将大鼠的胸腔暴露于胸中线,将右肺中叶置于10%甲醛溶液中固定,在-20℃冷冻备用; 将大鼠的胸腔暴露于胸中线,将右肺中叶置于10%甲醛溶液中固定。
1.6 指标检测
1.6.1 HE染色 右肺中叶常规石蜡包埋、切片,常规HE染色。
1.6.2 ELISA检测 酶标仪采用HBS-1096C Pro自动酶标仪(上海珂淮仪器有限公司),IL-10和IL-17的ELISA检测试剂盒分别为北京普尔伟业生物科技有限公司上海森雄科技实业有限公司生产。根据试剂盒说明书严格操作,采用酶联免疫吸附法(ELISA)检测血清IL-10、IL-17水平。
1.6.3 免疫组化检测 严格按照SABC免疫组化试剂盒说明操作:切片常规脱蜡脱水→3%双氧水灭活内源性过氧化物酶→滴加一抗(兔抗鼠 ICAM-1,1∶100稀释)37 ℃孵育4 h→滴加二抗(羊抗兔IgG抗体-HRP多聚体, 1∶200稀释) →37 ℃孵育20 min→滴加SABC 37 ℃孵育20 min→DAB显色,镜下控制反应时间5 min,蒸馏水终止反应→脱水封片→光镜下观察、照相和分析。
根据盲法原则,采用日本OLYMPUS公司的AX-70显微成像系统进行观察分析及照相,每只大鼠取6张切片,每张切片随机取2个视野照相。采用Image-Pro Plus 6.0图像分析系统,测定ICAM表达的平均光密度值(IOD)。
1.7 统计学方法

2 结果
2.1 肺组织HE染色
图1显示,气管周围及肺组织内的中性粒细胞、单核细胞、淋巴细胞等炎性细胞HE染色后呈蓝色。对照组:细支气管上皮完整,形态规则,支气管壁不增生,肺泡形态规则,肺泡壁规则;模型组:气管和肺组织周围有大量炎性细胞浸润,支气管狭窄,上皮细胞分离,黏膜水肿,肺泡腔明显变小;穴位组:与模型组比较,炎症细胞浸润减少,支气管形态略微缩小,肺泡形态不规则;贴片组:与模型组比较,细支气管形态较正常,腔内无明显上皮细胞脱落,壁内炎症细胞,肺泡形态不完善;穴位注射+贴片组:细支气管形态规则,管周围可见小炎症细胞,黏膜正常,肺泡腔形态较规则,个别肺泡壁增厚,炎症细胞增多。
2.2 各组血清IL-10、IL-17和IgE含量比较
表1显示,血清IL-10、IL-17和IgE含量统计学比较显示,模型组大鼠IL-17、IgE高于正常组,IL-10低于正常组,差异显著(P<0.05);3个治疗组的IL-17和IgE均低于模型组,IL-10高于模型组,差异有统计学意义(P<0.05)。 IL-17含量:应用组+注射组低于应用组和注射组, 差异有统计学意义(P<0.05); 穴位组与斑块组之间比较差异无统计学意义(P> 0.05)。 IgE含量:贴剂+穴位注射组的应用低于穴位注射组和应用组(P<0.05)。 穴位注射组与放置组之间比较差异无统计学意义(P> 0.05)。 IL-10含量:贴剂+穴位组高于贴剂组和空穴注射组,差异有统计学意义(P<0.05),穴位组与贴剂组比较差异无统计学意义(P> 0.05)。
2.3 各组大鼠肺组织ICAM-1的表达比较
表1图2显示,在正常组支气管周围观察到少量棕黄色阳性细胞, 模型组在支气管和支气管分泌物以及间质和肺泡棕黄色颗粒周围具有更多表达。 ICAM-1的平均光密度高于正常组,差异有统计学意义(P<0.05)。 应用组和穴位组中的棕黄色颗粒小于模型组。 ICAM-1的表达水平低于模型组,差异有统计学意义(P<0.05)。 斑块+穴位组中棕黄色阳性细胞表达不明显。 与注射组比较,ICAM-1的平均光密度低,差异有统计学意义(P<0.05)。 穴位组和贴剂组之间比较差异无统计学意义(P> 0.05)。
3 讨论
支气管哮喘(下称哮喘)是一种呼吸道慢性炎症性疾病,其病理生理学机制包括炎症细胞、炎症介质与呼吸道组织和细胞间的复杂相互作用,导致急性支气管痉挛,呼吸道壁水肿,黏液分泌增加和呼吸道重构,从而引起呼吸道阻塞。此外,炎症还可以引起呼吸道反应性增高。近年来的研究发现,支气管哮喘的发病机制主要与免疫反应有关,其中,呼吸道炎症是哮喘发病的主要原因之一。本实验中,模型组血清IL-10含量明显低于对照组,表明在哮喘的炎症阶段IL-10的含量减低。IL-10是一类强大的免疫抑制因子,主要由CD4+CD25+ Tregs 细胞合成分泌。此外,TH2、TH1淋巴细胞、单核细胞、巨噬细胞也都是其来源[3]。IL-10可抑制促炎因子、趋化因子的合成以及与受体的结合,并且阻断炎症细胞释放促炎症细胞因子[4]。缺乏IL-10可能是哮喘的重要原因。 通常认为,Th1 / Th2细胞因子的比例是不平衡的,并且TH2细胞因子的优势是哮喘的免疫学基础。 最近的研究发现,Treg / Th17细胞及其相关细胞因子IL-10 / IL-17的失衡也是哮喘发病机制的重要病理生理基础[5]。
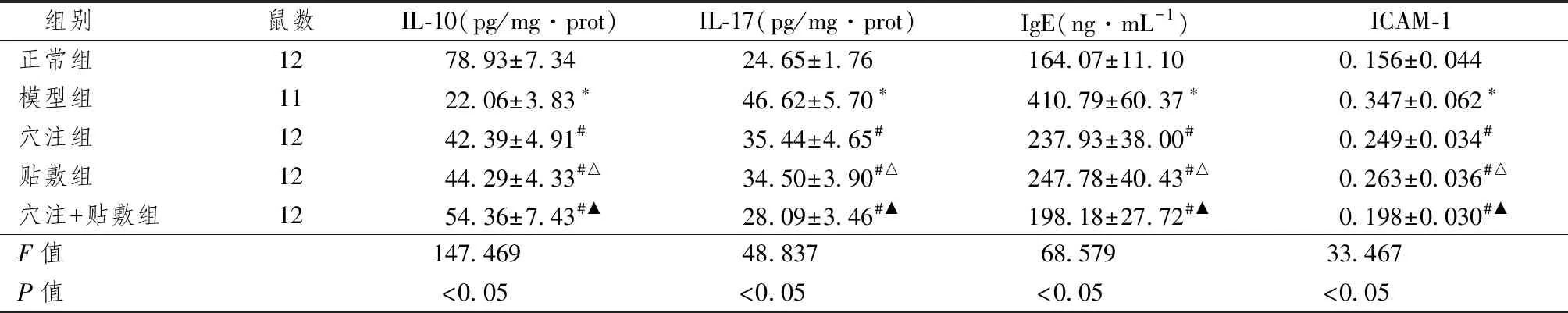
表1 各组血清IL-10、IL-17、IgE含量及ICAM-1在肺组织中IOD值表达比较
注: 与模型组比较:*P<0.05; 与穴注组比较:#P<0.05;与贴敷组、穴注组比较:△P<0.05; 与贴敷组、穴注组比较:▲P<0.05

图1 各组大鼠肺组织HE染色比较
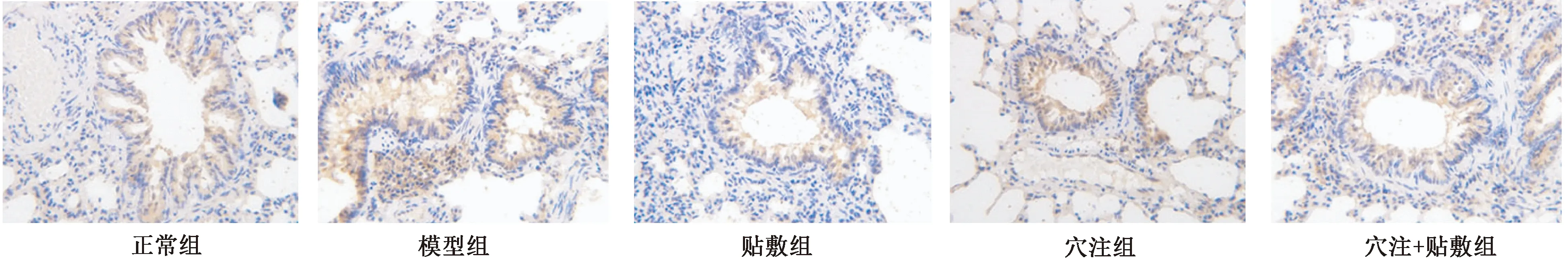
图2 各组大鼠肺组织ICAM-1表达比较(免疫组化分析)
本研究结果显示,模型组大鼠血清IL-17明显高于正常组,差异有统计学意义。这与文献关于IL-17具有促炎作用的研究相符合,提示IL-17对哮喘炎症反应的促进作用。有研究显示,IL-17水平可以作为评估严重支气管哮喘的独立危险因素[6]。哮喘大鼠气道的高反应性依赖于TH17细胞应答及中性粒细胞浸润,表明TH17细胞及其细胞因子IL-17是促进哮喘加重的关键因素[7]。实验中的模型组大鼠血清IL-17含量明显高于正常组,而IL-10低于正常组,经穴位贴敷组、穴位注射组、穴位注射+贴敷组治疗后大鼠的血清IL-17含量较模型组降低,IL-10含量较模型组升高。同时HE染色显示,血管周围有少量炎症细胞,支气管形态规则,黏膜正常,肺泡腔形态规则。 上述结论进一步表明,Treg细胞和TH17细胞之间的失衡是哮喘的重要原因[8],Treg细胞分泌IL-10减少,可导致免疫细胞失衡而发生哮喘,而IL-10与IL-17的表达失衡,从某种方面也反映了Treg/TH17的失衡状态。
该研究中的另一个指标是细胞间黏附分子-1(ICAM-1),在从血管到炎症部位的白细胞如嗜酸性粒细胞、中性粒细胞、淋巴细胞等积累中起关键作用[9]。 ICAM-1主要在白细胞、血管内皮细胞、成纤维细胞、上皮细胞和肺组织中表达。当哮喘发生时,ICAM-1可以介导和促进上述细胞的黏附[10]。有研究表明,ICAM-1与哮喘的呼吸道炎症有密切联系,使用抗ICAM-1单抗能够改善哮喘动物模型呼吸道的炎症细胞浸润[11]。也有研究推断[12], ICAM-1能够协同炎性因子加快嗜酸粒细胞等炎症细胞向气道浸润,ICAM-1对于气道炎症程度的影响很大。模型组大鼠肺组织免疫组化的平均积分光密度(OD)值明显高于正常对照组,表明在哮喘大鼠的炎症阶段,ICAM-1的表达增强,减少ICAM-1的表达,可以减少气道炎症从而控制哮喘。
传统医学的内病外治常配合穴位敷贴来完成。 穴位敷贴对于药物有放大和增敏作用[13]。贴敷药物由白芥子、延胡索、甘遂、细辛、百部、五味子、前胡、麻黄组成。上述药研磨过筛,加用姜汁、香油调制,选用辛香走窜之品,具有辛温散寒平喘之功,配以行气化痰、敛肺平喘药物,达到祛痰镇咳平喘的作用。加之对以上穴位的刺激,肺、脾、肾三脏同调,达到宣肺理气、健脾化痰、培元固本的作用。此外,草分枝杆菌是一种灭活的非病原性细菌[14],能够促进外周血单个核细胞产生γ-IFN、IL-4,促进TH细胞成熟,上调TH1细胞功能,从而调节Th1 /Th2的平衡,起到防治哮喘的作用[15]。并且能够提高机体IgG、IgM的水平,从而调整T细胞亚群的含量,发挥提高免疫功能的作用[16]。本实验将草分枝杆菌作为穴位注射药物注射于哮喘大鼠模型,为草分枝杆菌的应用寻找新的注射方法,也是寻找哮喘防治更有效的手段。穴位敷贴组、穴位注射组、穴位注射+黏连组ICAM-1的表达均低于模型组,表明3种方法均有效。 穴位组和斑块组之间比较差异无统计学意义,穴位暴露组ICAM-1表达低于其他组。 结果表明,3种方法均可通过降低肺组织ICAM-1的表达,抑制炎症细胞的积聚,减轻哮喘的症状。 应用效果与穴位注射相似,穴位注射联合应用效果更好。
综上所述,穴位注射联合贴敷可提高哮喘大鼠血清IL-10含量,降低IL-17、IgE水平及ICAM-1的表达。

