大黄素抑制胰腺癌新生血管形成的机制研究
陈敏远 郑晨果 刘长宝 王兆洪
大黄素是一种葱醒类物质,能抑制多种恶性肿瘤细胞生长并诱导凋亡[1-3]。最近研究发现,大黄素也能通过抑制肿瘤新生血管形成,从而抑制肿瘤生长[4]。本实验在裸鼠原位移植瘤模型基础上研究大黄素抑制胰腺癌新生血管生成的机制,并探讨微小RNA(microRNA)在大黄素抑制胰腺癌新生血管形成中的作用。
1 材料与方法
1.1 药物和试剂 大黄素(纯度>98%,美国Sigma公司,批号E7881),用二甲基亚砜(DMSO)溶解,DMSO 的终浓度<0.1%;内皮细胞标记物CD31、CD34,血管内皮生长因子(VEGF)单克隆抗体(美国Santa Cruz 公司,批号CD1-H5224、CD4-H5255、Santa023);Trizol (美 国Invitrogen 公 司, 批 号12183555);Takara One Step PrimeScript microRNA cDNA Synthesis Kit 和Takara SYBR Premix Ex Taq TM II(日本Takara 公司,批号D350A、DRR041A);荧光定量PCR(qRT-PCR)反应所需引物由上海基康生物有限公司合成。
1.2 细胞系和动物 人胰腺癌细胞株SW1990(美国组织培养库ATCC);雌性BALB/c 裸鼠(中国科学院上海动物实验中心)40 只,4~6 周龄,体质量20~22g,实验动物使用许可证号:SYXK(浙)2015-0009。饲养于无特定病原体动物级(SPF 级)屏障系统的洁净层流架内,室温控制在(25±1)℃,相对湿度40%~60%。本实验经温州医科大学实验动物中心动物实验伦理审核通过(批准编号:wydw2019-0012)。
1.3 动物模型制备 (1)皮下移植瘤制备:取对数生长期的SW1990 细胞约2×106注射于裸鼠皮下,1 个月后生长成约1cm3皮下移植瘤,无菌条件下处死裸鼠取出肿瘤组织,选取健康肿瘤组织剪成1mm3的组织块待用。(2)胰腺癌裸鼠原位移植瘤制备:50mg/kg戊巴比妥钠腹腔注射麻醉裸鼠,取左上腹腹直肌旁切口,暴露胰尾并打开胰腺被膜,将瘤块置入胰尾后缝合被膜。
1.4 分组和给药 将40 只BALB/c 裸鼠用随机数字表法分为对照组和大黄素低、中、高剂量组(20、40、80mg/kg)[5],每组10 只。手术后第3 周开始给药,对照组给予DMSO 终浓度<0.1%的生理盐水,腹腔注射;大黄素低剂量组给予20mg/kg 大黄素,腹腔注射;大黄素中剂量组给予40mg/kg 大黄素,腹腔注射;大黄素高剂量组给予80mg/kg 大黄素,腹腔注射;各组均每周治疗3 次,共治疗2 周[5]。末次用药1 周后予用戊巴比妥麻醉裸鼠,取部分肿瘤组织4%多聚甲醛固定,待免疫组织化学染色;另一部分肿瘤组织存于液氮中,待Western blot 和qRT-PCR 检测。
1.5 免疫组化法检测各组原位移植瘤微血管密度(MVD) 取固定好的肿瘤组织,经脱蜡、水化、3%H2O2封闭以及高压热抗原修复后,加入兔血清封闭,CD31/CD34 一抗体4℃孵育过夜,PBS 洗涤后滴加辣根过氧化物酶(HRP)标记的二抗室温孵育30min,DAB 显色3~5min,苏木素复染后树脂封片镜检。低倍镜(100×)下寻取血管热点区域,然后高倍镜(400×) 下随机选择5 个视野,计数每个视野中CD31/CD34 阳性细胞数,其平均值即为微血管密度[6]。
1.6 Western blot 法检测各组原位移植瘤VEGF 蛋白表达 取新鲜肿瘤组织,RIPA 裂解液裂解组织,提取上清,BCA 方法定量蛋白浓度。12%SDS-聚丙烯酰氨凝胶电泳,半干转膜法转膜,含5%无脂牛奶TBST 封闭,滴加VEGF 一抗4℃孵育过夜,HRP 标记的二抗孵育2h,用ECL 发光液显色。GAPDH 为内参。
1.7 qRT-PCR 法测定各组miR-20b,miR-21,miR-155,miR-210 表达 按照Trizol 试剂盒使用说明书从肿瘤组织提取总RNA,并计算RNA 纯度和浓度。选取OD260/OD280 比值在1.8~2.0 之间的RNA 进行后续试验。依据Takara One Step PrimeScript microRNA cDNA Synthesis Kit(Perfect Real Time)试剂盒说明书配制反应液,将microRNA 逆转录(即RT 反应)为cDNA。依据Takara SYBR Premix Ex Taq TM II(Perfect Real Time)试剂盒说明书配置反应液,加入miR 引物序列与Uni-miR qPCR Primer,将PCR 反应管离心机轻轻离心后放入LightCycler 480 Real Time PCR 扩增仪中进行Real Time PCR反应。Uni-miR qPCR Primer 为宝生物公司通用引物。内参U6 引物由宝生物公司提供。其余反应所需引物由宝生物公司与上海基康生物有限公司合成。用于qRT-PCR 的引物序列如下:miR-20b 5′ -CAAA GUGCUCAUAGUGCAGGUAG-3′;miR-21 5′-UAGC UUAUCAGACUGAUGUUGA-3′;miR-155 5′-UUAA UGCUAAUCGUGAUAGGGGU-3′;miR-210 5′-AGC UACAUUGUCUGCUGGGUUUC-3′。
1.8 统计学方法 应用SPSS 19.0 统计软件。计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 免疫组化检测MVD 与对照组比较,大黄素低、中、高剂量组MVD 均降低(P 均<0.05);与低剂量组比较,中、高剂量组MVD 明显降低(P 均<0.05);中、高剂量组间MVD 比较,差异无统计学意义(P>0.05)。见表1。
2.2 Western blot 检测VEGF 表达 与对照组比较,大黄素低、中、高剂量组VEGF 蛋白表达量均下调(P均<0.05);与低剂量组比较,中、高剂量组VEGF 蛋白表达量明显下调(P 均<0.05),且高剂量组较中剂量组下调更明显(P<0.05),见图1,表2。
表1 按CD31/CD34 计算微血管密度
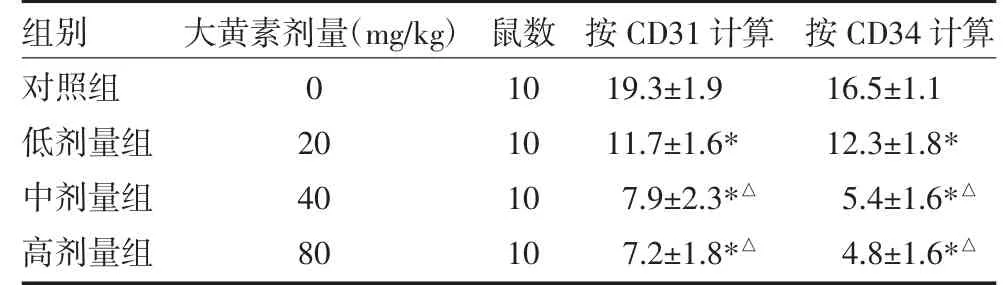
表1 按CD31/CD34 计算微血管密度
注:与对照组比较,*P<0.05;与低剂量组比较,△P<0.05;MVD:微血管密度;对照组:生理盐水腹腔注射;低剂量组:20mg/kg 大黄素腹腔注射;中剂量组:40mg/kg 大黄素腹腔注射;高剂量组:80mg/kg 大黄素腹腔注射;CD:白细胞分化抗原
组别对照组低剂量组中剂量组高剂量组大黄素剂量(mg/kg)0 20 40 80鼠数10 10 10 10按CD31 计算19.3±1.9 11.7±1.6*7.9±2.3*△7.2±1.8*△按CD34 计算16.5±1.1 12.3±1.8*5.4±1.6*△4.8±1.6*△
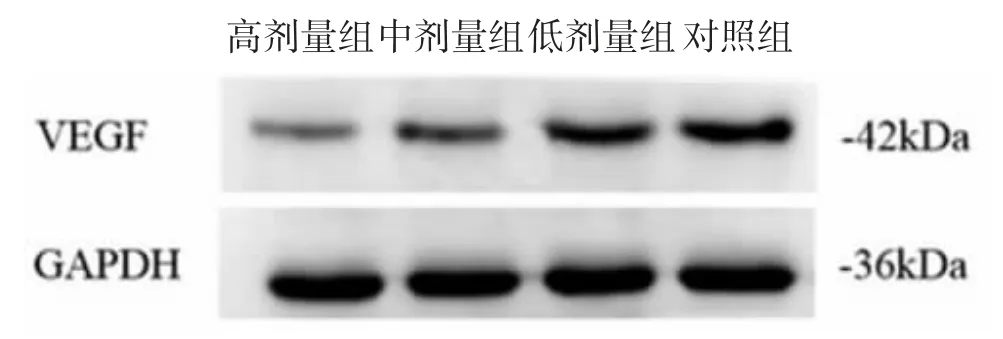
图1 大黄素对VEGF 蛋白表达的影响
表2 大黄素对VEGF 蛋白表达的影响(差异倍数)
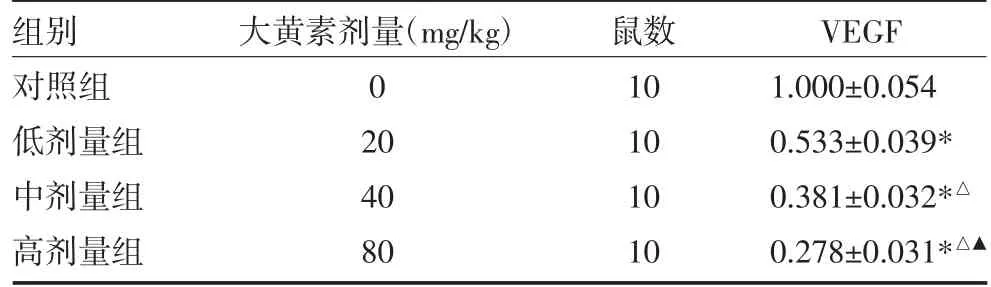
表2 大黄素对VEGF 蛋白表达的影响(差异倍数)
注:与对照组比较,*P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,▲P<0.05;对照组:生理盐水腹腔注射;低剂量组:20mg/kg 大黄素腹腔注射;中剂量组:40mg/kg 大黄素腹腔注射;高剂量组:80mg/kg 大黄素腹腔注射;VEGF:血管内皮生长因子
组别对照组低剂量组中剂量组高剂量组大黄素剂量(mg/kg)0 20 40 80鼠数10 10 10 10 VEGF 1.000±0.054 0.533±0.039*0.381±0.032*△0.278±0.031*△▲
2.3 qRT-PCR 法检测microRNA 表达 与对照组比较,大黄素组低、中、高剂量miR-20b、miR-21、miR-155 及miR-210 表达水平均降低(P 均<0.05);与低剂量组比较,中、高剂量组miR-20b、miR-21、miR-210 及高剂量组miR-155 表达水平降低(P 均<0.05),且高剂量组miR-20b、miR-21、miR-155 及miR-210 表达较中剂量组降低更明显(P 均<0.05),见表3。
3 讨 论
新生血管的生成对于肿瘤的生长是不可或缺的[6]。肿瘤依靠来自病灶周围原有的血管提供的营养物质生长,随着肿瘤体积慢慢变大至约1~2mm3时,原有的血管提供的营养物质相对不足,刺激肿瘤细胞分泌各种促进新生血管产生的细胞因子。而肿瘤内部新血管网络的形成,突破了肿瘤继续生长的瓶颈。研究表明,大黄素在体内外可抑制恶性肿瘤的生长、转移,但大黄素对肿瘤新生血管的研究却鲜有报道[1-3]。肿瘤的血管密度可以作为预测患者病情发展的指标,与肿瘤通过血管的远处转移亦密切相关;免疫组化显示的MVD 和肿瘤侵袭转移的潜力正相关[7]。本研究结果显示,大黄素各剂量组MVD 较对照组明显降低(P<0.05)。这一结果与之前的文献报道相一致,因此我们推断,大黄素可能通过抑制肿瘤血管新生而抑制肿瘤的生长、发展[4]。
表3 大黄素对microRNA 表达的影响(差异倍数)
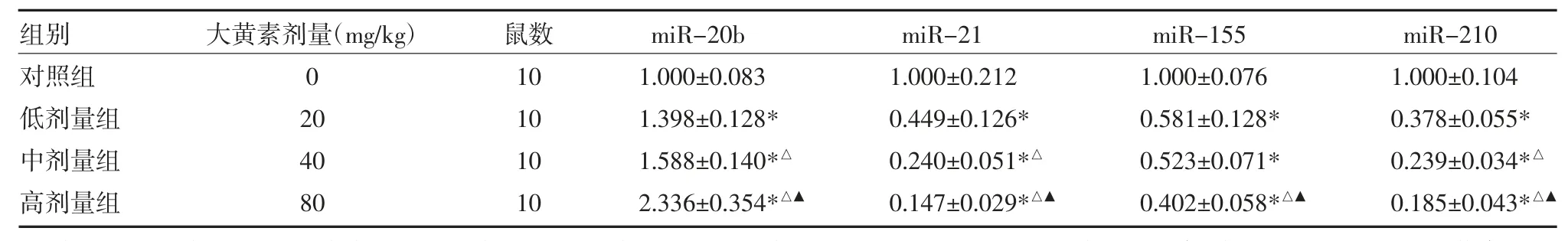
表3 大黄素对microRNA 表达的影响(差异倍数)
注:与对照组比较,*P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,▲P<0.05;对照组:生理盐水腹腔注射;低剂量组:20mg/kg 大黄素腹腔注射;中剂量组:40mg/kg 大黄素腹腔注射;高剂量组:80mg/kg 大黄素腹腔注射;micro RNA:微小RNA
组别对照组低剂量组中剂量组高剂量组大黄素剂量(mg/kg)0 20 40 80鼠数10 10 10 10 miR-20b 1.000±0.083 1.398±0.128*1.588±0.140*△2.336±0.354*△▲miR-21 1.000±0.212 0.449±0.126*0.240±0.051*△0.147±0.029*△▲miR-155 1.000±0.076 0.581±0.128*0.523±0.071*0.402±0.058*△▲miR-210 1.000±0.104 0.378±0.055*0.239±0.034*△0.185±0.043*△▲
VEGF 是主要的促新生血管因子,它使毛细血管的通透性改变,以纤维蛋白原为主的血浆蛋白到达血管外,为形成新的毛细血管结构提供土壤,而这些毛细血管网最终能为肿瘤细胞的生长带来丰富的养分;VEGF 的另一个功能是与细胞表面的血管内皮生长因子受体结合,通过后续的细胞信号转导,刺激血管内皮细胞分裂增加,数量增多,从而促进血管的新生[8]。本研究结果显示,VEGF 在对照组中高表达,在大黄素组均低表达,且与大黄素浓度相关。这说明大黄素可能通过抑制VEGF 的表达,使VEGF 与其受体的结合减少,从而降低其促血管生成的作用。
有研究表明,miR-21 使VEGF 和激活蛋白1(AP1)mRNA 和蛋白的表达增加[9]。miR-21 还可通过负性调节RECK 和TIMP3 等金属蛋白酶(MMPs)抑制剂,导致金属蛋白酶活化后致使肿瘤侵袭能力增强。Park 等[10]发现抑制miR-21 或miR-221 的表达与耐药有关。在含氧量正常的细胞中,抑制miR-20b 导致缺氧诱导因子1α(HIF-1α)和VEGF 的表达增多,而在缺氧的肿瘤细胞中,miR-20b 增多则使HIF-1α和VEGF 的表达减少[11]。miR-155、miR-210 作为癌基因存在于胰腺癌,具有抗肿瘤凋亡和促进肿瘤细胞的血管新生等作用[12]。miR-210 被证明在肿瘤细胞中与VEGF 同步过表达,并上调血管内皮生长因子受体2(VEGF-R2)和ephrinA3,从而显著促进缺血区毛细血管新生。而miR-155 也被报道与Smad 有重要关系[13]。本研究发现,大黄素可促进miR-20b 的表达,显著抑制miR-21、miR-155、miR-210 的表达,且与大黄素浓度呈相关性。大黄素可能通过抑制相关的microRNA 而抑制肿瘤新生血管的形成,进而抑制胰腺癌原位移植瘤的生长。

