黄尾鲴形态特征及其同工酶电泳分析
张涛,张林,周剑光,甘金华,陈建武,何力
(农业农村部水产品质量安全风险评估实验室(武汉),农业农村部淡水鱼类种质监督检验测试中心,中国水产科学研究院长江水产研究所,武汉 430223)
黄尾鲴(Xenocyprisdavidi)隶属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鯝亚科(Xenocyprininae)、鯝属(Xenocypris),俗称黄尾、黄片、黄姑子、黄瓜鱼或黄板刁等,在中国长江、珠江、闽江以及黄河水系均有分布,为中国特有种[1]。黄尾鲴为底栖中小型鱼类,通常生活在江河、湖泊和水库等天然水域的中下层,以藻类、腐殖质、有机碎屑以及植物碎片为饵料,兼食浮游动物和底栖动物[2],具有食性杂、生长快、抗逆性强、肉质细嫩、营养价值高、可自然繁殖和容易捕捞等特点。黄尾鲴自20世纪50年代引入池塘驯养,至60年代初人工繁殖成功[1]。由于黄尾鲴个体繁殖力较强[3],且集群生活,在湖泊、水库中均能形成自然种群,具有较高的群体生产力。此外,黄尾鲴可通过其下颌角质边缘刮取藻类、腐殖质、有机碎屑等作为食物,可起到净化水质、减缓水体富营养化进而改善水生态环境的作用,是天然水域增殖品种之一。由于黄尾鲴饵料成本低廉,在水体中不与肉食性和植食性鱼类争食,又使其成为良好的套养品种之一。
目前,有关黄尾鲴的报道主要集中在养殖技术[4-5]、生物学特性[3, 6-8]、营养学特性[9]、发育生物学[10-11]、分子遗传学特性[1,8,12-13]及渔业资源评估[14]等方面,有关黄尾鲴形态特征[4-5,8,15]方面的研究仅见零星报道,缺乏系统性。有关生化遗传特性方面的研究[16-19]主要针对于野生群体,关于养殖群体的报道相对较少,且不同研究者研究结果间存在差异。形态特征和生化遗传参数是制定种质标准时常采用的指标。已有研究表明:即使形态特征相近、分类上仍属同一个种的不同地理种群,在同工酶水平上也存在一定差异[20]。所以,在鉴定生物物种时,除了从形态特征层面着手外,有必要探讨其在同工酶水平上是否存有差异。本研究通过形态学观察、可数可量性状测定,并结合聚丙烯酰胺凝胶电泳技术检测不同组织中的乳酸脱氢酶(LDH)以及苹果酸脱氢酶(MDH)表达情况,同时筛选出黄尾鲴种质的特征生化遗传参数,并与已有研究结果进行比较分析,旨在从形态特征和生化遗传角度进一步丰富黄尾鲴种质资源方面的研究内容,为其种质鉴定标准的制定提供理论依据。
1 材料与方法
1.1 实验材料
实验用黄尾鲴于2018年11月采自湖北省随州市,为人工养殖群体,总共74尾,体重范围为210.8~615.8 g,均值为(390.4±82.4) g;体长范围为24.0~32.0 cm,均值为(28.8±1.7) cm。
1.2 实验方法
1.2.1 形态测定
按照养殖鱼类种质检验性状测定标准GB/T 18654.3—2008[21]的规定,对30尾样本进行形态观察,并对可数可量性状进行测定。可数性状计数参数包括背鳍鳍条数、臀鳍鳍条数、侧线鳞数、侧线上鳞数、侧线下鳞数、脊椎骨数以及左侧第一鳃弓外侧鳃耙数。可量性状测量参数包括全长、体长、体高、头长、吻长、眼径、眼间距、尾柄长和尾柄高。全长及体长参数用直尺测量,其他参数用游标卡尺进行测量,并计算可量性状的比例值。
1.2.2 组织酶液的制备、电泳及染色方法
LDH所用凝胶为不连续浓度胶,浓缩胶、分离胶浓度分别为7.5%、4%,MDH所用凝胶浓度为9%连续浓度胶,组织酶液的制备、电泳及染色参照张涛等[22]的方法。
1.2.3 模式图的绘制
采用Bandscan 5.0(Glyko, 美国)电泳图谱中的酶带进行灰度识别,并根据识别灰度绘制电泳图谱模式图。
1.2.4 酶的命名与分析
同工酶的命名和分析参考熊全沫[23]的方法,以各酶带的相对迁移率(Rf)从小到大依次命名并顺序编号。
1.3 数据处理
所得可量性状数据采用SPSS 20.0(IBM公司,美国)进行分析,结果以(平均值±标准差)表示。
2 结果与分析
2.1 形态描述及可数、可量性状
观测74尾黄尾鲴形态(图1),发现其体呈纺锤形,侧扁,腹部圆。头小,较尖,近圆锥形。口下位,下颌有较发达的角质边缘。侧线完全,在腹鳍附近向下弯曲呈弧形,向后延伸至尾柄正中。背鳍有硬刺,表面光滑,起点在腹鳍起点稍前上方。胸鳍不发达,远不及腹鳍起点。腹鳍、臀鳍较短小。尾鳍分叉,上下叶几乎等长。肛门靠近臀鳍。在肛门前有一小段腹棱,其长不超过肛门与腹鳍基部间距的1/4。背部呈黑色或青灰色,胸鳍和腹鳍呈淡黄色,体侧下半部及腹部呈银白色,鳃盖骨后缘有一浅黄色斑块,背鳍末端呈黄色,尾鳍呈橘黄色。

图1 黄尾鲴外观形态Fig.1 Morphological observation of Xenocypris davidi
黄尾鲴鳔2室,前室短,后室长。下咽齿齿式2·4·6/6·4·2。脊椎骨数为36~41。左侧第一鳃弓外侧鳃耙数为44~52。腹膜呈黑色。黄尾鲴可数、可量性状见表1,表中范围给出了所测各指标的上下限,均值反映了所测数据的集中程度。可数性状中,背鳍条数稳定,侧线鳞数较多,变化范围也较大。可量性状中,主要以体长和头长为参照,给出了吻长、眼径和眼间距等头部主要参数与头长的比例关系,也反映了体高、尾柄长和尾柄高等躯干部主要参数与体长的比例关系。
2.2 LDH的表达
黄尾鲴5种组织中的LDH同工酶表达结果如图2所示。由图2可见,心脏组织中共检测到6条酶带(图2A),其中LDH1、LDH2、LDH4和LDH5表达活性较强,LDH3表达活性最弱;眼睛晶状体组织中共检测到6条酶带(图2B),LDH2、LDH4和LDH5表达活性较强,LDH6表达活性最弱;肌肉组织中共检测到4条LDH酶带(图2C),其中1~2号样本检测到3条酶带,而其余3尾样本均多出1条酶带即LDH1,且LDH1在3号样本中的表达活性弱于其他两个样本,LDH2~LDH4在各样本中的酶谱相同,表达活性一致;肝脏组织中共检测到7条酶带(图2D),LDH2、LDH3、LDH5~LDH7表达活性均较强,LDH1表达活性最弱;肾脏中检测到的酶带数最多,共有8条(图2E),LDH1仅在3~5号样本中检出,LDH2和LDH3在1号样本中未检出,LDH4~LDH8为5尾样本鱼的
共有酶带,其中,LDH4和LDH5表达活性相对较弱,其余3条共有酶带表达活性相对较强。综上,除肌肉和肾脏组织外,5尾样本鱼其余3种组织酶谱相同,表达活性一致。LDH在黄尾鲴不同组织中均有表达,但是表达的酶谱和活性不同,呈现出明显的组织特异性。
表1 黄尾鲴的可数性状和可量性状的均值与标准偏差
Tab.1 The mean values and standard deviation of countable and measurable parameters ofXenocyprisdavidi

特征Trait指标Item范围Scale均值Average可数性状背鳍条数7 7.00±0.00Countabletrait臀鳍条数 9~11 9.84±0.60侧线鳞数60~6864.99±1.72侧线上鳞数10~1210.69±0.74侧线下鳞数5~6 5.81±0.39脊椎骨数36~4138.28±1.38左侧第一鳃弓外侧鳃耙数44~5248.76±1.81可量性状全长/体长1.16~1.26 1.21±0.02Measurabletrait体长/体高3.55~4.033.77±0.12体长/头长4.80~5.855.41±0.17体长/尾柄长5.84~9.806.68±0.58体长/尾柄高8.55~10.399.39±0.38头长/吻长3.63~4.443.94±0.18头长/眼径3.47~4.223.87±0.17头长/眼间距1.93~3.712.19±0.20尾柄长/尾柄高0.99~1.671.41±0.12

图2 黄尾鲴LDH电泳图谱A、B、C、D、E分别表示心脏、眼睛晶状体、肌肉、肝脏和肾脏的LDH酶谱;1~5泳道分别表示不同个体的酶谱。Fig.2 Electrophoretogram of LDH isozymes in Xenocypris davidiA, B, C, D, E show electrophoretograms of LDH isozymes expressed in heart, eye, muscle, liver and kidney respectively.1-5 show the zymograms of different individuals.
2.3 MDH的表达
黄尾鲴的MDH同工酶的表达如图3所示,线粒体型MDH(m-MDH)仅在心脏和肌肉组织中有表达,其余3种组织中仅检测到上清液型MDH(s-MDH)。心脏组织中共检测到7条MDH酶带(图3A),s-MDH1~s-MDH3仅在1号样本中有检出,s-MDH4~m-MDH7在5尾样本中均有检出,其中,m-MDH7在1号样本中的表达活性最高,而s-MDH4~s-MDH6在1号样本中的表达活性均弱于其他样本。眼睛晶状体组织MDH酶带表达见图3B,除1号样本未检测到MDH表达外,其余4尾样本中均检测到3条s-MDH酶带,其中s-MDH1表达活性高于s-MDH2和s-MDH3。肌肉组织中共检测到4条MDH酶带(图3C),除1号和2号样本中检测到3条上清液型s-MDH酶带和1条线粒体型m-MDH4酶带外,其他样本中只检测到3条上清液型s-MDH酶带;s-MDH3在1号和2号样本肌肉中表达活性高于其他3个样本,s-MDH1和s-MDH2在5尾样本肌肉中的表达活性基本相同。肝脏组织中共检测到4条s-MDH酶带(图3D),除1号样本未检测到s-MDH2外,其余4尾样本均有s-MDH2检出,s-MDH1和s-MDH3在1号样本中的表达活性程度均比其余4尾样本弱。肾脏组织中检测到3条MDH酶带(图3E),除s-MDH1在1号样本中未检测到外,其余样本酶谱相同,表达活性相似。因此,推断黄尾鲴MDH表达的酶谱和活性既有个体差异性也有组织特异性。

图3 黄尾鲴MDH电泳图谱A、B、C、D、E分别表示心脏、眼睛晶状体、肌肉、肝脏和肾脏MDH酶谱;1~5泳道分别表示不同个体的酶谱。Fig.3 Electrophoretogram of MDH isozymes in Xenocypris davidiA, B, C, D, E show electrophoretograms of MDH isozymes expressed in heart, eye, muscle, liver and kidney respectively.1-5 show the zymograms of different individuals.
2.4 黄尾鲴特征生化遗传参数
本研究中5尾样本鱼肌肉和肾脏中LDH酶带均有多态,心脏和肝脏中LDH酶带分离效果并不理想,而所有样本鱼眼睛晶状体组织中LDH不仅酶带数和表达活性程度相同,且分离效果好,酶带清晰,初步确定以眼睛晶状体LDH作为从生化遗传特征层面鉴定黄尾鲴种质的备选对象。再随机选取5尾样本鱼的眼睛晶状体进一步电泳以验证眼睛LDH酶带表达情况,5尾样本鱼眼睛LDH同工酶图谱显示全部为单态(图4)。因此,本研究采用眼睛晶状体组织的LDH作为鉴定黄尾鲴种质的特征生化遗传参数。

图4 黄尾鲴眼睛晶状体组织LDH电泳图谱1~5泳道分别表示不同个体的酶谱。Fig.4 Electrophoretogram of LDH isozymes expressed in eyes of Xenocypris davidi1-5 show the zymograms of different individuals.
3 讨论
3.1 黄尾鲴的形态学比较
本研究中黄尾鲴的形态特征与其他已有研究结果基本一致,本研究观察到黄尾鲴的胸鳍和腹鳍呈淡黄色,不同于彭良宇[4]和《中国鲤科鱼类志》[24]中的观测结果,分析认为造成这种观察差异的原因可能主要是与养殖环境的差异有关,这种现象在其他鱼类中亦有类似的报道[25],当然也不排除观察者主观判断因素造成的差异。在可数性状方面,本研究结果与罗泉笙[15]和《中国鲤科鱼类志》[24]的报道相一致,不同于谢立华[8]的研究结果,分析认为造成这一差异的原因除了与样本量大小有关外,还可能与观察者的主观认识有关。在可量性状方面,本研究中除少数性状比例如体长/头长、头长/吻长等参数与罗泉笙[15]和《中国鲤科鱼类志》[24]报道稍有差异外,其他性状比例基本一致,分析造成这一差异的原因可能与野生种群和养殖种群获取饵料难易程度不同有关,养殖种群饵料充分有保障,受敌害、环境胁迫相对较少,有利于其生长,而野生种群饵料供应保障程度上不及养殖种群,而且相对养殖种群长期处于复杂多变的水生态环境,不利于其生存与生长[26]。当然也不排除与所测样本鱼的规格和样本量大小有关,随着黄尾鲴规格的增大,可食部分所占比例也相应增大。因此,建议在报道鱼类可数可量性状时,一定要说明样本的规格及样本数量。
表2 黄尾鲴可数性状的比较
Tab.2 Comparations of countable parameters ofXenocyprisdavidi
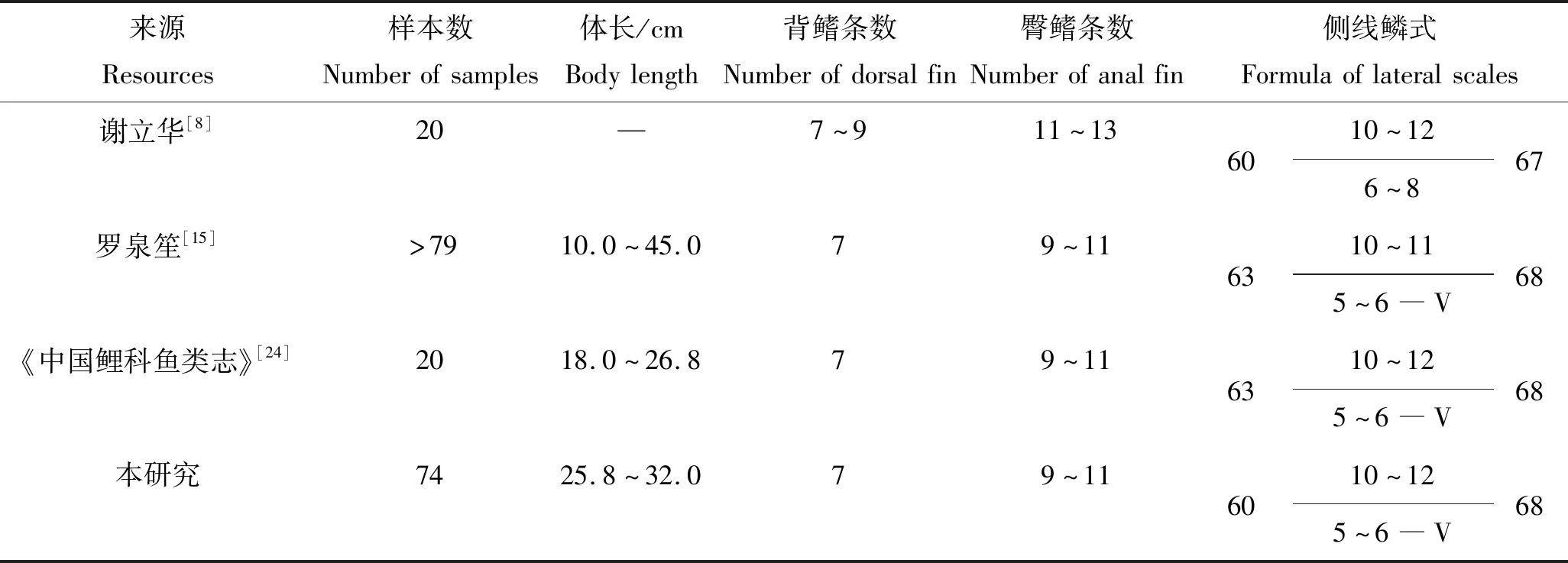
来源Resources样本数Numberofsamples体长/cmBodylength背鳍条数Numberofdorsalfin臀鳍条数Numberofanalfin侧线鳞式Formulaoflateralscales谢立华[8]20—7~911~136010~12676~8罗泉笙[15]>7910.0~45.079~116310~11685~6―V《中国鲤科鱼类志》[24]2018.0~26.879~116310~12685~6―V本研究7425.8~32.079~116010~12685~6―V
注:侧线鳞式参照文献[21]。“—”示文献未列出,下同。
3.2 黄尾鲴同工酶表达的组织特异性及其研究结果比较
本研究中,黄尾鲴的各种组织中均能检测到LDH和MDH同工酶的表达,说明黄尾鲴体内LDH和MDH分布比较广泛。从实验结果来看,两种同工酶在黄尾鲴5种组织中的表达均具有组织特异性,除了不同组织检出的酶带数目不同外,表达的活性也存在差异。如肝脏LDH酶带着色程度均较深,说明其在肝脏中表达活性较强,这与肝脏是重要的糖代谢器官是相适应的,糖代谢主要通过肝糖原的合成和分解以及糖异生作用来维持血糖浓度相对稳定,而LDH是参与糖酵解和糖异生过程中催化乳酸和丙酮酸之间氧化还原反应的重要酶类[27-28]。同时,心脏组织MDH表达活性也高于眼睛晶状体组织,心脏主要的功能是泵血和循环,血液通过血管进入机体各部分,为机体提供氧分和营养,而MDH是三羧酸循环过程中的一种重要酶,能够催化苹果酸脱氢并与草酰乙酸相互转化[29],MDH在血液为机体提供氧和营养方面发挥着巨大作用。一般认为,同工酶是基因表达的产物,其表达受温度、压力、激素、氧容量和营养等内外因素的时空调控,致使其基因在各组织间的表达时间和强度不相一致,造成了不同组织同工酶酶谱的特异性[30]。
关于黄尾鲴LDH和MDH研究结果的比较见表3,从表3可以看出不同研究者[16-19]对黄尾鲴各组织LDH和MDH的研究结果稍有不同。关于LDH,本研究与姚桂桂等[19]的研究结果比较接近,除了心脏LDH酶带数略有差异、肾脏LDH酶带数差异较大外,其余组织中LDH表达的酶带数相近,且均认为眼睛晶状体组织LDH酶带稳定,多次重复试验结果无差异,眼睛晶状体组织LDH可作为鉴定黄尾鲴种质的特征生化遗传参数。分析认为造成差异的原因可能与实验方法不同有关,包括样品制备方法、浓缩胶和分离胶的浓度、电压和电泳时间的不同等。值得注意的是,不排除养殖种群经过人工定向选择和有限亲本累代繁殖后,致使等位基因丧失,反应在同工酶电泳时相对于野生群体有差异,其他学者研究报道中也有类似的现象[31-32]。当然,由于同工酶是蛋白质水平的标记,是对基因的间接反映,检测结果往往是被修饰的基因产物,而非基因本身[33]。上述研究结果的差异,也可能与同工酶自身特性有关。
表3 黄尾鲴LDH和MDH研究结果比较
Tab.3 Comparations of LDH and MDH isozymes expressed inXenocyprisdavidi

来源Resources电泳方法及凝胶浓度Electrophoresismethodandgelconcentration电泳时间Electrophoresistime同工酶Isozyme心脏Heart眼Eye肌肉Muscle肝脏Liver肾脏Kidney朱蓝菲[16] 玻璃管电泳5.6%1.5hLDH33——3曹丽琴和 孟庆闻[17] PAGE垂直版电泳,凝胶浓度不详100minLDH555115MDH43355张燕萍等[18]PAGE垂直版电泳,浓缩胶5%,分离胶10%4~5hLDH2—344MDH2—未检出31姚桂桂等[19]PAGE垂直版电泳,浓缩胶3.75%,分离胶6.5%5~6hLDH76—713本研究 PAGE垂直版电泳,浓缩胶4%,分离胶7.5%6~7hLDH663~475~8PAGE垂直版电泳,9%连续胶5~6hMDH4~70~33~43~42~3
4 结论
本研究采用传统形态学方法观测了黄尾鲴的形态特征,重点对其可数、可量性状进行了讨论分析,黄尾鯝的主要形态特征:头小而尖,口下位,下颌有较发达的角质边缘。肛门靠近臀鳍,肛门前有一小段腹棱。鳃盖骨后缘有一浅黄色斑块,背鳍末端黄色,胸鳍和腹鳍淡黄色,尾鳍橘黄色。鳍式为背鳍D.Ⅲ-7和臀鳍A.ⅲ-9~11;下咽齿齿式2·4·6/6·4·2;脊椎骨数为36~41;左侧第一鳃弓外侧鳃耙数为44~52。同时,通过聚丙烯酰胺凝胶垂直板电泳对黄尾鲴心脏、眼睛晶状体、肌肉、肝脏和肾脏5种组织的LDH和MDH同工酶进行了分析,其LDH酶带数分别为6、6、3~4、7和5~8条,MDH酶带数分别为4~7、0~3、3~4、3~4和2~3条,初步确定了黄尾鲴眼睛晶状体中LDH为单态、表达丰富且活性稳定,可作为鉴定黄尾鲴种质的特征生化遗传参数。本研究可为黄尾鯝种质鉴定、制定其种质标准提供参考资料。

