EGCG通过PI3-K/Akt信号通路诱导人甲状腺乳头状癌细胞K1增殖和凋亡的影响
赵星智, 胡新华
(中国医科大学附属第一医院 血管甲状腺外科,辽宁 沈阳 110001)
近年来,我国肿瘤患者的发生率呈现逐年升高的趋势,已成为影响国民身体健康的主要疾病之一[1]。甲状腺乳头状癌是甲状腺癌症最常见的一种,患者的病情发展缓慢,恶性程度低,因此常常易于忽视,但却存在较高的转移甚至死亡的风险[2-3]。对于肿瘤的治疗,目前主要是以手术为主,但在实际治疗中都具有明显的局限性,因此大量研究致力于甲状腺乳头状癌的预防和新药的研发。茶饮是我国传统文化的一部分,有迹象显示饮茶能够显著降低直肠癌、胃癌、结肠癌等多种癌症的发生[4-5],近代药理研究表明绿茶中富含的表没食子儿茶素没食子酸酯(epigallo-catechingallate,EGCG)是其发挥抗癌防癌活性的主要原因,近年来EGCG抗肿瘤活性研究引起研究者的广泛关注[6-7],但关于EGCG在甲状腺乳头状癌预防和治疗的研究鲜有报道,本文主要研究EGCG通过PI3-K/Akt信号通路对人甲状腺乳头状癌细胞K1凋亡的影响,探索其可能的作用机制,为今后EGCG在临床抗癌防癌应用方面提供参考。
1 材料与方法
1.1 材料
1.1.1 原料 EGCG购自Sigma公司,人甲状腺乳头状癌细胞K1细胞购自ATCC。
1.1.2 试剂 达尔伯克(氏)改良伊格尔(氏)培养基(dulbecco′s modified eagle medium,DMEM)、MTT、二甲基亚砜(Dimethyl sulfoxide,DMSO)、青霉素和链霉素、胰蛋白酶等(上海生工生物股份有限公司);胎牛血清、Annexin V-FITC/PI试剂盒、PI试剂(杭州四季青生物工程材料有限公司);PI3-K、Akt/p-Akt、mTOR、cyclic D1、CDK4、Bcl-2/Bad、cleaved-caspase-3、β-actin、蛋白抑制剂等(Santa Cruz公司,美国);HRP羊抗兔IgG、HRP羊抗鼠IgG(Thermo公司,美国);细胞裂解液、ECL化学发光试剂及其他试剂、耗材(北京索莱宝科技有限公司)。
1.1.3 仪器与设备 CO2培养箱(SanYo公司,日本);XD-202倒置显微镜(南京江南永新光学有限公司);DNM-9606酶标分析仪(北京朗普新技术有限公司);FACSCalibur流式细胞仪(BD公司,美国);湿转仪(AB公司,美国);电泳仪(Bio-red,美国);凝胶成像系统(DNR公司,以色列);其他仪器购自德国eppendorf公司。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEN高糖培养基培养人甲状腺乳头状癌K1细胞,培养条件为37 ℃,5% CO2恒温恒湿。隔天换液1次,细胞融合度达到75%以上,3次传代后进行实验检测。
1.2.2 MTT法检测细胞增殖抑制作用 取对数生长期细胞,调整细胞浓度为105/mL,100 μL/孔接种于96孔板,37 ℃、5% CO2下过夜培养(约16 h),实验前2%胎牛血清的DMEM培养基饥饿处理2 h。培养基进行EGCG稀释,浓度为目标浓度的2倍,每孔加入100 μL稀释药物,终浓度为5、10、20、40、80 μg/mL,对照孔只加入100 μL细胞培养基,每个浓度设置5个复孔,分别培养24、48、72 h后每孔加入20 μL MTT溶液(5 g/L),孵育4 h,弃尽孔内培养基,加入150 μL DMSO,沉淀完全溶解后,用酶标分析仪测定490 nm波长下各孔的OD值。细胞抑制率(%)=((对照孔A490平均值-各药物处理孔A490平均值)/对照孔A490平均值)×100%。实验重复检测3次,计算半数抑制浓度IC50值。
1.2.3 流式细胞术检测细胞周期 取对数生长期细胞,调整细胞浓度为2.5×105/mL,2 mL接种于6孔板,37 ℃、5% CO2下过夜培养(约16 h)。用孔内培养基直接稀释EGCG至20、50、80 μg/mL、37 ℃、5% CO2培养处理48 h。离心收集细胞于上样管,用预冷的75%乙醇4 ℃条件下固定30 min,PBS清洗后重悬加入PI溶液终浓度为50 mg/L;室温暗室孵育30 min。加PBS至500 μL混匀过300目筛,30 min内上机检测分析细胞周期情况。
1.2.4 流式细胞术检测细胞凋亡 取对数生长期细胞,调整细胞浓度为2.5×105/mL,2 mL接种于6孔板,37 ℃、5% CO2下过夜培养(约16 h)。用孔内培养基直接稀释EGCG至20、50、80 μg/mL,37 ℃、5% CO2培养处理48 h。离心收集细胞于上样管,按照 Annexin V-FITC试剂盒说明书向每管中依次加入150 μL Annexin V-FITC结合液,3 μL Annexin V-FITC和2 μL PI染液重悬细胞,室温暗室孵育15 min。加PBS至500 μL混匀过300目筛,30 min内上机检测,Cell Quest软件检测分析细胞凋亡情况。
1.2.5 细胞蛋白表达检测 取对数生长期细胞,调整细胞浓度为2.5×105/mL,2 mL接种于6孔板,37 ℃、5% CO2下过夜培养(约16 h)。次日用孔内培养基直接稀释EGCG至20、50、80 μg/mL,处理细胞48 h后,PBS清洗1次,收集细胞于1.5 mL离心管,细胞裂解液冰浴裂解30 min。取上清,酶标仪490 nm波长蛋白定量。12% SDS-PAGE电泳分离,采用湿转法将蛋白转至硝酸纤维素膜上,4 ℃条件依次加入封闭液孵育2 h,一抗孵育过夜(稀释比例均为1∶1 000),二抗孵育2 h(稀释比例均为1∶5 000)。用ECL化学发光试剂显色,凝胶成像系统检测分析蛋白条带,蛋白表达定量分析用Image J图像分析软件对条带进行分析,内参采用β-actin。

2 结果与分析
2.1 EGCG对人甲状腺乳头状癌细胞K1增殖的影响
不同浓度的EGCG处理人甲状腺乳头状癌细胞K1,通过MTT法检测人甲状腺乳头状癌细胞K1的增殖活性。结果显示不同剂量的EGCG分别作用24、48、72 h,甲状腺乳头状癌细胞K1的半数抑制浓度IC50值分别为(68.97±5.62)、(51.95±4.78)、(34.355±4.21) μg/mL,差异统计学分析有意义(P<0.001)。EGCG处理K1细胞48 h,结果显示随着药物浓度增加,细胞存活率显著降低(P<0.01);表明EGCG能够对人甲状腺乳头状癌细胞K1产生剂量、时间依赖性的增殖抑制作用,见图1。
2.2 EGCG对人甲状腺乳头状癌细胞K1细胞周期的影响
流式细胞术检测不同剂量的EGCG处理人甲状腺乳头状癌K1细胞48 h分析对凋亡影响,结果显示:随着药物作用时间的增加,与对照组相比,G1期细胞比例显著增加,进入S期和G2/M期的细胞数量明显降低(P<0.05),同时当EGCG剂量达到50 μg/mL时,在G1期出现一个亚二倍体凋亡峰(P<0.05),预示着EGCG可能具有诱导K1细胞凋亡的作用;当EGCG剂量达到80 μg/mL时,基本不存在G2/M期细胞。Westernblot分析发现,随着EGCG剂量的增加,甲状腺乳头状癌K1细胞中Cyclin D1和CDK4蛋白的表达量显著降低,且呈显著剂量依赖,差异统计学分析有意义(P<0.05),表明EGCG能够通过下调Cyclin D1和CDK4蛋白表达,将K1细胞阻滞在G1期,见图2。

图1 MTT检测EGCG对人甲状腺乳头状癌细胞K1细胞增殖的影响Fig.1 Effect of EGCG on proliferation of human papillary thyroid carcinoma cell line K1 detected by MTT
2.3 EGCG对人甲状腺乳头状癌细胞K1凋亡的影响
流式细胞术检测剂量EGCG对人甲状腺乳头状癌细胞K1凋亡影响,结果显示:与对照组比,随着药物剂量的增加,细胞凋亡总量逐渐增加,当EGCG的剂量为20 μg/mL时,凋亡细胞量为(32.48±2.51)% (P<0.001);当EGCG的剂量达到50 μg/mL和80 μg/mL时,人甲状腺乳头状癌细胞K1的凋亡率分别为(47.62±2.57)% (P<0.001)和(59.34±2.79)%(P<0.001);组间比较差异统计学分析有意义(F=64.672,P<0.001)。通过Westernblot对相关凋亡蛋白表达量检测发现,随着EGCG剂量的增加,K1细胞抗凋亡蛋白Bcl-2的表达显著降低,促凋亡蛋白Bad和cleaved-caspase-3的表达量明显增高(P<0.05),且表现出明显的剂量依赖性,组间差异统计学分析有意义(P<0.05)。表明EGCG能够通过调控凋亡蛋白的表达量,诱导K1细胞的凋亡,见图3。

图2 EGCG对人甲状腺乳头状癌细胞K1细胞周期及相关蛋白表达的影响Fig.2 Effects Of EGCG on cycle and related protein expression of human thyroid papillary carcinoma K1 cellsA:流式细胞术检测细胞周期;B:不同细胞周期细胞所占百分数;C:不同蛋白的Westernblot结果图;D:蛋白定量分析;与对照组相比,*:P<0.05,**:P<0.01,***:P<0.001,下图同A:Flow cytometry for cell cycle detection;B:Percentage of cells in different cell cycle;C:Westernblot results of different proteins;D:Proteins quantitative analysis;Compared with control group,*:P<0.05,**:P<0.01,***:P<0.001,same the following Figure

图3 流式细胞术分析EGCG对K1细胞的凋亡作用Fig.3 Apoptosis of K1 cells was analyzed by flow cytometry (EGCG)
2.4 EGCG对人甲状腺乳头状癌细胞K1蛋白表达的影响
通过Westernblot分析EGCG对人甲状腺乳头状癌细胞K1的蛋白表达影响,结果显示:与对照组相比,EGCG处理后人甲状腺乳头状癌K1细胞对AKT蛋白的表达量无影响(P>0.05),而PI3-K表达和p-AKT的表达随着EGCG剂量的增加,表达量显著降低(P<0.05);同时下游调控蛋白m TOR的表达也明显受到抑制(P<0.05),组内差异统计学分析有意义(P<0.05)。表明EGCG能够通过PI3-K/AKT信号通路调控细胞的生物学功能,见图4。
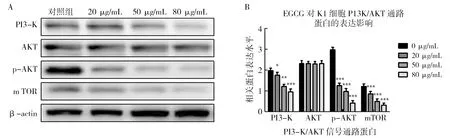
图4 Westernblot检测蛋白表达及分析Fig.4 Expression and analysis of protein detected by WesternblotA:PI3-K/AKT相关蛋白Westernblot分析结果;B:蛋白定量分析A:Westernblot analysis results of PI3-K/AKT related protein;B:Proteins quantitative analysis
3 讨 论
甲状腺乳头状癌是最常见、恶性度最低的甲状腺癌,约占甲状腺癌的85%。该疾病病程发展缓慢,因而难以做到早期的诊断和治疗,统计显示甲状腺乳头状癌的发病率呈逐年增加趋势。由于甲状腺乳头状癌对放射线外照射及化疗不敏感,手术治疗存在很大副反应,且影响美观,因此寻求针对甲状腺乳头状癌新的治疗方法显得十分迫切。有研究显示在喜欢饮茶的东亚地区,部分癌症如前列腺癌、直肠癌等的发病率显著低于其他地区,这可能与该地区的茶饮文化相关,绿茶含有丰富的茶多酚,主要成分是表没食子儿茶素没食子酸酯,研究指出EGCG能够对包括皮肤癌、乳腺癌、前列腺癌等多种癌症具有显著的抗肿瘤作用;通过构建肿瘤模型裸鼠,表明EGCG对肿瘤的生长和转移发挥明显的抑瘤作用[8],目前关于EGCG对甲状腺乳头状癌的治疗及作用机制鲜有报道。因此本文主要研究EGCG通过PI3-K/Akt信号通路诱导人甲状腺乳头状癌细胞K1增殖和凋亡的影响。
本研究结果显示,通过MTT法检测发现,EGCG分别作用24、48、72 h,甲状腺乳头状癌细胞K1的半数抑制浓度IC50值显著降低(P<0.05),同时随着剂量增加,细胞的存活率明显降低(P<0.01),表明EGCG能够对人甲状腺乳头状癌细胞K1产生剂量、时间依赖性的增殖抑制作用。引起细胞产生增殖抑制的途径有很多,主要包括周期阻滞、诱导凋亡和自噬等。其中细胞周期是一个完整而又复杂的系统,受到多种调节因子和蛋白的调控,其中主要是细胞周期素(cyclins)、细胞周期蛋白依赖性激酶(CDKs)及细胞周期蛋白依赖性激酶抑制因子(CKIs),其中cyclins起正调控作用,CKIs为负调控因子。在细胞周期调节过程中,Cyclin Dl与CDK4首先结合形成复合体,同时激活抑癌基因pRb的表达及磷酸化,从而促进细胞的增殖[9-11]。肿瘤细胞由于cyclin Dl与CDK4的高表达,缩短G1期促使细胞提前进入S期导致自身增殖失控。本研究通过流式细胞术研究EGCG对K1细胞周期影响,结果显示,随着EGCG剂量的增加,G1期细胞比例显著上升,而S期和G2/M期细胞比例明显降低。通过Westernblot分析发现,随着EGCG剂量增加,Cyclin Dl与CDK4蛋白表达量呈现显著的剂量依赖性降低(P<0.05),这表明EGCG可能是通过抑制Cyclin Dl与CDK4的表达,将K1细胞阻滞于G1期。
在研究EGCG对K1细胞周期影响时,发现当EGCG的剂量达到50 μg/mL时,在G1期出现一个亚二倍体凋亡峰;剂量达到80 μg/mL时,亚二倍体凋亡峰显著增高,由于亚二倍体峰凋亡峰往往出现在细胞发生凋亡时,其比例反映了细胞凋亡的程度[12],预示着EGCG可能对K1细胞存在诱导凋亡的作用。本研究通过流式细胞术分析EGCG对K1细胞凋亡的影响,结果显示,随着剂量的增加,人甲状腺乳头状癌细胞K1的凋亡率显著增加(P<0.05)。由于细胞凋亡往往涉及凋亡信号的传递及相关蛋白表达,其中caspase家族和Bcl-2家族蛋白作为调控细胞凋亡的主要蛋白[13-15],caspase-3作为caspase家族的主要成员,其在细胞信号的传递和凋亡执行中具有重要作用,当细胞进入凋亡程序,抑凋亡蛋白Bcl-2显著降低,促凋亡蛋白Bad的表达明显升高,放大凋亡信号并进一步通过caspase-9的活化激活caspase-3蛋白活性并执行细胞凋亡,而凋亡信号一旦激活caspase-3,细胞凋亡将进入不可逆的状态[16-17]。本研究通过Westernblot分析发现,随着EGCG剂量的增加,K1细胞抑凋亡蛋白Bcl-2的表达量明显降低,而促凋亡蛋白Bad和cleaved-caspase-3的表达量显著增加。表明EGCG能够通过调控凋亡蛋白的表达量,诱导人甲状腺乳头状癌K1细胞的凋亡。
PI3K/AKT信号通路在细胞的增殖、分化、生存中扮演着十分重要的角色[18-19],在PI3K信号通路中,AKT的磷酸化是整个信号传递过程的核心,上游PI3k蛋白的表达能够调控AKT的磷酸,从而抑制Bcl-2家族蛋白Bad的活化,阻碍细胞凋亡[20];同时活化下游蛋白mTOR的表达,参与细胞生长及能量代谢[21]。本研究发现EGCG对K1细胞总AKT蛋白的表达量没有变化,但能够降低PI3K蛋白的表达量并抑制ATK蛋白的磷酸化,进一步下调mTOR蛋白的表达量(P<0.05)。这表明EGCG能够通过下调PI3K蛋白的表达,抑制AKT的磷酸化,通过调控Bad蛋白的表达诱导细胞凋亡,同时通过降低mTOR蛋白表达量,抑制细胞的能量代谢途径,实现对K1细胞的增殖抑制。由于诱导细胞凋亡存在多种信号传递途径,而EGCG是否能够同时激活多条信号通路,共同诱导细胞凋亡的发生,值得后续研究探讨。
综上所述,EGCG能够通过PI3-K/Akt信号通路,下调PI3-K蛋白表达,抑制AKT蛋白磷酸化和mTOR表达,同时下调cyclin D1、CDK4、Bcl-2的表达,促进Bad表达及caspase-3 蛋白活化,诱导G1阻滞及细胞凋亡,抑制人甲状腺乳头状癌细胞K1增殖。

