激光对小麦增强UV-B辐射POD影响的研究
王 鹏(山西省太谷中学校 山西太谷 030800)
自从1980年以来,全球许多区域上空臭氧(O3)总量显著下降,特别在20 世纪90年代,相比前几十年,臭氧量更是显著下降,且目前呈继续降低趋势。臭氧层耗损导致的最直接的后果是近地面短波辐射,特别是UV-B(波长在290~320 nm之间的紫外线)辐射的增加,科学家认为今后20年内臭氧层是处于最脆弱状态的时期,一些影响将在21 世纪的大部分时间内出现[1]。
增强的UV-B 直接影响生物的生活与生存,导致许多动、植物在形态结构、生理代谢、遗传特性和生长周期等方面发生改变[2],进而直接或间接地对人类的生存构成威胁。因此,揭示UV-B 对生物,尤其是对农作物的损伤及修复机理尤为重要。
小麦作为一种重要的粮食作物,受UV-B 辐射后在形态结构、细胞、生理生化和DNA 水平等各方面都发生了明显的变化。形态结构方面:植株矮化,叶面积减小,气孔数减少,叶子卷曲,节间缩短,腋芽增多,叶上表皮腊质结构改变,表皮增厚、色素堆积、叶绿素重新分布,并出现明显的“翘根”现象;细胞水平:细胞有丝分裂率降低,产生落后染色体、染色体桥、游离染色体、核变形等畸变,出现了“分束分裂”的现象;生理生化水平:丙二醛(MDA)、还原型抗坏血酸(AsA)的浓度增加,超氧化物歧化酶(SOD)活性无明显变化,过氧化物酶(POD)的活性增强[3];DNA 分子水平:主要是使同一条链上相邻的2 个嘧啶碱基形成环丁烷嘧啶二聚体(CPDs)和6-4 光产物(6-4PPS)。细胞可通过光修复、切除修复、重组修复和SOS 修复等途径进行修复。
激光已被广泛用做研究手段,其生物效应可分为光效应、电磁效应、热效应和压力效应。已有研究表明,适当激光照射可提高种子萌发力[4],提高酶活性,增强抗逆性[5],同时也可促进DNA 损伤修复的进行。这些研究对于增强植物抗辐射能力,提高农作物产量具有重要的现实意义。本实验采用He-Ne 激光(可见光激光[6])处理增强UV-B辐射的小麦,以其在过氧化酶POD 方面的功效反映He-Ne 激光在小麦UV-B 辐射损伤修复中的影响和作用机制。
目前研究人员正从分子水平进行研究,以便更深层次探讨UV-B 辐射对植物的伤害。同工酶分析是从分子水平研究植物抗逆性的一种有效手段。同工酶是具有恒定性质的酶的各种类型,是基因表达的产物; 过氧化物酶都可清除生物体内的H2O2。其不同之处是前者催化H2O2分解为H2O 与O2;而后者催化H2O2氧化其他底物(以SH2表示)后才产生H2O[7]。
1 材料与方法
1.1 实验材料 选用冬小麦临远93-4736(Triticum aestivum,cv.),由山西省农科院小麦研究所提供。
1.2 实验设备 恒温光照培养箱、光照培养箱、大功率激光生物辐照仪、酸度计、电子天平、逆渗透纯水机、超速冷冻离心机、恒温磁力搅拌器、超净水仪及玻璃仪器烘干器。
1.3 实验试剂 氯化汞、碘化钾、Tris-甘氨酸、磷酸二氢钠、磷酸氢二钠、四唑蓝盐、三羟甲基氨基甲烷、氯化镁、Tris-盐酸、3%双氧水、乙二胺四乙酸、过硫酸氨、联苯胺、醋酸、溴酚蓝、蔗糖、四甲基乙二胺、蒸馏水及双蒸水。
1.4 实验方法
1.4.1 选取最佳激光照射时间 用He-Ne 激光(8 mW/mm2)辐照方法,探究增强UV-B[10.08 kJ/(m2·d)]辐射下小麦在生化方面自我修复的影响。为确定辐照的最佳时间,采取了不同照射时间(表1);第4 组在各组中是修复最好的,最终确定辐照时间4 min 是最佳时间。

表1 各处理组设置及处理程序
1.4.2 种子萌发 设置对照组(CK)、UV-B 处理组(B)、UV-B 和激光复合处理组(BL)共3 组,处理方法见表2。选取籽粒饱满,大小均一的小麦种子,经0.1% HgCl2表面消毒后,培养于有湿滤纸的培养皿内。25℃恒温培养,种子露白时待处理。

表2 处理组设置及处理程序
1.4.3 UV-B 辐射处理 将UV-B 灯垂直悬于培养皿上方,通过调整UV-B 灯与植物培养皿之间的距离控制UV-B 的辐射强度。采用10.8 kJ/(m·d)的辐射剂量处理萌发小麦,每天处理8 h,共处理6 d。
1.4.4 He-Ne 激光辐照 He-Ne 激光器波长为632.8 nm,选用剂量为8 mW/mm2,240 s,25℃。激光辐照处理安排在夜间进行,以排除杂光影响,激光处理后立即转入暗处25℃培养。
1.4.5 形态特征指标的测定 种子处理3 d 后,每天统计各处理组的发芽数,测量株高、根长,分别求其平均值;以百分比表示其发芽率,同时对株高、根长等形态指标进行记录和统计。
1.4.6 POD 酶液的提取 每组取小麦叶片0.5 g,切碎,放人研钵中,加5 mL 0.2 mol/L(pH=7.8)磷酸缓冲液研磨成匀浆。将匀浆液全部转入离心管中,以3 000 g 离心10 min ,上清液即为POD的粗提液。低温下保存备用。
1.4.7 凝胶电泳 聚丙烯酰胺凝胶电泳的凝胶浓度采用分离胶7%和浓缩胶4%(表3),电极缓冲液Tris-甘氨酸pH=8.7。垂直平板凝胶(厚1.0 mm,共10 齿),以样品∶蔗糖∶溴酚兰=10∶10∶1 的比例配置样品。每齿点样15 μL,电泳时浓缩胶10 mA,电泳时间30 min,分离胶20 mA,电泳时间8 h。
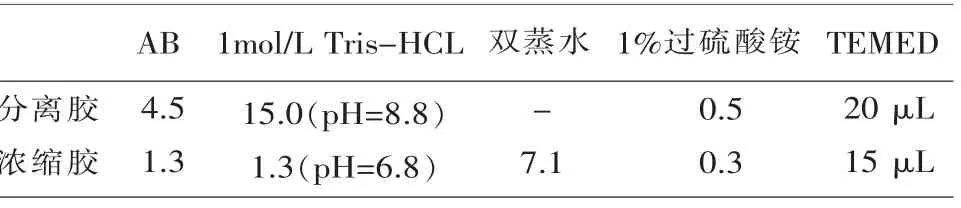
表3 聚丙烯酰胺凝胶配制方法(单位:mL)
1.4.8 POD 染色 取醋酸联苯胺溶液(2 g 联苯胺溶于18 mL 醋酸中,加72 mL 水)5 mL,3% H2O22 mL,加蒸馏水93 mL。将取出的胶浸入染色液中5~10 min,取出用水漂洗,停止染色[8]。
2 实验结果
2.1 形态特征的变化 经UV-B 处理的小麦明显表现出以下特征:生长发育迟缓,株高较低;发芽率明显降低,生长势下降;叶片较短、卷曲,萌发初期卷为蜗牛状,逐渐由叶尖开始泛黄;根普遍很短,但根数较多,根色泛黄;在增强UV-B 辐照下,小麦幼苗根尖出现“翘根”现象,幼根翘起,脱离基质,无法吸水以至干枯。
与UV-B 处理组相比,经激光处理后,有明显的修复效应。小麦生长发育较快,植株变高;发芽率提高,生长势上升;叶片长势较好,卷曲,泛黄较少;根长有所增加。并且在增强UV-B 辐照下出现的“翘根”现象,经激光处理后,其现象减少,翘根不太明显。但整体上和CK 组有一定差距。
2.2 凝胶拍摄与分析 电泳后,胶板在Gel Media System 中分析:图象采集用佳能Power Shot G2 数码相机,再用Gel-Pro Analyzer 软件进行分析。
2.2.1 POD 电泳图谱 由电泳图谱(图1)可知,经UV-B 辐射处理后,酶带变浅,变少。结果表明,经紫外线辐射后,POD 的含量减少,酶的活性降低。而BL 组则明显优于B 组,却差于CK 组。
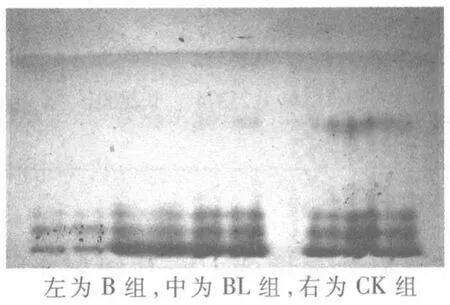
图1 POD 电泳图谱
2.2.2 POD 曲线分析 将各处理组凝胶电泳图谱中最清晰的2 条条带进行曲线分析,CK 组、BL组及B 组各Rf 曲线见图2。比较3 组曲线,峰面积CK 组大于B 组,而BL 组与CK 组差别不大。BL 组也明显大于B 组。

图2 CK 组、B 组和BL 组Rf 曲线图
2.2.3 OD 值的比较 各组最大OD 值见表4。1和2 是CK 组,3 和4 是BL 组,5 和6 是B 组。在同一峰值中,同组的相差不大,而CK 组大于BL组都明显大于B 组。而OD 值反映的是酶的浓度与含量,可看出BL 组明显优于B 组。
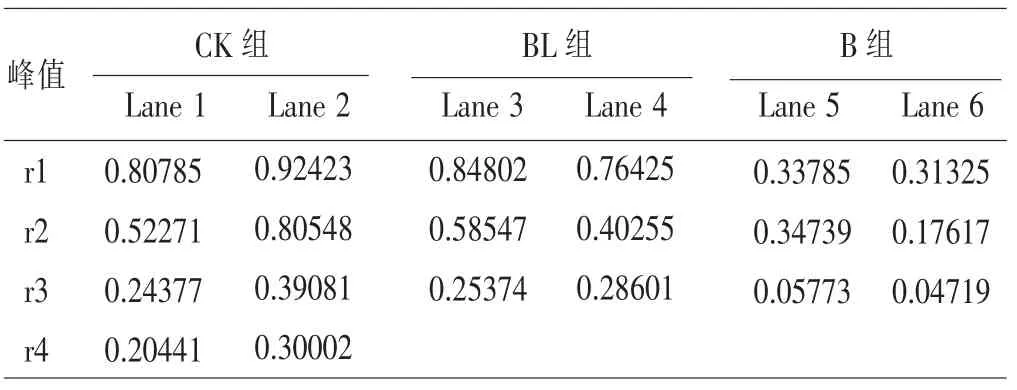
表4 Rf 曲线最大OD 值比较
3 讨论
3.1 翘根现象 在增强UV-B 辐射下,小麦幼苗根系弯翘,向着UV-B 光源方向弯曲,其机理有待进一步探讨。
3.2 POD 的变化 POD 是植物体内的一种典型的过氧化物酶,增强UV-B 辐射能改变POD 的活性。UV-B 辐射一方面加快了活性氧的产生,另一方面破坏了POD 等的保护酶系统,导致活性氧等过氧化物的积累,加速膜脂过氧化,造成膜系统破坏及代谢异常。酶是基因表达的产物,由于增强UV-B 从分子水平破坏了生物大分子,使DNA 分子受损,酶的表达也受损。紫外线辐射下,植物体内清除活性氧等过氧化物的防卫系统受到破坏,POD 与活性过氧化物之间的平衡打破,致使活性过氧化物在体内积累,造成植物结构功能受损,蛋白质表达减少,包括POD 含量也减少。
植物具有适应性,适当的UV-B 辐射能依靠自身的修复机制进行。有研究表明,激光照射可促进小麦对UV-B 的损伤修复[12]。适当激光照射可能主要通过磁场效应首先活化某些基因,使这些基因开始转录,合成mRNA;其次,活化核糖体上蛋白质合成作用因子,从而使新出现的mRNA 翻译,合成新蛋白质。新蛋白质的出现可反映处于上游的某些基因已经表达。
3.3 He-Ne 激光的作用机理 激光对生物体的刺激效应已在多种植物中得到了广泛研究。已有研究表明,激光对生物体的作用主要表现为光效应、电磁效应、热效应和压力效应[9]。但低功率的激光特别是可见光范围的激光,其产生的热和压力很少。因此,激光对生物体的影响就主要表现为光效应和电磁效应。然而,产生光效应的光源必须是线性偏振的,用非相干的热光源(λ=630 nm)辐照时无效[9]。起作用的就有可能是激光的电磁效应,其中主要是磁场效应。磁场可通过许多方式影响生物分子(包括蛋白质和酶)的结构,从而导致生物活性的变化[10]。低功率的激光能促进生物体内酶的活性[11]。
当小麦受UV-B 胁迫辐射后,可引起DNA 的一条链上2 个相邻胸腺嘧啶残基的稳定联结,可导致基因失活;UV-B 也有很强的致突性造成碱基的取代、缺失或插入,这些损伤的形成直接影响DNA 的复制、转录和翻译,从而在细胞或者是植株水平上表现出损伤效应。低功率的激光不仅能提高生物体内酶的活性,而且能增强生物体内的光修复、切除修复等。

