斑马鱼眼部细胞凋亡模型的建立
杨 菲,华永庆,林紫微,黄天一,崔 杰,李梦雨,陈婷婷,许惠琴
(南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
随着人类社会工业化及信息化的发展,不良的生活作息和环境污染等因素越来越侵害人们的健康,眼部疾病的发生率逐年上升[1]。目前,用于眼部疾病模型的研究主要集中在小鼠、大鼠、豚鼠、家兔和恒河猴等哺乳动物,但由于其周期普遍较长,不利于眼部用药的快速筛选。斑马鱼(Daniorerio)作为一种视觉高度发达的模式动物,其视网膜形态学结构与人类和其他脊椎动物非常相似[2]。斑马鱼眼睛在整体中占较大比重,其胚胎透明的特性便于实验操作以及器官可视化[3-4]。因此,模式生物斑马鱼用于眼部实验具有优势。邻苯二甲酸二丁酯(dibutyl phthalate, DBP)作为常用的增塑剂来增大塑料的可塑性和强度。研究表明,DBP有致癌、致畸、致突变和致哮喘的作用[5],染毒后尤其容易使机体的眼部细胞发生凋亡。本研究选用斑马鱼作为模式动物,用DBP建立眼部细胞凋亡模型,并观察药物的作用,以验证模型的有效性,为眼部用药的研究提供一种简单快捷的评价方法。
1 材料
1.1 实验动物斑马鱼AB品系,购于凯基生物有限公司,昼夜节律为昼 ∶夜=14 h ∶10 h;温度(28.5±0.5)℃。
1.2 药物与试剂DBP(纯度>99.5%,源叶生物科技有限公司,批号:S51140);N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC),纯度>99%,购自碧云天生物技术有限公司,批号:S0077;人参皂苷Rg1(ginsenoside Rg1,Rg1),纯度≥98%,购自源叶生物科技有限公司,批号:B21057;链霉蛋白酶E(Solarbio公司,批号:721J041);吖啶橙(Acridine Orange,AO)染色液(1 g·L-1),购自源叶生物公司,批号:R20290;MS-222(Sigma, 批号: MKBV1603V);亚甲蓝(Solarbio公司)。
1.3 仪器M205FA体式荧光显微镜(Leica公司);SPX-150生化培养箱(上海跃进医疗器械有限公司)。
2 方法
2.1 药物溶液的配制
2.1.1胚胎培养液 量取纯水1 000 mL,加盐水调节电导率至550~580 μs·cm-1,加入0.1 g·L-1亚甲蓝溶液1 mL,混合均匀,即得。
2.1.2DBP储备液 精密称取21 mg DBP,加胚胎培养液至7.54 mL,即得10 mmol·L-1DBP储备液,置于4 ℃冰箱备用,使用时,用胚胎培养液稀释成所需浓度。
2.1.3NAC储备液 精密称取16.27 mg NAC,加胚胎培养液至1.994 mL,即得500 mmol·L-1NAC储备液,置于4 ℃冰箱备用,使用时,用胚胎培养液稀释成所需浓度。
2.1.4Rg1储备液 精密称取20 mg人参皂苷Rg1,加胚胎培养液至2.497 mL,即得10 mmol·L-1Rg1储备液,置于4 ℃冰箱备用,使用时,用胚胎培养液稀释成所需浓度。
2.1.5链酶蛋白酶E溶液 精密称取25 mg链酶蛋白酶E粉末,置于50 mL胚胎培养液中,待完全溶解,即为0.5 g·L-1链酶蛋白酶E溶液。
2.1.6AO溶液 取50 μL AO染色液(1 g·L-1),加9.95 mL胚胎培养液稀释至5 mg·L-1。
2.1.7麻醉剂 精密称取三卡因粉末400 mg,加入Tris缓冲液(调至pH 7),再加入超纯水至100 mL,混合均匀,得三卡因储存液,储存于4 ℃冰箱,用时量取三卡因储存液4.2 mL,加入超纯水至100 mL,混合均匀,即得。
2.2 DBP对斑马鱼存活率的影响将挑选好的正常胚胎置于6孔板中,每孔20枚,并加入3 mL胚胎培养基,从受精后30 h(hpf)开始加入各浓度DBP(0.1、10、50、100 μmol·L-1),在正常环境下培养42 h,于18 h和42 h观察死亡胚胎数目,上述实验平行重复3次,数据汇总后统计存活率。
2.3 DBP诱导眼部细胞凋亡模型将挑选好的正常胚胎置于6孔板中,每孔12枚,并加入3 mL胚胎培养基,从受精后30 h或54 h开始,吸尽胚胎培养基,分别加入各浓度DBP(0.1、1、5、10、50 μmol·L-1),在直射光(54-324 lux)或非直射光条件下继续培养18 h,上述实验平行重复3次。AO染色,并在体式显微镜下观察,眼部绿色荧光显示为凋亡细胞,采集图片并进行数据处理。
2.4 给药方式将正常斑马鱼胚胎置于6孔板中,每孔12枚鱼卵,并给予3 mL胚胎培养基饲养至30 hpf,吸尽培养基;分组,空白对照组加入3 mL胚胎培养基,模型组加入3 mL 10 μmol·L-1DBP,6个给药组每孔除加入1.5 mL 20 μmol·L-1DBP外,分别加入1.5 mL NAC(0.2、2 mmol·L-1)以及人参皂苷Rg1(0.2、2、10、100 μmol·L-1),共培养18 h,上述实验平行重复3次。AO染色,并在体式显微镜下观察眼部凋亡细胞,采集图片并进行数据处理。
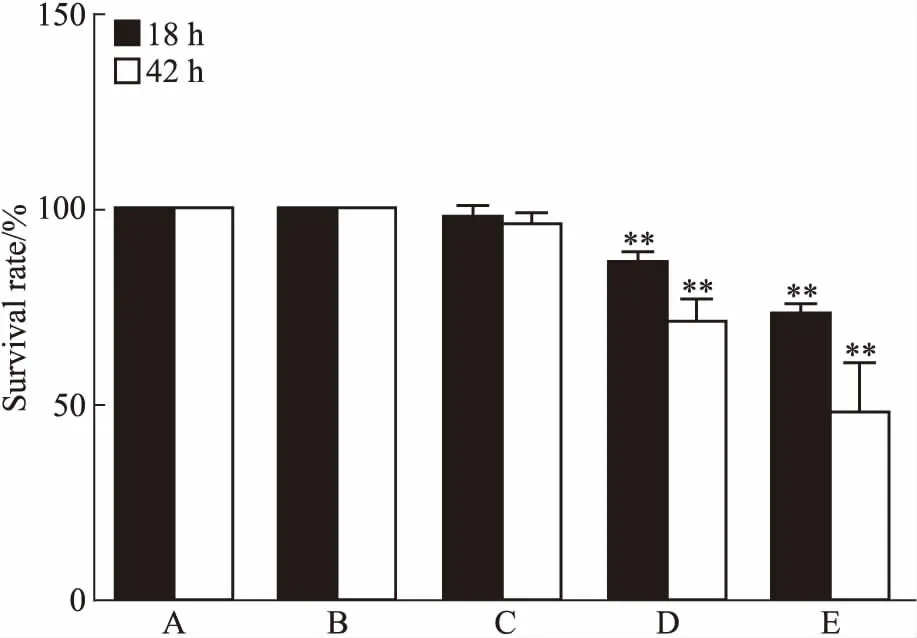
Fig 1 Effect of 18 h(A) and 42 h(B) DBP treatmenton survival rate of
A:Control;B:0.1 μmol·L-1DBP;C:10 μmol·L-1DBP;D:50 μmol·L-1DBP;E:100 μmol·L-1DBP.**P<0.01vscontrol group
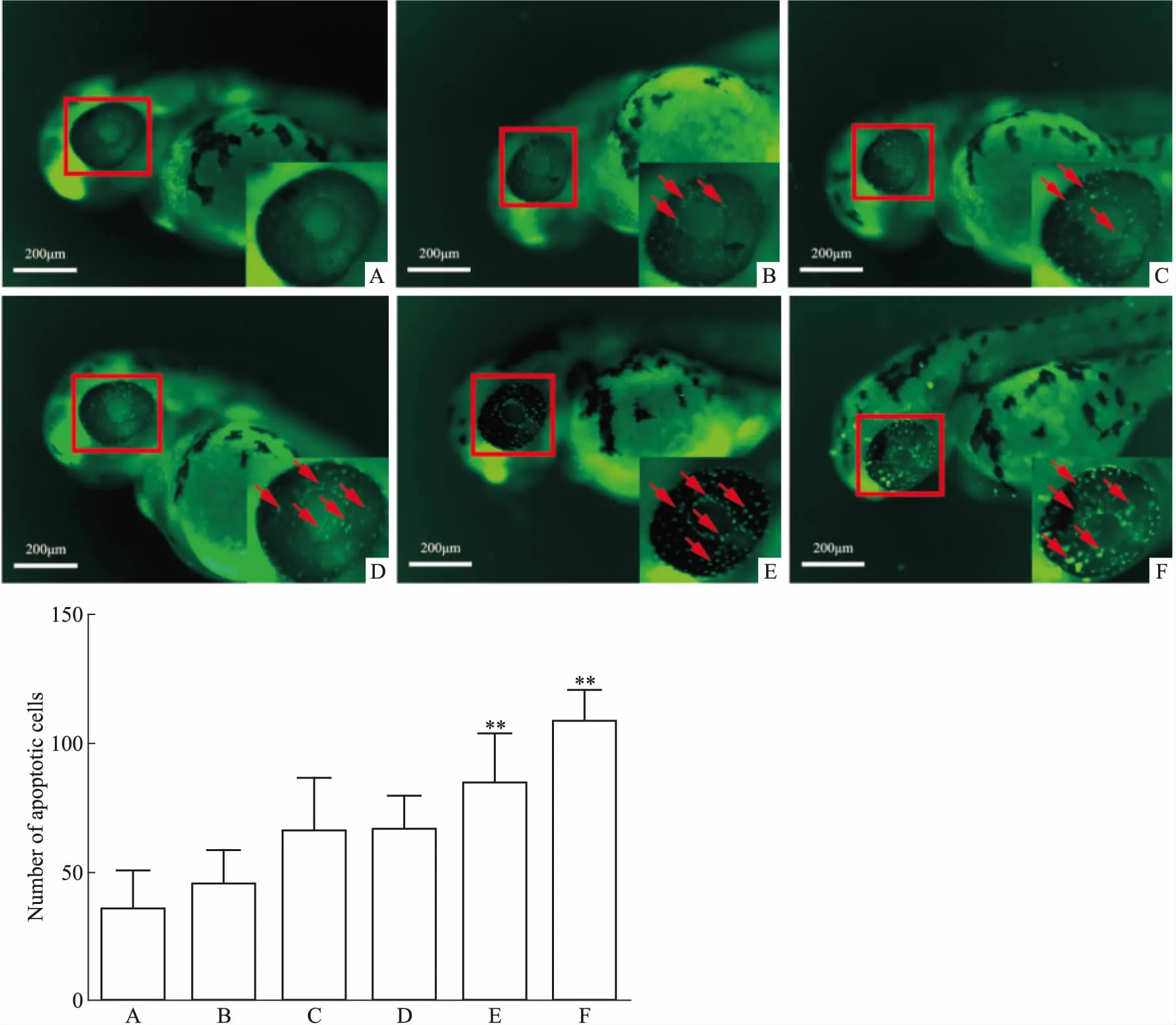

A:Control;B:0.1 μmol·L-1DBP;C:1 μmol·L-1DBP;D:5 μmol·L-1DBP;E:10 μmol·L-1DBP;F:50 μmol·L-1DBP
2.5 图片采集及数据处理将胚胎放在有0.5 g·L-1蛋白酶E溶液的培养皿中,在室温下放置8 min;当胚胎有个别开始脱膜时,立即加入胚胎培养液稀释,终止脱膜,迅速将脱膜后的胚胎移入干净的培养皿中,漂洗2遍后,用5 mg·L-1AO溶液在暗室中染色1 h,进而用胚胎培养液漂洗3次,每次5 min,然后用2 mL 0.04 g·L-1的MS-222麻醉5 min,置载玻片上,于体式荧光显微镜下镜检拍照,采用ImageJ软件对斑马鱼眼部凋亡细胞数进行统计。

3 结果
3.1 不同浓度DBP对斑马鱼存活率的影响为确定DBP对斑马鱼存活率的影响,在30 hpf后加入0.1、10、50、100 μmol·L-1DBP。加入DBP后18、42 h统计斑马鱼存活率。结果发现(Fig 1),30 hpf的斑马鱼给予浓度低于10 μmol·L-1的DBP,在42 h内不影响幼鱼存活率,50、100 μmol·L-1DBP以时间-剂量依赖的方式降低存活率(P<0.01)。
3.2 不同浓度DBP对30 hpf的斑马鱼眼部细胞凋亡的影响为观察DBP对斑马鱼眼部细胞凋亡的影响,在30 hpf的斑马鱼培养基中加入0.1、1、5、10、50 μmol·L-1DBP共培养18 h,即斑马鱼受精48 h后,发现0.1、1、5 μmol·L-1DBP组模型效果不稳定,10、50 μmol·L-1DBP诱导斑马鱼眼部凋亡作用最为明显(P<0.01),见Fig 2。
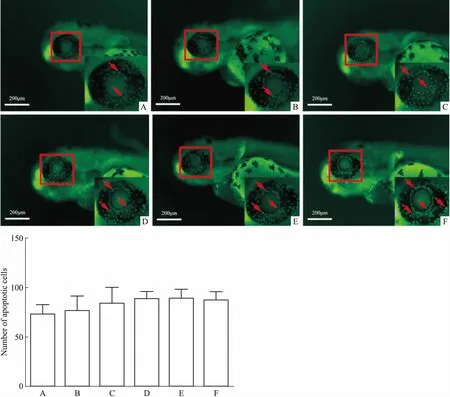
3.3 不同浓度DBP对54 hpf的斑马鱼眼部细胞凋亡的影响在上述实验中,实验结束时间为受精后48 h,斑马鱼幼鱼还未完全出卵,拍照前需要用链霉蛋白酶E破卵。为了排除其影响,延长造模前的培养时间,选择54 hpf的斑马鱼进行DBP造模18 h,即斑马鱼受精72 h,此时斑马鱼幼鱼已经完全出卵,不需要链蛋白酶E破卵。结果发现(Fig 3),72 hpf的斑马鱼空白组眼部会产生自发凋亡,此时在相同造模条件下观察,模型组与空白组比较,差异不明显。因此,最终选择30 hpf作为斑马鱼眼部细胞凋亡的开始造模时间。
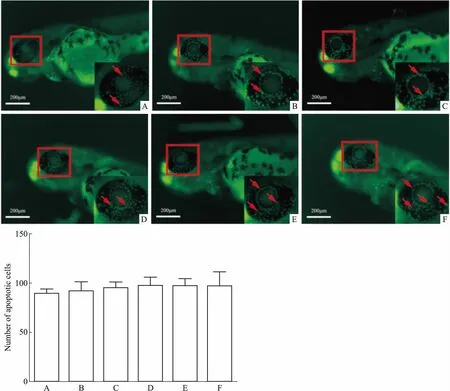
3.4 光照对斑马鱼眼部细胞凋亡的影响为了探究斑马鱼在72 hpf生长过程中自身眼部细胞凋亡的原因,在斑马鱼的培养过程中采用非直射光照,探究直射光与非直射光对斑马鱼眼部细胞凋亡的影响。结果发现(Fig 4),非直射光照对斑马鱼眼部细胞凋亡没有明显改善作用。故在建立斑马鱼眼部细胞凋亡模型构建过程中,可以采取正常的斑马鱼培养光照条件。
综上所述,在30 hpf的斑马鱼幼鱼中,10、50 μmol·L-1DBP造模可见更为明显的眼部细胞凋亡,且此时空白组斑马鱼幼鱼未产生自发性的眼部细胞凋亡,但是高浓度DBP(50 μmol·L-1)会影响斑马鱼幼鱼的存活率,故最终选择在正常温度及光照培养条件下,30 hpf的斑马鱼,10 μmol·L-1DBP造模18 h,作为斑马鱼眼部细胞凋亡模型的造模条件。
A:Control;B:0.1 μmol·L-1DBP;C:1 μmol·L-1DBP;D:5 μmol·L-1DBP;E:10 μmol·L-1DBP;F:50 μmol·L-1DBP
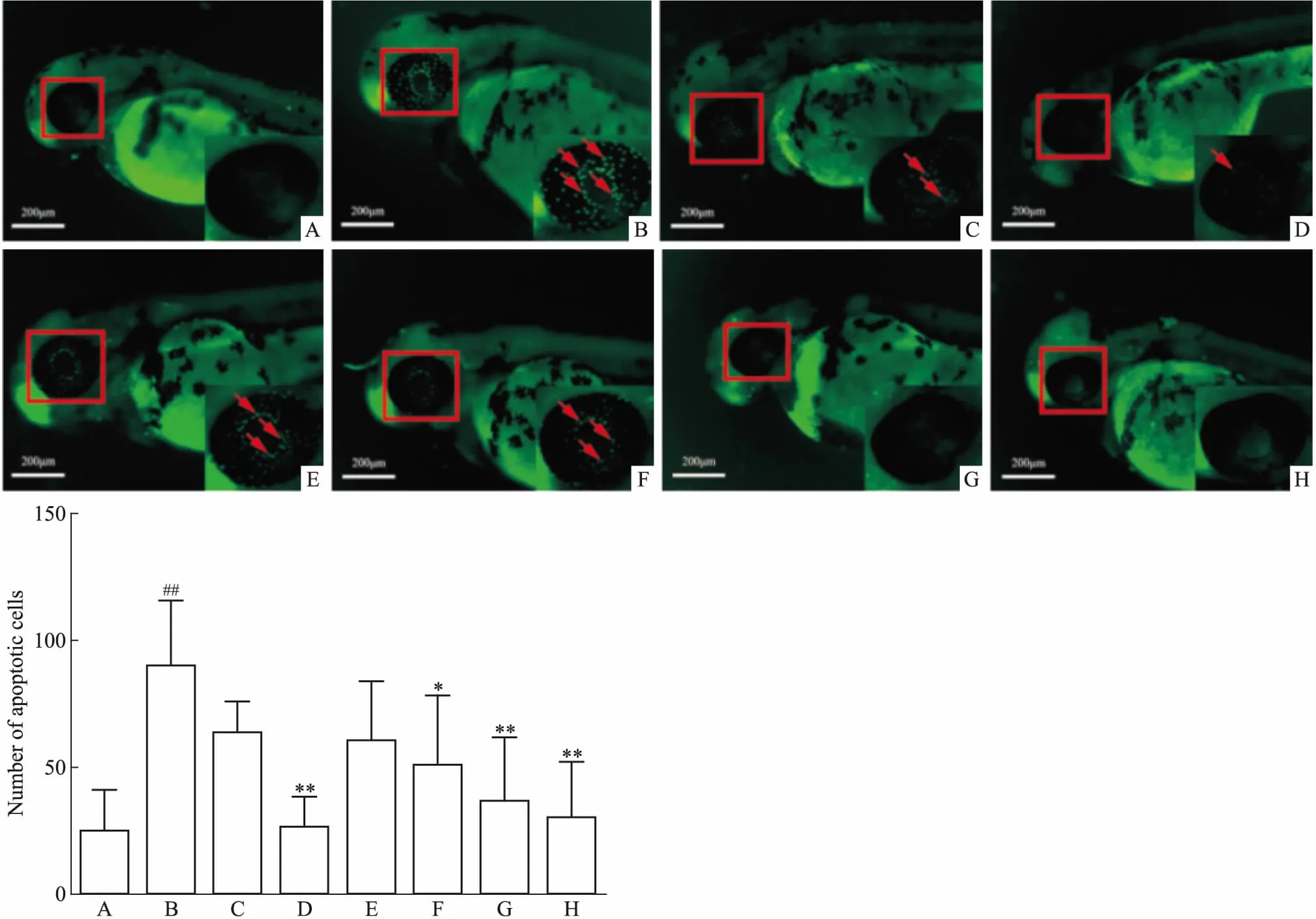
3.5 抗凋亡药物对斑马鱼眼部细胞凋亡的影响在30 hpf的斑马鱼培养基中加入10 μmol·L-1DBP与不同浓度人参皂苷Rg1或NAC共培养18 h。Fig 5结果表明,模型组与空白组相比,斑马鱼眼部细胞凋亡明显(P<0.01)。与模型组相比,NAC(1 mmol·L-1)和人参皂苷Rg1(1、5、50 μmol·L-1)都能以浓度依赖的方式明显缓解眼部细胞凋亡(P<0.05)。
4 讨论
斑马鱼已成为研究脊椎动物发育和疾病遗传机制越来越受欢迎的模式生物。70%的人类基因至少有1个斑马鱼直系同源物,84%的已知人类致病基因具有斑马鱼对应物[6]。其眼发育具有时空特异性,在受精后24 h时,循环系统、脑发育和眼发育形成,48 h时开始出卵膜,具有视功能,相当于人类新生儿时期[7]。在本研究中,DBP构建斑马鱼眼部细胞凋亡模型的周期仅48 h,与用传统哺乳动物造模相比,大大缩短了实验周期,为与眼部细胞凋亡相关的眼部用药的研究提供了快速筛选模型。另一方面,斑马鱼易于饲养,并可低成本大量繁殖,每对斑马鱼每周可产100~200只鱼卵[3],这一生殖特性极大地节约了实验成本。
DBP已经在多种工业使用了50多年,是最常用的增塑剂,主要用于软质聚氯乙烯(PVC),在最终产品中最多可占40%。长期暴露于DBP会对动物产生发育和生殖毒性。DBP在体内可减少超氧化物歧化酶、过氧化氢酶,升高丙二醛,造成DNA损伤,引起细胞凋亡[5]。在斑马鱼从幼鱼向成鱼生长过程中,DBP会导致卵黄蛋白原合成减少[8]。在斑马鱼成鱼中,DBP延迟睾丸的发育,减少精子产生,这种影响在除去DBP,用清洁水净化30 d后可以部分恢复[9]。在本实验中,30 hpf的斑马鱼幼鱼暴露在10 μmol·L-1DBP中,采用AO染色技术,在体式荧光显微镜下观察斑马鱼眼部凋亡细胞,可见随剂量和造模时间的增加,凋亡细胞呈绿色荧光从眼球中心由内向外发散。在此基础上,用抗凋亡药物NAC和人参皂苷Rg1验证该模型能否用于眼部用药的药效评价。NAC直接保护DNA免受氮芥、硫芥等烃化剂的损伤,阻止烃化剂引起的细胞凋亡,在氧化应激引起的细胞损伤中起抗凋亡作用[10]。而人参皂苷Rg1是人参的主要活性成分,已有研究发现,人参皂苷Rg1具有较好的抗凋亡、抗衰老作用[11]。NAC和人参皂苷Rg1都能够明显减少DBP导致的斑马鱼眼部细胞凋亡。上述实验证实,DBP引起的眼部细胞凋亡是可被药物逆转的,这为斑马鱼用于眼部疾病研究的可行性及合理性提供了可靠的实验依据。已有实验证实,敲除斑马鱼HSF1或gdf6a基因,可造成斑马鱼眼部细胞凋亡[12-13],但是由于基因敲除后对机体的影响未知,是否适用于眼部用药筛选有待进一步研究。

综上所述,应用DBP建立斑马鱼眼部细胞凋亡模型,具有灵敏、高效、便捷、低成本、周期短等特点,为眼部疾病的治疗药物研究提供新方法。

